можно ли вырастить ребенка в пробирке
Человек или имитация: как ученые выращивают эмбрионы для экспериментов
Эмбриологи создали из клеток кожи первую модель эмбриона человека на ранней стадии развития. Это позволит обойти запрет на такого рода опыты в большинстве стран. Рассказываем, можно ли считать зародышем такой организм, как его создали и чем он поможет науке.
Читайте «Хайтек» в
О каких эмбрионах идет речь?
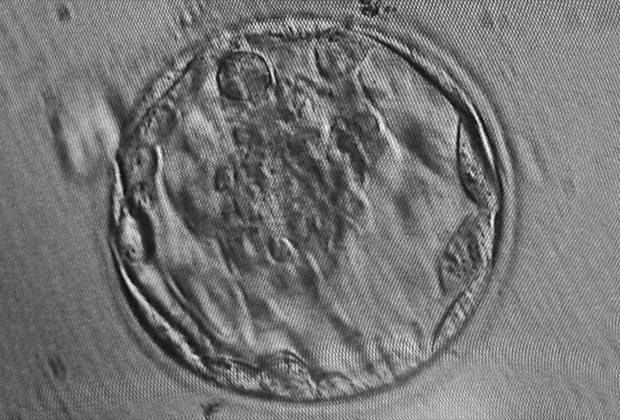
О бластоцисте. Это ранняя стадия развития зародыша млекопитающих (в том числе человека). Стадия бластоцисты следует за стадией морулы и предшествует стадии зародышевого диска. Стадия бластоцисты относится к преимплантационному периоду развития, то есть самому раннему периоду эмбриогенеза млекопитающих (до прикрепления зародыша к стенке матки).
В эволюции млекопитающих бластоциста как стадия развития возникла для обеспечения имплантации, а также для организации пространственной основы формирования зародышевого диска при отсутствии желтка.
Стадия бластоцисты не гомологична стадии бластулы. Стадия бластулы следует в онтогенезе млекопитающих позже (зародышевый диск), в т. н. «первую фазу гаструляции», но традиционно термин «бластула» к млекопитающим и другим амниотам не применяют. Соответственно распространенной ошибкой является употребление слова «бластоцель» по отношению к полости бластоцисты.
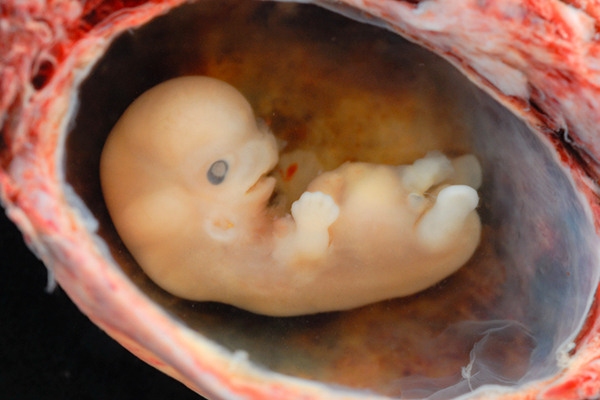
Внешне бластоциста представляет собой шар, состоящий из нескольких десятков или сотен клеток. Размер бластоцисты колеблется от долей миллиметра (0,1 мм у грызунов и человека) до нескольких миллиметров (у непарнокопытных).
Бластоциста состоит из двух клеточных популяций: трофобласта (трофэктодермы) и эмбриобласта (внутренней клеточной массы). Трофобласт формирует внешний слой эмбриона — полый шар или пузырек.
Эмбриобласт формирует внутренний слой бластоцисты, располагается внутри трофобластатического пузырька в виде скопления клеток у одного из полюсов шара (внутренняя клеточная масса).
Трофобласт участвует в имплантации (прикрепление эмбриона к эпителию матки, инвазия внутрь эндометрия матки, иммуносупрессорное действие, разрушение кровеносных сосудов), а также в формировании эктодермы ворсинок хориона (эктодермальная часть плаценты).
Эмбриобласт дает начало собственно телу плода, а также мезодермальным и энтодермальным структурам внезародышевых органов (желточному мешку, аллантоису, амниону, мезодермальной части хориона).
Партеногенез
Обычно эмбрионы в лабораторных условиях выращивают из донорских оплодотворенных яйцеклеток. В случае клонирования от сперматозоидов можно отказаться.
Начиная с середины десятых годов стало понятно, что вырастить зародыши в пробирке можно без участия половых клеток вообще. Бластоциста состоит из трех типов клеток, из которых потом формируются ткани плода, плацента и желточный мешок. А получают все это из стволовых клеток.
В начале 2000 гг. было показано, что обработкой in vitro ооцитов млекопитающих (крыс, макак, а затем и человека) либо предотвращением отделения второго полярного тельца при мейозе возможно индуцировать партеногенез, при этом в культуре развитие можно довести до стадии бластоцист.
Полученные таким образом бластоцисты человека потенциально являются источником плюрипотентных стволовых клеток, которые могут быть использованы в клеточной терапии.
В 2004 году в Японии слиянием двух гаплоидных ооцитов, взятых у разных особей мыши, удалось создать жизнеспособную диплоидную клетку, деление которой привело к формированию жизнеспособного эмбриона, который, пройдя стадию бластоцисты, развился в жизнеспособную взрослую особь.
Предполагается, что этот эксперимент подтверждает участие геномного импринтинга в гибели эмбрионов, образующихся из ооцитов, полученных от одной особи, на бластоцистарной стадии.
Беременность стволовыми клетками
Исследователи из Утрехтского университета создали мышиный эмбрион из стволовых клеток двух типов — эмбриональных и трофобластных. У выращенной ими бластоцисты сформировались все типы клеток, необходимые для дальнейшего развития.
Более того, при имплантации в матку животного бластоциста вызывала беременность. Правда, авторы работы подчеркивали, что у них получился не совсем настоящий зародыш и потому самка не смогла бы его выносить и родить.
В 2019 году ученые из Института биологических исследований Солка также инициировали беременность у мышей, пересадив им эмбрионы, полученные всего из одной соматической клетки. Ее взяли из организма взрослого животного, перепрограммировали и размножили — таким образом появилась культура зародышевых стволовых клеток.
Затем их перепрограммировали еще раз, превратив в так называемые улучшенные плюропотентные клетки, и обработали коктейлем из специальных сигнальных веществ — тех, которые при естественном эмбриональном развитии вызывают дифференцировку трофобласта (из него формируется плацента) и внутренней клеточной массы (из нее образуются ткани зародыша).
В результате в 15% случаев из них вырастали бластоиды — структуры, аналогичные бластоцистам по клеточному составу и экспрессии генов.
Статус человеческого эмбриона
Вопрос о статусе человеческого эмбриона рассматривается, среди прочего, в рамках биоэтики. Ключевое значение при таком рассмотрении имеет признание или непризнание «человеческого» содержания у эмбриона.
На данный момент статус эмбриона в российском законодательстве не до конца ясен, поскольку трудно «ответить на вопрос о том, воспринимает ли право идею существования эмбриона как субъекта правоотношений».
В частности закон «О трансплантации органов и (или) тканей человека» рассматривает эмбрионы как разновидность человеческих органов, хотя его действие на эмбрионы не распространяется. Далее существует представление о невозможности считать эмбрион человеком, «так как он не обладает правоспособностью».
В то же время юридическая мысль признает, что к человеческим органам эмбрион отнесен быть не может, поскольку является новым организмом со своими собственными органами.
Осознается и тот факт, что «в эмбрионе заложены все основы жизни». Таким образом, ситуацию следует признать сложной в силу двойственности правовой природы эмбрионов, что создает серьезные правовые проблемы, ибо «возникает вопрос о том, может ли эмбрион быть объектом правоотношений».
Эмбрионы становятся предметом имущественных споров в разных странах, включая США. Весьма известно так называемое дело Дэвисов (слушалось в 1989 году в штате Теннеси), когда в процессе раздела имущества разводящихся супругов возник вопрос о правах на ранее замороженные эмбрионы.
В итоге суд передал эмбрионы матери во временное владение для целей имплантации. Кроме того, суд установил, что человеческая жизнь начинается с момента зачатия и что по этой причине эмбрион не является объектом права собственности.
Однако в другом деле, которое слушалось в Нью-Йорке в 1995 году, эмбрионы были переданы бывшей жене в собственность. Известен также случай, когда супруги требовали изъять из лаборатории ранее переданный ими на исследование эмбрион.
В итоге суд потребовал передать эмбрион супругам, не обнаружив, однако наличия права собственности и подтвердив, «что человеческий эмбрион не является объектом права собственности».
Таким образом, американская правовая мысль в принципе готова признать эмбрион объектом правоотношений, однако этот объект весьма специфичный: как правило, суды не признают право собственности на эмбрионы, поскольку последние являются началом новой человеческой жизни.
В дискуссиях о приемлемости или неприемлемости тех или иных манипуляций с эмбрионами важное место занимает понятие прав эмбриона. В частности запрет на использование эмбриона или эмбриональных тканей в целях медицинских исследований основан на признании таких прав.
Их защитники, сторонники так называемой консервативной позиции, ссылаются на то, что с момента зачатия человеческая жизнь свята и неприкосновенна, а также утверждают, что эмбрион обладает всеми человеческими правами.
Сторонники так называемой либеральной позиции даже на самых поздних стадиях беременности отказываются признавать самостоятельный статус плода, а решение его судьбы отдается матери или медикам.
Естественные неотчуждаемые права человека включают, среди прочего, право на жизнь. Вопрос о том, каков момент возникновения права на жизнь, от которого и берет свой отсчет правосубъектность, крайне важен для уголовного и гражданского права и для юриспруденции в целом.
Существует представление, согласно которому правовой статус эмбриона должен определяться на основе того факта, что эмбрион является началом новой жизни, а не частью человеческого организма. Сторонники этой позиции исходят из того, что человек как новое существо ( биологический индивидуум) возникает сразу после слияния родительских половых клеток.
Зачем выращивать эмбрионы?
Для того, чтобы обойти довольно суровые правила, напрямую запрещающие создавать зародыши человека в исследовательских целях. А без этого невозможно разобраться, что на самом деле происходит на ранних стадиях развития.
Вполне вероятно, что общество в целом будет относиться к исследованиям на таких моделях более терпимо, чем к опытам над настоящими эмбрионами, считают в редакционной статье Nature исследователи из Мичиганского университета (США). Пока главный этический вопрос, который стоит решить, — применимо ли к ним правило 14 дней.
Сегодня человеческие эмбрионы, полученные экспериментально, уничтожают через 14 дней после оплодотворения. В одних странах нарушение этой нормы карается законодательно, в других — опыты с подобными зародышами отклоняют этические комитеты и лишают финансирования.
Если же в отношении бластоидов запрет отменят, то ученым, вероятно, удастся разобраться не только с причинами выкидышей и неудачами при ЭКО, но и выяснить механизмы целого ряда наследственных патологий — в том числе сердечно-сосудистых заболеваний и некоторых типов диабета.
Бог из пробирки Эмбрион впервые вырастили вне утробы матери
Биологам впервые удалось вырастить в пробирке эмбрионы, достигшие стадии внедрения в стенку матки. До этого исследователи получали зародышевые тельца, которые не развивались дальше этого этапа. Теперь специалисты могут создавать удобные платформы для изучения развития животных и человека, а также решить проблемы разработки искусственной утробы. «Лента.ру» рассказывает о научной работе ученых из Кембриджского университета, опубликованной в журнале Science.
Развитие позвоночных животных от одной клетки до многоклеточного организма — процесс очень сложный. В нем несколько стадий, в результате которых формируются различные группы влияющих друг на друга клеток. Хотя во всех одна и та же ДНК, от их местоположения в зародыше зависит то, какие гены будут активными. Это, в свою очередь, определяет функции клеток в тканях формирующегося организма.
Материалы по теме
Геноцид во благо
У млекопитающих развитие эмбриона может происходить как в теле матери, так и в яйце (у ехидны и утконоса). Зародыш возникает при оплодотворении ооцита (яйцеклетки). После этого происходит ее дробление — ряд делений с образованием все более мелких клеток (бластомеров). В результате формируется морула — шар, все внутреннее пространство которого заполнено 16-ю бластомерами.
За стадией морулы следует стадия бластоцисты. Бластомеры продолжают делиться, все более уплотняясь и образуя полую сферу. В ней запускается процесс дифференцировки клеток, и образуются два типа клеток: трофобласт, формирующий внешний слой бластоцисты, и эмбриобласт (внутренняя клеточная масса), находящийся внутри нее. Эмбриобласт создает компактное образование у одного из полюсов бластоцисты.
На стадии бластоцисты в клетках зародыша происходят процессы, которые устанавливают оси симметрии, а также регулируют экспрессию генов, что на следующих этапах приведет к формированию различных тканей. Эмбрион, который ранее напоминал сферу, становится асимметричным. Трофобласт дает начало экстраэмбриональным (внезародышевым) тканям, из которых затем образуются плацента, желточный мешок и амнион. Из эмбриобласта развиваются еще две группы клеток — эпибласт и гипобласт.
Из эпибласта в итоге формируется тело будущего организма. Однако это происходит только при том условии, что клетки данной группы взаимодействуют с внезародышевыми тканями. Гипобласт способствует образованию некоторых внезародышевых структур, в том числе примитивной энтодермы, которая дает потом висцеральную энтодерму, окружающую эпибласт и выполняющую регуляторные функции.
После того как бластоциста внедряется в слизистую матки в процессе беременности, структура зародыша меняется, постепенно усложняясь. Клетки эпибласта упорядочиваются, образуя форму розетки. Внутри возникает полость. Трофобласт в это время превращается во внезародышевую эктодерму (ExEc), в которой также есть полость. В конце концов обе полости соединяются. Кроме того, возникают мезодерма и первичные половые клетки, образуется зародышевый цилиндр.
Эпибласт состоит из эмбриональных стволовых клеток (ЭСК), способных дифференцироваться в три зародышевых листка: эктодерму, мезодерму и энтодерму. Клетки этих трех слоев — плюрипотентные, то есть могут превратиться во все типы клеток взрослого организма. Именно поэтому ЭСК используются для создания зародышеподобных структур — эмбриоидов. Они помогают понять механизмы развития плода, однако проблема в том, что в них не воспроизводятся процессы, протекающие in vivo (в живом организме) после внедрения в стенку матки.
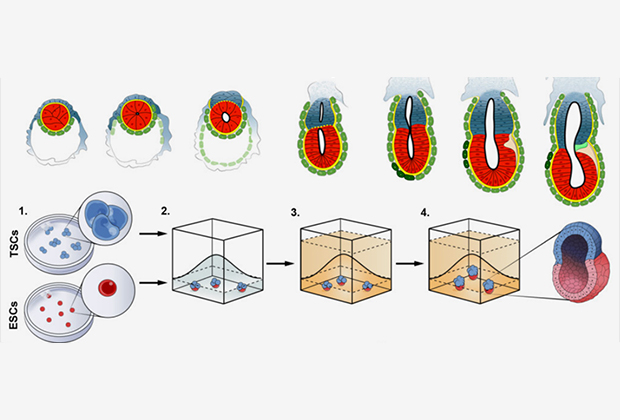
Ученые решили убедиться в том, что внезародышевые ткани обеспечивают дальнейшее развитие эмбриона, проведя соответствующие эксперименты in vitro (в пробирке). Взяли эмбриональные стволовые клетки и небольшие группы стволовых клеток из трофобласта (ТСК) — предшественников клеток внезародышевых органов. Из них были получены клеточные культуры, имитирующие взаимодействие эпибласта с трофобластом. Связи между клетками осуществлялись через трехмерные внеклеточные структуры из коллагенового матрикса «Матригель».
Матрикс заменял в культуре примитивную энтодерму, обеспечивая поляризацию клеток эпибласта и формирование полости. Оказалось, что в этих условиях ЭСК и ТСК образовывали форму, напоминающую зародышевый цилиндр и характерную для эмбрионов мышей после имплантации. Однако была не только внешняя схожесть. Тщательный анализ морфологии, размера, числа клеток и активности генов, характерных для определенных клеточных линий, показал, что в эмбрионах как in vivo, так и in vitro присутствовали отдельные структуры, полученные из стволовых клеток эпибласта и трофобласта.
Исследователи выделили несколько этапов развития зародыша в пробирке. Сначала наблюдается спонтанная самоорганизация, которая приводит к поляризации клеток и образованию полостей внутри эмбриональной и экстраэмбриональной частей зародыша. Затем полости объединяются в один большой эквивалент проамниотической полости. Потом две группы стволовых клеток взаимодействуют через сигнальный путь Nodal. Сигналами служат белки, участвующие в эмбриональной индукции; они направляют развитие отдельных частей зародыша — например, способствуют формированию нервной системы. Все завершается выделением костного морфогенетического белка, который индуцирует образование клеток, напоминающих первичные половые клетки.
Результаты исследования важны для решения проблемы создания искусственной утробы. В этом устройстве можно было бы вынашивать зародыши без участия живого существа. Однако до сих пор известны не все факторы, влияющие со стороны организма матери на дифференцировку клеток. Например, пока совершенно непонятна роль имплантации бластоцисты. Культивирование плодов in vitro в постимплантационный период невозможно без изучения того, что происходит с клетками зародышей в этот период. Новые эмбриоиды позволят проводить соответствующие исследования.
«ЭКО-поколение» в России: как детей выращивают в пробирках
МОСКВА, 20 дек — РИА Новости. Ежегодно в научном Центре акушерства и гинекологии имени Кулакова врачи проводят около 2 тысяч циклов экстракорпорального оплодотворения (ЭКО), рассказала РИА Новости руководитель отделения вспомогательных репродуктивных технологий в лечении бесплодия Елена Калинина.
Корреспонденты РИА Новости побывали в лаборатории Центра, в котором в 1986 году появился на свет первый в России ребенок из поколения ЭКО, и где с тех пор детей бережно выращивают в пробирках, как цветы.
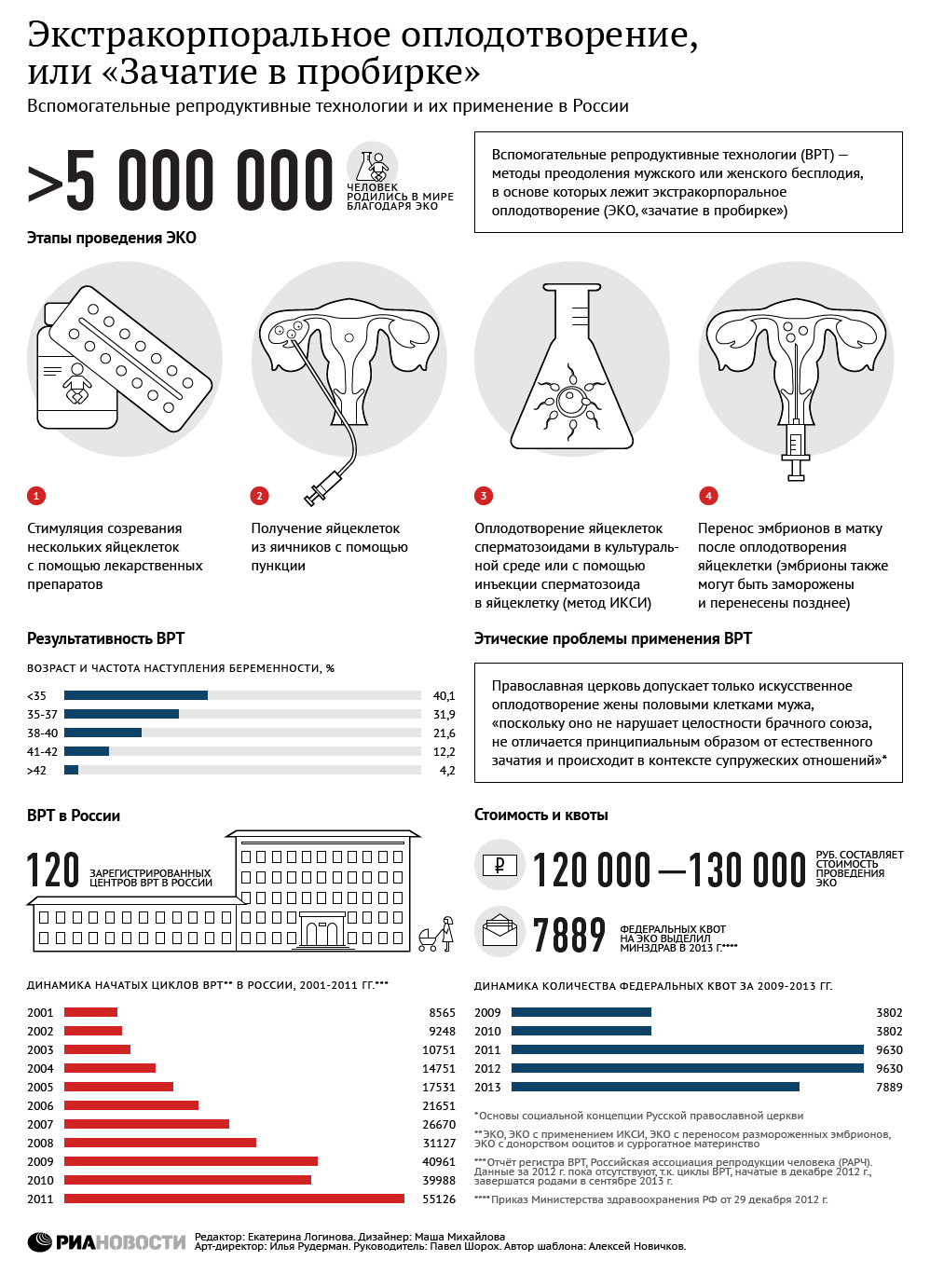
Экстракорпоральное оплодотворение (ЭКО) — «искусственное оплодотворение», вспомогательная репродуктивная технология, используемая в случае бесплодия.
В термостате тепло и уютно
Перед закрытой стеклянной дверью в небольшом коридорчике, скрестив пальцы за спиной, сидят три женщины в стерильных халатах и шапочках и взволнованно ждут, когда их вызовет врач. Скоро каждая из них станет участницей медицинского таинства — современного непорочного зачатия. И они втроем мысленно обращаются к небесам, чтобы там услышали молитвы и подарили счастье — стать мамой.
Новая жизнь во время ЭКО зарождается не в утробе матери, а в специальной чашке под микроскопом. За слиянием яйцеклетки и сперматозоида, как за остросюжетным фильмом, опытные врачи следят по монитору компьютера.
Сразу после оплодотворения человеческие эмбрионы помещают в термостат. Внутри — идеальная питательная среда для развития будущего малыша: сахара, аминокислоты, антибиотики. И идеальная температура — такая же, как в организме только что забеременевшей женщины: 37 градусов. Каждый термостат рассчитан на четыре пациентки, однако перепутать эмбрионы невозможно, утверждает врач Калинина. Все они хранятся в индивидуальной ячейке, на крышке которой указана фамилия женщины и дата оплодотворения.
Почти пять дней мама находится только в субъективном психическом контакте с будущим ребенком, которого на исходе пятых суток иногда можно увидеть невооруженным глазом, как крохотную, меньше, чем полмиллиметра, точку. Точнее ее размер исчисляется приставкой «нано». И только через трое-пятеро суток после оплодотворения с помощью врачей начинается физическое сближение, и малыш, наконец, воссоединяется с мамой. Шансы на успешную беременность повышаются, если женщине подсаживают сразу два эмбриона. Именно поэтому в 20% случаев после ЭКО рождаются двойни.
Оставшиеся и неиспользованные после оплодотворения эмбрионы отдают в заботливые руки хранительницы криобанка, которая заморозит их и будет «нянчить», пока семейная пара не решится родить братика или сестричку своему первенцу.
«ЭКО — достаточно дорогостоящая процедура и связана с повышенной гормональной нагрузкой на женщину. Чтобы не прибегать к ЭКО в следующий раз, родители могут заморозить полученные эмбрионы и использовать их, например, через два года или через пять лет», — пояснила Калинина.
Замороженное счастье
«В природе все удивительно, ведь если заморозить эмбрионы или сперму в обычном холодильнике при температуре минус 18 градусов, они погибнут, а экстремально низкие температуры позволяют десятилетиями сохранять клетки живыми», — рассказала кандидат биологических наук, научный сотрудник отделения ЭКО Виктория Замятнина.
В криобанке хранится сперма примерно тысячи разных мужчин, причем некоторые образцы заморожены еще в 1998 году. Обычно мужчины оставляют свой биоматериал по трем причинам: желание стать донором, необходимость заранее сдать сперму для ЭКО или перед химиотерапией, результатом которой может стать необратимое бесплодие.
Не все зависит от врачей
Замораживать яйцеклетки в России начали не более пяти лет назад. В отличие от сперматозоидов, женские половые клетки — более нежная структура, и сохранить их жизнеспособность гораздо сложнее. Поэтому создание банка яйцеклеток в центре Кулакова только планируется.
«По закону женщина может воспользоваться донорской яйцеклеткой, но мы не имеем права говорить, чья это яйцеклетка», — сказал РИА Новости главный врач центра имени Кулакова Виктор Тютюнник.
Если генетическая мать по медицинским показаниям не в силах выносить своего ребенка, взрастить этого малыша в утробе ей может помочь биологическая мама. Практика привлечения суррогатных мам началась в центре около 10 лет назад. «За последние пять лет у нас было чуть больше 100 случаев суррогатного материнства. В 2009-2010 годах около 35 суррогатных матерей вступали в программу, но в этом году только девять», — заметил Тютюнник.
Как правило, для криоконсервации у одной женщины берут около пяти яйцеклеток, но из этих пяти яйцеклеток только одна может быть способна к оплодотворению после размораживания. «Так что не все зависит от врачей, если хотите, на все воля Божья. И даже заморозив однажды свои яйцеклетки, женщина не может быть до конца уверена, что сможет их успешно оплодотворить через несколько лет», — заметила Замятнина.
Судьба эмбриона
Работать с замороженными эмбрионами, каждый из которых через несколько лет имеет шанс превратиться в ребенка, нужно только с любовью и крайне осторожно. Если сперму можно доставать из дюара на несколько секунд, то эмбрионы такого обращения не перенесут и погибнут. Поэтому все манипуляции с биоматериалом проводятся только в жидком азоте. У криохранительницы непременно должны быть ловкие руки, при необходимости она за полсекунды может перенести эмбрионы из дюара в ванночку с жидким азотом для дальнейших манипуляций.
Однако не все эмбрионы «родятся» в будущем. Время проходит, родители стареют и уже не хотят вынашивать своих будущих детей, полученных и замороженных во время ЭКО. По словам Замятниной, редко, но все же случается, что эмбрионы приходится уничтожать. Это одна из причин, почему религиозные организации не приемлют такого способа лечения бесплодия как экстракорпоральное оплодотворение. Гуманно ли убивать ненужные генетическим родителям живые человеческие эмбрионы и кто несет ответственность за это решение?
«Можно я не буду отвечать? Это очень моральный вопрос», — сказала Замятнина.
«Дети из пробирки»: 40 лет революционному методу ЭКО
Автор фото, Reuters
Вопросы экстракорпорального (то есть «вне тела», в пробирке) оплодотворения занимали Эдвардса с начала 1960-х. Именно тогда он стал проводить первые эксперименты с яйцеклетками животных, полагая, что в один прекрасный день сможет помочь бездетным семьям произвести на свет собственного ребенка.
Но только после встречи с гинекологом и одним из пионеров лапароскопии Патриком Стептоу и нескольких лет их совместных поисков стал реализовываться разработанный им новый поступенчатый метод ЭКО (IVF).
Автор фото, Reuters
Профессор Роберт Эдвардс и первый «ребенок из пробирки» Луиза Джой Браун в 2003 г.
Несмотря на успех нового метода и рождение Луизы Джой, коллеги-ученые и общество в целом, не говоря уже про церковные круги, были настроены если не отрицательно, то резко скептически.
Именно поэтому, хотя женщин-добровольцев, готовых испытать любую новую методику, лишь бы забеременеть, у Эдвардса и Стептоу было достаточно, первые годы экспериментов, а впоследствии и лечения, проходили чуть ли не в полусекретной обстановке.
ЭКО: КАК ЭТО РАБОТАЕТ:
1. Подавление естественного менструального цикла у женщины с помощью гормональных препаратов
2. Стимуляция яичников с целью произвести как можно больше яйцеклеток с помощью ежедневных гормональных инъекций (10-12 дней)
3. Сбор яйцеклеток из обоих яичников с помощью УЗИ
4. Оплодотворение в чашке Петри спермой супруга или донора
5. Имплантация шестидневного эмбриона (или двух-трех) в матку с помощью катетера
В обстановке секретности и дороговизны
Грейс Макдональд, мать второго ребенка, зачатого с помощью ЭКО, об экспериментальном методе лечения бесплодия Эдвардса и Стептоу узнала случайно в 1978 году из медицинского журнала Lancet и прилетела в лабораторию на крыльях надежды.
Впоследствии в интервью газете Guardian она вспоминала, что тогда женщин-добровольцев просили хранить все процедуры в тайне, ради их же собственной безопасности, поскольку взгляд на вспомогательные способы репродукции был похож на тот, который сегодня царит в отношении, скажем, клонирования.
Грейс забеременела со второй попытки ЭКО и родила мальчика в феврале 1979 года.
Изначально Эдвардс и Стептоу намеревались предложить этот метод британской Национальной службе здравоохранения (NHS) и делать его бесплатно, но официальная медицина в те годы этого сторонилась, и тогда врачи открыли небольшую клинику в пригороде Кембриджа.
Для процедуры ЭКО могут использоваться как собственные яйцеклетки и сперма супругов, так и донорские
Конец истории Подкаст
Лечение стоило в то время 3 тыс. фунтов, тогда как среднегодовой доход в Британии был порядка 6 тыс. фунтов, а коэффициент успешности составлял всего 12%. Но несмотря на все эти препоны, недостатка в пациентках в новой клинике не было.
Более того, женщинам после подсадки эмбриона в течение какого-то времени рекомендовалось в буквальном смысле передвигаться на карачках и не принимать вертикального положения, чтобы увеличить шансы наступления беременности.
Несмотря на несовершенство этой процедуры, слухи о счастливых мамах росли, и в клинику Эдвардса и Стептоу потянулись как воодушевленные шансом на успех женщины, так и коллеги-врачи, чтобы посмотреть и перенять методику.
Их заслуги перед медициной в целом и бесплодными семьями, заполучившими свой наиценнейший в жизни подарок, были в конце концов признаны как медицинскими кругами, так и государством, правда, много лет спустя, когда Патрика Стептоу уже не было в живых: в 2010 году профессор Эдвардс получил Нобелевскую премию по медицине, а в 2011-м и британский титул рыцаря-бакалавра.