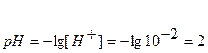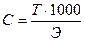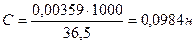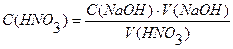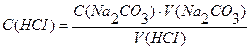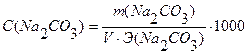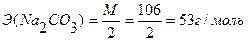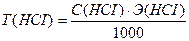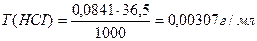что такое скачок титрования
Скачок титрования является самой существенной частью кривой титрования, т.к. на нём всегда лежит точка эквивалентности.
С помощью него осуществляют выбор индикатора, решают некоторые другие вопросы.
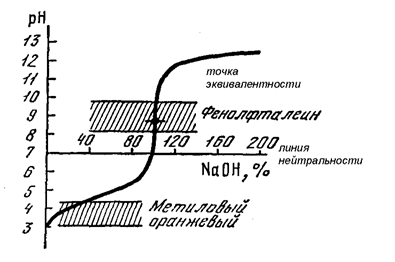
Чем больше скачок титрования, тем точнее будут результаты анализа и более широкий выбор индикаторов для его проведения.
На величину скачка титрования влияют, в первую очередь, кислотные и основные свойства исходных веществ, их содержание в растворе, а также температура реакционной среды.
Повышение температуры оказывает существенное влияние на скачок титрования в сторону его уменьшения вследствие возрастания константы диссоциации воды. Отсюда следует, что кислотно-основное титрование лучше проводить, не прибегая к нагреванию.
Для титрования можно использовать только те индикаторы, интервал перехода которых полностью лежит на скачке титрования. Причём, чем более симметрично он расположен относительно точки эквивалентности, тем более предпочтительным является данный индикатор (в идеале точка эквивалентности должна лежать в середине интервала перехода). Показатель титрования (рТ) индикатора при этом тоже будет лежать на скачке титрования и может отклониться от точки эквивалентности в ту или иную сторону. Наиболее оптимальным является случай, когда рТ индикатора совпадает на графике с точкой эквивалентности, но это происходит далеко не всегда. В случае несовпадения значений рН для рТ индикатора и точки эквивалентности возникает так называемая индикаторная ошибка, связанная с недотитровыванием части исследуемого раствора или, наоборот, с добавлением небольшого избытка титранта. Однако следует подчеркнуть, что если рТ индикатора лежит внутри скачка титрования, то индикаторная ошибка составляет не более 0,3% и, таким образом, существенно не влияет на результаты анализа.
Сопоставляя данные таблицы 1 и вид графика на рис. 15, можно сделать вывод, что при титровании соляной кислоты щёлочью (NаOH) в качестве индикатора можно использовать метиловый оранжевый (рТ≈4) или фенолфталеин (рТ≈9). В первом случае рТ индикатора будет иметь меньшее значение, чем рН в точке эквивалентности, и мы будет немного не дотитровывать кислоту. Во втором случае рТ индикатора лежит выше точки эквивалентности на скачке титрования. Вследствие этого мы добавим щелочи немного больше, чем нужно (другими словами, мы слегка перетитруем исследуемый раствор).
При титровании слабой кислоты (СН3СООН) сильным основанием (NаOH) точка эквивалентности смещается в щелочную область (рН>7) из-за гидролиза образующейся соли (СН3CООNa) и лежит выше линий нейтральности на кривой титрования с проходящим через рН = 7 и параллельной оси абсцисс (рис. 16). Скачок титрования становится менее выраженным. Например, при сравнении с предыдущим случаем (рис. 15) он уменьшается на 3 единицы рН. Уменьшение (сужение) скачка титрования выражено тем сильнее, чем более слабой является исследуемая кислота. Для кислот, имеющих значение (рКа>7), скачок титрования будет практически отсутствовать, т.е. он выродится в точку перегиба на кривой титрования. Такие кислоты нельзя количественно измерить в водном растворе с помощью титриметрии. Необходимо использовать в этом случае неводное титрование, т.е. в растворителе, который бы значительно усилил кислотные свойства слабой кислоты.
Рис. 16. Кривая титрования слабой кислоты (СН3СООН)
сильным основанием (NaOH)
Как видно из рис. 16, метиловый оранжевый нельзя использовать в качестве индикатора при титровании уксусной кислоты или любой другой слабой кислоты, т.к. его интервал перехода лежит ниже скачка титрования. В противном случае мы будем получать заниженные результаты вследствие недотитровывания исследуемого раствора.
А вот интервал перехода фенолфталеина лежит внутри скачка титрования, поэтому его можно применять в качестве индикатора при титровании слабой кислоты. Соответственно, для этих же целей можно использовать и другие индикаторы, интервал перехода которых и величина рТ лежат в области значений рН >7: тимолфталеин, ализариновый красный и т.д. (табл. 1).
При взаимодействии слабого основания с сильной кислотой наблюдаются такие же отличительные способности (по сравнению с реакцией нейтрализации между сильными электролитами), как и при титровании слабой кислоты щелочью. Так, вследствие гидролиза соли, образующейся в ходе реакции, точка эквивалентности тоже не совпадает с точкой нейтральности, но смещается в данном случае уже в кислую область (рН 7, не укладывается в скачок титрования и лежит за его пределами. При использовании данных индикаторов мы будем перетитровывать исследуемый раствор и получать завышенные результаты анализа.
При взаимодействии слабой кислоты и слабого основания изменение рН происходит постепенно на протяжении всего процесса титрования. Скачок титрования на соответствующей кривой практически отсутствует, вследствие чего точно определить момент эквивалентности и подобрать для данного случая соответствующий индикатор становится невозможным.
На основании данного заключения в кислотно-основном методе анализа в качестве рабочих растворов (титрантов) не используют растворы слабой кислоты либо слабого основания.
Кривые титрования многоосновных (полипротонных)
кислот, многокислотных оснований и их солей
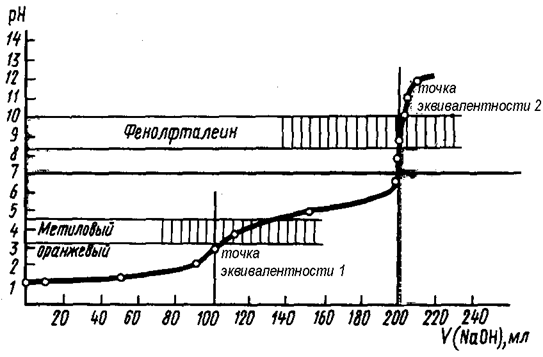
Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато. Кривые титрования данных соединений могут иметь в соответствии с этим несколько (два и более) скачков титрования и точек эквивалентности. На рисунке 18 представлена кривая титрования трёхосновной фосфорной кислоты (H3PO4) щелочью (NaOH). Отчётливо видно наличие двух скачков титрования. Первый из них соответствует достижению первой точки эквивалентности, когда кислота оттитровывается по первой ступени
с образованием однозамещённого дигидрофосфата натрия.
Второй скачок титрования соответствует взаимодействию кислоты с NaOH по второй ступени с образованием двухзамещённого гидрофосфата натрия:
Третий скачок титрования на графике, соответствующий реакции:
При необходимости можно оттитровать Н3PO4 по всем трём стадиям. Для этого в исследуемый раствор вводят CaCl2, в результате чего образуется малорастворимый Ca3(PO4)2
а выделившееся эквивалентное количество соляной кислоты титруют обычным способом.
Рис. 18. Кривая титрования трехосновной фосфорной кислоты (H3PO4) сильным основанием (NaOH)
Как следует из рис. 18, каждой стадии нейтрализации фосфорной кислоты соответствует свой индикатор. Если мы будем использовать метиловый оранжевый, то оттитруем фосфорную кислоту только по первой стадии. При использовании фенолфталеина оттитруем фосфорную кислоту как двухосновную с образованием двухзамещенной соли. Соли слабых многоосновных кислот и щелочных металлов при взаимодействии с сильными кислотами ведут себя как слабые основания, и кривые титрования таких веществ тоже имеют несколько точек эквивалентности и скачков титрования (рис. 19) вследствие ступенчатого протекания реакции:
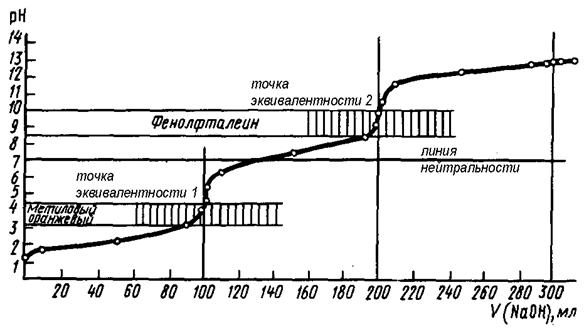
Na2CO3 + HCl = NaHCO3 + NaCl – точка эквивалентности 1
NaHCO3 + HCl = NaCl + CO2 + H2O – точка эквивалентности 2
Рис. 19. Кривая титрования раствора Na2CO3 сильной кислотой (HCl)
В смеси сильных кислот можно установить только их общую суммарную концентрацию, раздельное определение компонентов невозможно. Кривая титрования такой смеси не отличается от кривой титрования одной сильной кислоты (рис. 15).
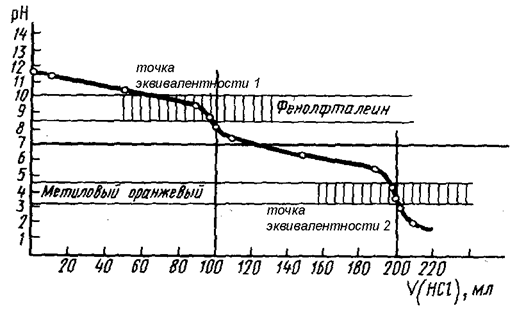
При титровании сильной кислоты в присутствии слабой наблюдаются два скачка титрования (рис. 20) и используются 2 индикатора, причём первой оттитровывается с использованием метилового оранжевого сильная кислота, и скачок титрования в данном случае невелик. Соответственно, и погрешность измерения может достигать нескольких процентов.
HCl + NaOH = NaCl + H2O – точка эквивалентности 1
CH3COOH + NaOH = CH3COONa + H2O – точка эквивалентности 2.
Зато скачок титрования, соответствующий нейтрализации слабой кислоты, является хорошо выраженным. При титровании в присутствии фенолфталеина можно точно определить суммарное содержание обеих кислот в смеси.
Титрование смеси нескольких слабых кислот практически не отличается от титрования многоосновной кислоты, подробно рассмотренной нами выше.
Рис. 20. Кривая титрования смеси кислот
(НСl и СН3СООН) раствором NaOH
Точное количественное определение более сильной кислоты в этой смеси возможно, если константы диссоциации присутствующих кислот различаются на четыре и более порядка.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ, реакции нейтрализации, скачок титрования, построение кривых титрования
МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ, реакции нейтрализации, скачок титрования, построение кривых титрованияТЕМА 9
Кривая титрования
графическое изображение зависимости изменения концентрации С (Х), определяемого в-ва Х или некоторого связанного с ним свойства системы (раствора) от объема V(Т) прибавленного титранта (Т).
Кулонометрическое титрование-измерение количества электричества, затраченного на выполнение электродной реакции. При этом титрующий агент (например. кислотно-основного типа) не прибавляется в виде стандартного р-ра, а образуется в р-те электродной реакции, т. е в результате электролиза при постоянном токе.
Титрование сильной кислоты сильным основанием:
в процессе титрования происходит постоянная, непрерывная нейтрализация к-ты. В точке «100» наступает полная нейтрализация. Т. к. соль сильного основания и сильной к-ты не способна к гидролизу, рН в этой точке равен 7 (кривая титрования на обороте).
При дальнейшем титровании в р-ре накапливается избыток щелочи и в этом случае рН р-ра рассчитывается по формулам 1 и 2. Титрование слабой к-ты сильным основанием:
в нулевой точке рН вычисляют по формуле 3. По мере титрования в среде накапливается ацетат натрия. Смесь слабой к-ты и ее соли представляет собой кислотный буферный р-р. Поэтому в интервале 10-99 мл прибавленного титранта рН рассчитывают по формуле 5. В точке 100 вся к-та полностью связана в соль. Соль слабой к-ты и сильного основания легко гидролизуется с отщеплением свободных гидроксилов.
Поэтому точка эквивалентности находится в щелочной области (кривая титрования на обороте); рН рассчитывается по формуле 8. При дальнейшем титровании в растворе накапливается избыток титранта и рН в области 101-200 мл прибавленного титранта рассчитывают по формуле.
Титрование слабого основания сильной кислотой:
При дальнейшем титровании в р-ре накапливается избыток титранта и рН в интервале 101-200 рассчитывается по формуле 1. Титрование слабой к-ты слабым основанием: СН3СООН+NН4ОН =СН3СООNН4+Н2О. В нулевой точке рН раствора находят по формуле 3. В интервале 10-99 мл прибавленного титранта смесь представляет собой кислотный буфер и рН р-ра рассчитывают по формуле 5. В точке эквивалентности вся кислота связана в соль. Соль слабой к-ты и слабого основания полностью гидролизуется с образованием слабых к-ты и основания. В зависимости от значений рКα и рКb рН р-ра соли может находиться как в кислой, так и в щелочной области (кривая титрования); рН в этой точке рассчитывается по формуле 9.
При титровании слабых оснований, например аммиака, NН3+Н3О + = NН4 + +Н2О образуются катионы слабого основания, подвергающиеся гидролизу:
Выбор индикатора для титрования проводится по кривой титрования 2-мя способами:
Поэтому кривая α с обеими ветвями 1-го типа имеет самый большой скачок титрования. Кривые б и в состоят из разных ветвей 1 и 11 типа и поэтому имеют гораздо меньший скачок. Т.о., в случае слабого компонента скачок всегда уменьшается. Если же титровать слабое основание слабой кислотой, то кривая титрования будет состоять из обоих ветвей 11-го типа и совсем не будет иметь вертикальной части, т.е. в этом случае не будет наблюдаться заметный скачок титрования. Поэтому при титровании слабого основания слабой кислотой рН титруемого раствора изменяется настолько постепенно, что установить точно момент, когда следует прекратить титрование (т.е. точку эквивалентности) практически невозможно.
Для кривой титрования сильной к-ты сильным основанием характеризуется следующими особенностями:
В нейтральной среде перманганат-ион восстанавливается до диоксида марганца МпО2:
Если известны нормальности 2-х растворов и их объемы, при которых достигается точка эквивалентности, то можно вычислить количества эквивалента кислоты и щелочи:
где V (Н2SО4) и V(NаОН) выражены в миллилитрах.
Таким образом, при подстановке правых частей 2-х последних уравнений в предыдущее равенство получим очень важное для титриметрического анализа выражение принципа эквивалентности:
В общем виде для любых случаев титрования это соотношение имеет следующее выражение:
аналитический катион химия реакция буферный
Если известен объем анализируемого раствора, то по последнему уравнению можно рассчитать его нормальность: Сн(Х)= Сн(Т).V(Т)/V(Т).
Вычислив по результатам титрования нормальность анализируемого раствора из вышеприведенных уравнений можно определить массу вещества в любом объеме раствора.
Сущность кислотно-основного титрования. Кривые титрования



Метод кислотно-основного титрования (метод нейтрализации) – предназначен для определения концентрации кислот, оснований, солей и основан на реакции нейтрализации
Реакции кислотно-основного взаимодействия являются реакциями передачи протона от титранта к определяемому веществу или наоборот; характеризуются высокой скоростью и протекают строго стехиометрически.
Так как реакция нейтрализации не сопровождается изменением окраски раствора, точку эквивалентности определяют с помощью индикатора. Но обычно индикаторы меняют окраску не строго в точке эквивалентности, а с некоторым отклонением от неё. Другими словами, конечная точка титрования, (момент, в который происходит изменение окраски индикатора) не совпадает с точкой эквивалентности, а только более или менее соответствует ей. Поэтому даже при правильном выборе индикатора допускается погрешность – так называемая индикаторная ошибка титрования. Неправильный же выбор индикатора может вообще исказить результаты титрования.
Индикаторы, применяемые в кислотно-основном титровании: кислотно-основные индикаторы, например, метиловый оранжевый, фенолфталеин и др.
Титранты кислотно-основного титрования: растворы сильных кислот при определении концентрации оснований, растворы щелочей при определении концентрации кислот.
Стандартные вещества: карбонат натрия Na2CO3, тетраборат натрия Na2B4O7?10H2O для установления титра или нормальной концентрации (стандартизации) кислот. Щавелевая кислота Н2С2О4 ·2Н2О – для стандартизации щелочей.
Определяемые вещества: сильные и слабые кислоты; сильные и слабые основания; соли, подвергающиеся гидролизу.
Виды кислотно-основного титрования:
Для этого следует знать:
— как меняется рН раствора в колбе в ходе титрования, каково значение рН в точке эквивалентности и вблизи неё?
Для ответа на эти вопросы строят кривые титрования.
Кривая титрования – это график зависимости рН среды в колбе от объема добавленного титранта. Кривая титрования характеризуется точкой эквивалентности, точкой нейтральности, скачком титрования, линией нейтральности.
Линия нейтральности – прямая, параллельная оси абсцисс и пересекающая ось ординат при рН = 7.
Точка нейтральности – точка пересечения кривой титрования с линией нейтральности.
Скачок титрования – участок резкого изменения рН.
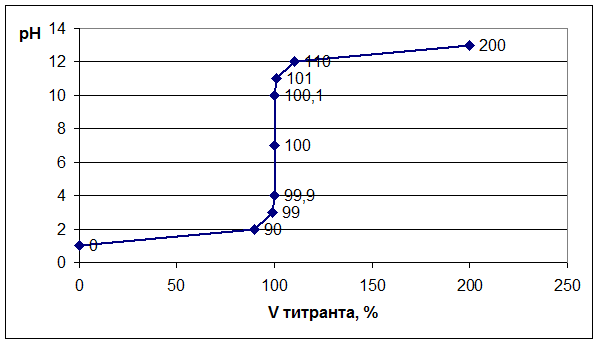
Титрование сильной кислоты сильным основанием (или наоборот). Расчет и построение кривой титрования. Для построения кривой титрования рассчитаем значения рН в точке эквивалентности и вблизи неё (когда добавлено титранта 0%, 90%, 99%, 99,9%, 100%, 100,1%, 101%, 110%, 200% от количества, необходимого для полной нейтрализации раствора в колбе) при титровании 10 мл 0,1н. раствора соляной кислоты 0,1н. раствором гидроксида натрия.
НСI + NaOH ↔ NaCI + H2O
По условию в колбе 10 мл 0,1н. раствор НСI, следовательно, в бюретке 0,1н. раствор NaOH.
По закону эквивалентов:
Следовательно, для полной нейтрализации 10 мл 0,1н. раствора НСI потребуется 10 мл 0,1н. раствора NaOH. По мере добавления к раствору кислоты, находящемуся в колбе, из бюретки раствора щелочи будет происходить постепенная нейтрализация соляной кислоты, причем 
Объем добавленного титранта, в нашем случае объем добавленной щелочи, рассчитываем по формуле:
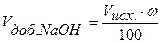
где ω – процент добавленного титранта.
Концентрация кислоты в колбе в процессе титрования будет меняться:
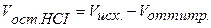
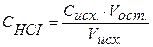
Точка №1: добавлено 0% NaOH, т.е. 0 мл. Концентрацию ионов Н + в колбе рассчитываем по формуле (8), значение рН – по формуле (5):
Точка №2: добавлено 90% от объема щелочи, необходимого для нейтрализации кислоты. Объем добавленной щелочи рассчитываем по формуле (35):
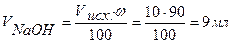
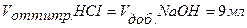
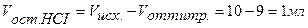
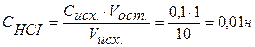
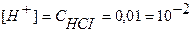
Аналогично рассчитываются точки №№ 3,4.
Точка №5 – точка эквивалентности, так как добавлено эквивалентное количество щелочи (100%). Вся кислота в колбе оттитрована:
НСI + NaOH ↔ NaCI + H2O
В колбе находится раствор хлорида натрия. Данная соль гидролизу не подвергается. Как рассчитать рН? Концентрация ионов Н + определяется диссоциацией воды:
Из формулы ионного произведения воды
Таким образом, при титровании сильной кислоты сильным основанием (или наоборот) точка эквивалентности совпадает с точкой нейтральности.
Точка №6: теоретически продолжаем титрование, чтобы построить график и подобрать индикатор. Добавляем 100,1% от необходимого объема щелочи, следовательно, в колбе избыток щелочи.
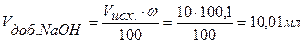
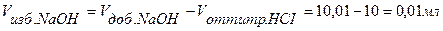
Находим концентрацию щелочи в колбе по формуле:
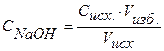
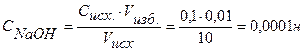
Концентрацию гидроксид-ионов рассчитываем по формуле (12), для расчета концентрации ионов Н + в щелочном растворе используем формулу (4):
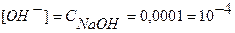
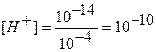
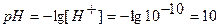
Аналогично рассчитывают точки №№ 7,8,9. Данные расчетов заносим в таблицу.
Далее строим график зависимости: рН = f (Vтитранта, %). На графике отмечаем точку эквивалентности, скачок титрования, линию нейтральности.
Следует отметить, что при титровании сильного основания сильной кислотой рН раствора в колбе будет меняться в обратном направлении, то есть от 14 до 0.
Выбор индикатора. Каждый индикатор изменяет свою окраску в определенном диапазоне значений рН – это так называемая область перехода. Показатель титрования индикатора (рТ) – это значение рН, при котором наблюдатель отчетливо отмечает изменение окраски раствора и признает титрование оконченным. Индикатор подбирают таким образом, чтобы его показатель титрования рТ был как можно ближе к значению рН в точке эквивалентности.
Для нашего случая (см. Приложение VII) подойдут следующие индикаторы: метиловый оранжевый, метиловый красный, лакмус, фенолфталеин.
Титрование слабой кислоты сильным основанием. В качестве примера рассмотрим титрование уксусной кислоты гидроксидом натрия:
Ацетат натрия подвергается гидролизу:
В результате образования некоторого избытка гидроксид-ионов точка эквивалентности не совпадает с точкой нейтральности, а лежит в щелочной области. Следовательно, имеет место сужение скачка титрования в кислотной области. Для данного вида кислотно-основного титрования подходит индикатор фенолфталеин.
Титрование слабого основания сильной кислотой. В качестве примера рассмотрим титрование гидроксида аммония соляной кислотой:
Хлорид аммония подвергается гидролизу:
В результате образования некоторого избытка ионов Н + точка эквивалентности лежит в кислотной области. Следовательно, имеет место сужение скачка титрования в щелочной области. Для данного вида кислотно-основного титрования подходят индикаторы метиловый оранжевый, метиловый красный.
Титрование слабой кислоты слабым основанием (и наоборот)невозможно, так как наблюдается сужение скачка титрования и в кислотной, и щелочной области. Скачок титрования исчезает на кривой титрования. Следовательно, не может быть резкого изменения окраски индикатора.
Индикаторы кислотно-основного титрования. Ионная теория индикаторов. Индикаторы в методе кислотно-основного титрования представляют собой слабые органические кислоты НInd или слабые органические основания IndOH, у которых молекулярная и ионная формы имеют различную окраску.
бесцветная малиновая
Индивидуальные задания
Рассчитать значения рН в точке эквивалентности и вблизи нее и построить кривую титрования:
| № варианта | Условие |
| 20 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 20 мл 0,1н. раствора NaOH 0,1н. раствором НNO3 | |
| 30 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 30 мл 0,1н. раствора КОН 0,1н. раствором НNO3 | |
| 40 мл 0,01н. раствора NaOH 0,01н. раствором НСI | |
| 40 мл 0,1н. раствора НСI 0,1н. раствором КОН | |
| 60 мл 0,1н. раствора НNO3 0,1н. раствором NaOH | |
| 60 мл 0,01н. раствора КОН 0,01н. раствором НСI | |
| 70 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 70 мл 0,1н. раствора КОН 0,1н. раствором НNO3 | |
| 80 мл 0,1н. раствора НСI 0,1н. раствором КОН | |
| 80 мл 0,01н. раствора КОН 0,01н. раствором НNO3 | |
| 20 мл 1н. раствора НСI 1н. раствором КОН | |
| 20 мл 1н. раствора NaOH 1н. раствором НСI | |
| 100 мл 0,01н. раствора НСI 0,01н. раствором NaOH | |
| 100 мл 0,1н. раствора NaOH 0,1н. раствором НNO3 | |
| 10 мл 1н. раствора НNO3 1н. раствором КОН |
Обучающие задачи
Задача №1
Титр раствора НСI равен 0,00359 г/мл. Найти молярную концентрацию эквивалента раствора соляной кислоты.
Дано: Решение:
Т(НСI) = 0,00359г/мл
Ответ: С (НСI) = 0,0984н.
Задача №2
Какова молярная концентрация эквивалента и титр раствора щавелевой кислоты (Н2С2О4?2Н2О), полученного растворением 1,7334 г её в мерной колбе ёмкостью 250 мл?
Дано: Решение:
Задача №3
На титрование 20 мл раствора НNO3 израсходовано 18,25 мл 0,1103н. раствора NaOH. Вычислить молярную концентрацию эквивалента раствора НNO3.
Дано: Решение:
С (NaOH) = 0,1103н.
Ответ: С (НNO3) = 0,1007н.
Задача №4
Вычислить нормальность и титр соляной кислоты, если на титрование 10,0 мл раствора Na2CO3, полученного растворением навески 0,4993г в мерной колбе ёмкостью 100мл, расходуется 11,2 мл раствора НСI.
Дано: Решение:
Vколбы = 100 мл
V (Na2CO3) = 10,0 мл
V (HCI) = 11,2 мл
Э (НСI) = М = 36,5 г/моль
Ответ: С(НСI) = 0,0841н., Т(НСI) = 0,00307 г/мл.
Задачи для самостоятельного решения
1. Титр раствора азотной кислоты равен 0,00609 г/мл. Найти молярную концентрацию эквивалента кислоты. Ответ: 0,0967н.
2. Рассчитать величину навески Н2С2О4?2Н2О для приготовления 100мл 0,1н. раствора. Ответ: 0,63г.
3. Какова молярная концентрация эквивалента и титр раствора Na2CO3, полученного растворением: а) навески 1,0678г в мерной колбе емкостью 200 мл; б) навески 0,4968г в мерной колбе емкостью 100 мл; в) навески 0,5265г в мерной колбе емкостью 100 мл? Ответы: а) Т = 0,00534 г/мл, С = 0,1008н; б) Т = 0,00497 г/мл, С = 0,0938н; в) Т = 0,00527 г/мл, С = 0,0994 н.
4. На титрование 10,00 мл раствора NaOH израсходовано 9,15 мл 0,0981н. раствора НСI. Вычислить молярную концентрацию эквивалента гидроксида натрия. Ответ: 0,0898н.
5. На титрование 10,00 мл 0,0915н. раствора Na2CO3 израсходовано 10,2 мл раствора НСI. Вычислить молярную концентрацию эквивалента раствора HCI. Ответ: 0,0897н.
6. На титрование 10,00 мл 0,1041н. раствора Na2CO3 израсходовано 8,9 мл раствора НСI. Вычислить нормальность раствора HCI. Ответ: 0,1170н.
7. На титрование 10,00 мл раствора NaOH израсходовано 8,75 мл 0,1055н. раствора НСI. Вычислить молярную концентрацию эквивалента NaOH. Ответ: 0,0923н.
8. Какой объем 0,0965н. раствора NaOH пойдет на титрование 10 мл 0,1105н раствора НСI? Ответ: 11,45 мл.
9. Какой объем 0,0991н раствора НСI пойдет на титрование 10 мл 0,1025н раствора NaOH? Ответ: 10,34 мл.
10. Вычислить нормальность и титр раствора соляной кислоты, если на титрование 20,00 мл раствора Na2CO3, полученного растворением навески 0,9985г в мерной колбе емкостью 200 мл, расходуется 24 мл раствора НСI. Ответ: С = 0,0785н., Т = 0,00287 г/мл.
11. Вычислить нормальность раствора НСI, если на титрование 10,00 мл раствора Na2CO3, полученного растворением навески 0,5502г в мерной колбе емкостью 100 мл, расходуется 9,75 мл раствора НСI. Ответ: С = 0,1065н.
? Контрольные вопросы
1. Сущность титриметрического анализа. Что такое титрование, точка эквивалентности? Способы установления точки эквивалентности.
2. Способы выражения концентрации растворов в титриметрическом анализе. Приведите соответствующие формулы.
3. Что лежит в основе классификации методов титриметрического анализа. Кратко охарактеризуйте каждый метод. Применение титриметрического анализа.
4. Стандартные и стандартизированные растворы. Требования, предъявляемые к стандартным веществам. Стандартные и стандартизированные растворы в кислотно-основном титровании. Приведите примеры. Формулы расчета массы вещества для приготовления стандартного раствора, расчета титра и нормальной концентрации стандартного раствора, расчета концентрации стандартизированного раствора.
5. Сущность кислотно-основного титрования. Что такое точка эквивалентности? В какой области значений рН лежит точка эквивалентности при титровании: а) сильной кислоты сильным основанием (или наоборот); б) слабой кислоты сильным основанием; в) слабого основания сильной кислотой? Привести примеры и объяснить. Объяснить, возможно ли титрование слабой кислоты слабым основанием.
6. Выбор индикатора в кислотно-основном титровании. Что такое область перехода и показатель титрования индикатора? Ионная теория индикаторов на примере фенолфталеина.
7. Ионно-хромофорная теория индикаторов. Понятие о хромофорах и ауксохромах.