что такое перитонит и сепсис
Острый аппендицит с перитонитом (K35.2)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Примечание
В данную подрубрику включены:
— острый аппендицит с прободением;
— острый аппендицит с перитонитом (разлитым);
Период протекания
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Процессы, влияющие на развитие перитонита:
1. Выпадение фибрина в экссудате. Является важной частью иммунной защиты, поскольку фибринные комплексы могут поглотить и адсорбировать большое количество бактерий. В результате системное распространение внутрибрюшинной инфекции может замедлиться, что уменьшает раннюю смертность от сепсиса. Однако одновременно с этим в фибринных комплексах бактерии, защищенные от механизмов иммунной защиты, могут размножаться, что приводит к развитию оставшейся инфекции и процессов абсцедирования.
Таким образом, выпадение фибрина в конечном итоге может приводить как к локализации процесса, так и к развитию инфекции.
2. Степень перитонеального бактериального загрязнения. В настоящее время средний уровень обсеменения при разлитом перитоните оценивают как 8х10 8 КОЕ/мл. Высокая степень обсемененности может истощать иммунную систему защиты.
3. Вирулентность. Бактериальные факторы вирулентности (способность к образованию капсулы, факультативно-анаэробный рост, возможность адгезии, продукция янтарной кислоты) мешают фагоцитозу бактерий нейтрофилами и опосредованному клеточному ответу. В результате инфекция сохраняется и формируются абсцессы. Синергия между определенными бактериями и грибками может также играть важную роль в ослаблении иммунной защиты хозяина.
4. Наличие энтерококков в качестве возбудителя.
5. Наличие микробных и микробно-грибковых ассоциаций в качестве возбудителя.
Перитонит: причины, симптомы, диагностика, лечение
Перитонит – воспалительное поражение брюшины, серозной оболочки, покрывающей большинство внутренних органов и выстилающей стенки брюшной полости изнутри. В большинстве случаев оно протекает как осложнение инфекционно-воспалительных заболеваний или травм в области груди и живота. Состояние больного при этом часто тяжелое, с интенсивной абдоминальной болью, рвотой, повышением температуры тела и другими симптомами. Лечение направлено на борьбу с инфекционным патогеном, чаще всего бактериального происхождения, и всегда включает хирургическое вмешательство на органах брюшной полости.
Ее воспаление приводит к нарушению работы жизненно важных органов и развитию неблагоприятных патофизиологических реакций, опасных для человека.
Причины
Как правило, воспаление брюшины вызвано бактериальной инфекцией. Часто это представители нормальной микрофлоры органов пищеварения – энтеробактерии, кишечная палочка, протей, кокки, клостридии и другие микроорганизмы. Реже возбудители гонореи, туберкулеза, гемолитический стрептококк либо пневмококк.
В зависимости от пути проникновения возбудителя в брюшную полость выделяют три вида патологии. Первичный перитонит развивается при миграции возбудителя из других очагов воспаления по кровяному руслу, фаллопиевым трубам у женщин или с током лимфы. Такое возможно при заболеваниях органов малого таза, включая гинекологические заболевания, воспаления в органах ЖКТ, инфекционных поражениях почек.
Вторичный перитонит – это не самостоятельная болезнь, а осложнение деструктивно-воспалительных поражений органов брюшной полости. Также причинами перитонита становятся проникающее ранение брюшной стенки или тупая травма живота с разрывом внутренних органов, послеоперационные осложнения и ошибки во время проведения хирургических вмешательств. Отдельно стоит отметить воспалительные поражения брюшины при злокачественных опухолях, глистной инвазии, гранулематозном и ревматоидном процессах в организме.
Третичный перитонит возникает спустя двое суток после удаления очага вторичного перитонита. Причина его появления в том, что организм больного не смог сформировать адекватную реакцию на инфекционный процесс.
Классификация
По площади пораженной брюшины воспаление может быть ограниченным, местным (при поражении 1-2 анатомических областей), разлитым (охватывающим три и более области) и общим (при тотальном воспалении).
В своем развитии заболевание проходит раннюю фазу (менее двенадцати часов), позднюю (менее пяти дней) и конечную (от одной до трех недель от начала воспаления).
Симптомы
Острый перитонит протекает в три стадии, каждая из которых имеет свои проявления. В первые сутки от начала перитонита, в реактивную стадию, отмечается местная реакция на раздражение брюшины. Изначально болевые ощущения локализуются там, где находится источник воспаления, могут иррадиировать в плечо, под ключицу. В дальнейшем боль разливается по всему животу. Для облегчения состояния человек принимает позу «эмбриона», лежа с прижатыми к животу ногами. Пациента беспокоят сухость слизистой рта, тошнота и рвота, снижение аппетита.
Токсическая стадия развивается в промежутке от четырех до семидесяти восьми часов. Характерны нарастающая интоксикация вплоть до эндотоксического шока, усиление общих проявлений – снижается кровяное давление, учащается сердцебиение, повышается температура тела и появляются проблемы с дыханием. Боль носит разлитой характер, ее интенсивность снижается, так как начинается паралич нервных окончаний брюшины, отмечаются вздутие живота, запор.
В терминальной стадии, после семидесяти двух часов от начала воспаления брюшины, происходит грубое нарушение жизненно необходимых процессов внутри организма. Над симптомами перитонита преобладают проявления паралитической непроходимости кишечника – интенсивная боль в животе, сильная рвота, не приносящая облегчение, и выраженное вздутие. Состояние больного крайне тяжелое, черты лица заострены, артериальное давление резко снижено, моча не отходит, сознание спутано, конечности приобретают синюшный или желтый оттенок, характерны повышенная потливость и другие признаки полиорганной недостаточности.
Для хронического перитонита характерны «смазанные» симптомы, возникающие вследствие длительной интоксикации и образования спаек в брюшной полости, нарушающих работу внутренних органов.
Осложнения
Диагностика
Если в ходе беседы с пациентом и осмотра врач подозревает у взрослого или ребенка перитонит, больной экстренно госпитализируется в стационар больницы, где проводятся дальнейшие лабораторные и инструментальные исследования для уточнения диагноза.
Лечение
Лечение перитонита всегда хирургическое, с обязательной предоперационной медикаментозной подготовкой. Последняя направлена на восполнение баланса жидкости, солей и нормализацию состояния пациента, а также адекватное обезболивание и нормализацию артериального давления.
Во время операции при перитоните устраняется очаг инфекции, удаляются гной и перитонеальный выпот, брюшная полость промывается антисептическими растворами и дренируется. Послеоперационное ведение больного включает курс мощной антибиотикотерапии, капельницы с детоксикационными растворами, препараты для поддержания работы органов сердечно-сосудистой системы, дыхания и нервной системы.
АБДОМИНАЛЬНЫЙ СЕПСИС
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В настоящее время основной проблемой в ургентной хирургии и интенсивной терапии остается лечение больных, у которых заболевание характеризуется развитием неотграниченного распространенного гнойного перитонита и деструктивных процессов в органах, когда очаг или источник инфекции не может быть ликвидирован или локализован в один этап, в ходе одной операции. Даже после устранения или отграничения источника инфицирования, санации обширной поверхности брюшины и активного дренирования брюшной полости, метаболической и массивной антибактериальной терапии у каждого второго больного в различные сроки послеоперационного периода развиваются некорригируемый инфекционно-токсический шок (ИТШ) и выраженная полиорганная недостаточность (ПОН), при которых летальность достигает 60 – 80% [1 – 3].
Согласно современным представлениям, абдоминальный сепсис (АС) является системной воспалительной реакцией организма в ответ на развитие первоначально деструктивного процесса в органах брюшной полости и/или забрюшинного пространства; АС характеризуется совокупностью процессов эндотоксикоза и ПОН [4]. Такая системная воспалительная реакция определяется составом и вирулентностью наиболее часто идентифицируемых микроорганизмов. Характер ее основных клинических и лабораторных проявлений делает эту реакцию универсальной при определенных нозологических формах неотложной абдоминальной патологии. В большинстве наблюдений практически все реакции опосредованы действием токсинов и медиаторов различной природы [5].
Данные мировой литературы и собственные практические наблюдения позволяют выделить группу ургентных хирургических заболеваний, при которых наиболее часто доминируют в разнообразных сочетаниях синдромы ПОН и ИТШ, определяющие диагностику, лечение и исход АС. В эту группу, по нашему мнению, целесообразно объединить следующие заболевания [6 – 10]:
• вторичный распространенный гнойный перитонит, развивающийся вследствие деструкции полого органа и запущенных форм кишечной непроходимости;
• послеоперационный распространенный перитонит, обусловленный, как правило, несостоятельностью зоны швов и анастомозов;
• гнойно-некротические формы деструктивного панкреатита – инфицированный некроз поджелудочной железы, септическую флегмону забрюшинной клетчатки, вторичный гнойный панкреатогенный перитонит, абсцессы различной локализации.
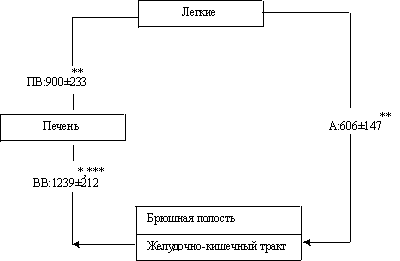
Схема 1. Концентрация (в пг/мл) бактериального эндотоксина в различных сосудистых бассейнах при АС (Х ± Sx)
Примечание: ВВ – воротная вена, ПВ – печеночная; А – бедренная артерия. Достоверность различий (р по непараметрическим критериям: * – по сравнению с артериальным показателем, ** – с показателем ВВ, *** – с показателем ПВ.
Следует отметить, что именно при этих заболеваниях наблюдаются максимально высокие летальность и частота септических осложнений, которые значительно отягощают течение послеоперационного периода, а у ряда пациентов могут стать непосредственной причиной смерти [4,11].
Наш клинический опыт позволяет выделить особенности АС, определяющие выбор диагностической и лечебной тактики у этих больных (табл. 1) [1].
Особое внимание следует уделять ранней и комплексной диагностике множественных и резидуальных, в том числе экстраабдоминальных очагов полимикробной инфекции. В ином варианте течения АС запоздалая и неполноценная диагностика приводит к быстрому развитию фатальных местных и системных гнойных осложнений, что в целом определяет резистентность к традиционным методам хирургического лечения, а следовательно, и крайне высокую летальность этого контингента больных.
Основные вопросы этиологии и патогенеза абдоминального сепсиса
| Наличие множественных или резидуальных очагов инфекции Основные источники: брюшная полость, забрюшинное пространство, ЖКТ Дополнительные источники: пневмонические очаги, мочевыделительный тракт Полимикробное инфицирование Резистентность к традиционным методам хирургического лечения Быстрое развитие ИТШ и ПОН в разные сроки до- и послеоперационного периода Быстрое включение энтерогенного источника интоксикации (транслокация бактерий и токсинов) Большая частота фатальных септических осложнений Высокая летальность |
Однако при последующем микробиологическом исследовании экссудата брюшной полости в ходе программируемого хирургического лечения АС практически у всех больных было отмечено увеличение удельного веса условно-патогенной госпитальной микрофлоры, преимущественно энтерогенного происхождения (5, 12, 14).
Таблица 2. Бактериология абдоминального сепсиса
У наиболее тяжелых больных с АС на фоне длительного пареза кишечника при проведении системной антибактериальной терапии наряду с патологической колонизацией желудочно-кишечного тракта (ЖКТ) и развитием тяжелых форм дисбактериоза кишечника происходят контаминация ротоглотки, инфицирование трахеи и бронхов, мочевого пузыря условно-патогенной микрофлорой из двух основных источников. Первый представлен патогенной микрофлорой верхних отделов кишечной трубки больного, второй – госпитальными микроорганизмами окружения палат интенсивной терапии (табл. 3).
Таблица 3. Соотношение удельного веса госпитальной и внегоспитальной микрофлоры в анатомических зонах при АС
| Локализация | Соотношение |
| Тонкая кишка | 1,3 |
| Брюшная полость | 1,2 |
| Рана | 2,7 |
| Мочевыводящие пути | 3,2 |
| Трахеобронхиальное дерево | 3,1 |
| Ротоглотка | 3,1 |
| Периферическое венозное русло | 0,95 |
Определение уровня портальной и системной бактериотоксинемии четко показало, что интоксикация бактериального происхождения у больных АС в значительной мере является эндогенной (схема 1) и обусловлена механизмами транслокации бактерий и их токсинов в сосудистое русло как из брюшной полости, так и из просвета ЖКТ в условиях нарушенной барьерной функции кишечной стенки и брюшины [12, 13].
Стратегия и тактика хирургического лечения
| Закрытый | Пассивное и активное дренирование Перитонеальный диализ Релапаротомия «по требованию» |
| Полуоткрытый | Этапные ревизии и санации «по программе» Санация в межоперативный период Временное закрытие лапаротомной раны |
| Открытый | Лапаростомия Оментобурсо- и люмбостомия Этапное хирургическое лечение |
При постнекротических гнойных осложнениях панкреонекроза мы, наоборот, все чаще используем принципы открытого дренирования путем формирования оментобурсо- и/или люмбостомии [9].
В современных условиях режим санационных программируемых оперативных вмешательств является достаточно эффективным средством ликвидации основных и дополнительных источников АС только при правильном определении показаний. Так, даже при все возрастающих возможностях современной анестезиологии и интенсивной терапии расширение показаний к таким методам лечения сопровождается увеличением числа фатальных осложнений, что дискредитирует эффективность открытого и полуоткрытого методов оперативного лечения. С другой стороны, нами установлено, что при АС у больных с выраженной полиорганной недостаточностью, т.е. с поражением более трех систем и органов, режим программируемых вмешательств при АС утрачивает свои преимущества, в то время как его существенные недостатки полностью сохраняются (табл. 5) [8].
Таблица 5. Открытые и полуоткрытые методы хирургического лечения абдоминального сепсиса
| Преимущества | Недостатки |
| Эффективная хирургическая санация | Повторная травма органов |
| Своевременная диагностика и коррекция осложнений | Потенцирование нозокомиальных осложнений |
| Активная санация и дренирование в межоперационный период | Вентральные грыжи |
| Решение психологических | Кровотечения и свищи |
| проблем, стоящих перед хирургом | |
| Спасение инкурабельных больных | Высокая стоимость лечения |
Наш десятилетний опыт лечения больных с АС, обусловленным распространенным перитонитом различной этиологии и гнойным панкреатитом, позволяет решить ряд тактических вопросов. Главным и определяющим является принцип объективной и динамической оценки интраоперационных данных и тяжести состояния больного при этапном хирургическом лечении.
Этапные вмешательства должны выполняться одной и той же бригадой хирургов и анестезиологов. Очень важно, чтобы показания к использованию современных методов хирургического лечения АС основывались на понимании положительных и отрицательных сторон каждого из них.
Таблица 6. Критерии интраоперационной оценки характера поражения органов брюшной полости при перитоните (в баллах)
разлитой – 4
диффузный – 2
абсцесс – 1
в виде «панциря» – 1
«рыхлых масс» – 4
каловый – 4
гнойный – 3
серозный – 1
геморрагический – 4
инфильтрирована – 3
перистальтика отсутствует – 3
кишечный свищ
(несостоятельность анастомоза) – 4
Дополнительные критерии:
нагноение, некроз раны, эвентрация – 3
неудаленные девитализированные ткани – 3
Среди очевидных преимуществ многоэтапных оперативных вмешательств (адекватная санация брюшной полости и забрюшинного пространства, своевременная диагностика и коррекция внутрибрюшинных осложнений, активное дренирование в межоперационный период) особое значение мы придаем возможности спасения тех больных с АС, у которых развитие заболевания носит потенциально фатальный характер в условиях традиционного хирургического лечения. Недостатки этих методов лечения – повторная операционная травма, длительность интубации полых органов и катетеризация магистральных сосудов, что сопровождается высоким риском развития нозокомиальных осложнений (рецидивирующих внутрибрюшинных и желудочно-кишечных кровотечений), формирование кишечных свищей, заживление ран вторичным натяжением с формированием в последующем вентральных грыж. Недостатком этих методов также является длительное пребывание больного в отделении интенсивной терапии,что удорожает лечение.
Таблица 7. Пути лечения синдрома кишечной недостаточности
Поддержание нормальной микроэкологии ЖКТ
Коррекция нарушений функций ЖКТ
Коррекция метаболического дистресс-синдрома
Оптимизация транспорта кислорода и микроциркуляции
При постнекротических гнойных осложнениях панкреонекроза мы используем иную шкалу оценки варианта развития и течения патоморфологического процесса в брюшной полости [9, 10].
Прогностическая значимость в отношении вероятности неблагоприятного исхода при использовании разработанных систем весьма высока, хотя мы использовали только общеклинические интраоперационные данные.
Таблица 8. Пути оптимизации антибактериальной терапии абдоминального сепсиса
| Целенаправленный выбор препаратов с учетом полимикробной этиологии патологического процесса |
| Динамический микробиологический мониторинг |
| Соблюдение фармакокинетических принципов терапии |
| Сочетание системного введения антибиотиков с селективной деконтаминацией ЖКТ и местным применением бактерицидных средств |
| Коррекция системных нарушений гомеостаза |
| Детоксикация (в том числе энтеральная) и блокада цитокиногенеза |
На основании изложенного мы выделяем абсолютные и относительные показания к этапным ревизиям и санациям в программируемом режиме.
Абсолютные показания:
• распространенный гнойный или каловый перитонит различной этиологии;
• инфицированная флегмона забрюшинного пространства;
• распространенные формы инфицированного панкреонекроза;
• сомнительная жизнеспособность части органа;
• послеоперационный перитонит, гнойные осложнения панкреонекроза, диагностируемые после запоздалой релапаротомии;
• индекс поражения брюшной полости и забрюшинного пространства более 13 баллов.
Относительные показания:
• тотальное нагноение лапаротомной раны, флегмона передней брюшной стенки;
• неустраненный и неадекватно отграниченный на первой операции источник деструкции или инфицирования;
• признаки анаэробного инфицирования;
• абсцессы поджелудочной железы и забрюшинного пространства.
Предложенные системы оценки тяжести состояния больных АС наряду с прогнозированием лечебной тактики позволили наиболее полно и объективно оценить эффективность методов активного хирургического лечения в однородных группах больных [8 – 10].
Вместе с тем представляется, что результаты программируемых вмешательств при АС могут быть улучшены при строгом соблюдении следующих принципов:
• оптимизация показаний на основании систем балльной оценки состояния органов брюшной полости и тяжести физиологического состояния;
• оптимальные режим оперативного лечения, количество, объем операций и интервалы между ними в зависимости от тяжести состояния больного;
• достижение адекватной санации брюшной полости в межоперационном периоде с применением элементов перитонеального диализа;
• в обязательном порядке необходимо сочетать различные способы декомпрессии, детоксикации и деконтаминации ЖКТ при АС [1, 7, 14].
Профилактика и лечение синдрома кишечной недостаточности
Синдром кишечной недостаточности при АС является не только важным компонентом, но и основным фактором патогенеза ПОН. Более того, нарушение барьерной функции ЖКТ при синдроме кишечной недостаточности создает условия для неконтролируемой транслокации условно-патогенных микроорганизмов и поддержания септического процесса даже при достаточно эффективной санации других очагов инфекции. Кишечная недостаточность действительно становится «мотором» танатогенеза при АС, поскольку повреждение анатомо-физиологической целостности ЖКТ включается в порочный круг метаболического дистресс-синдрома и глубокого угнетения интестинальных механизмов противоинфекционной защиты. Именно поэтому профилактика и коррекция синдрома кишечной недостаточности представляют важнейшее направление в терапии АС.
Таблица 9. Антибактериальные препараты, приемлемые для лечения АС
Аминогликозид + амоксициллин/клавулат + антианаэробные препараты
В клинике факультетской хирургии РГМУ разработаны стратегические направления лечения этого синдрома [5, 12, 14] (табл. 7).
Показанием к дренированию ЖКТ при перитоните, непроходимости кишечника, остром нарушении мезентериального кровообращения, панкреонекрозе является развитие динамической непроходимости кишечника, характеризующейся расстройством его моторно-эвакуаторной, переваривающей, всасывательной, барьерной и секреторной функций.
В настоящее время мы отдаем предпочтение закрытым методам дренирования, когда многоканальный зонд проводится в кишечник антеградно (назоинтестинальная интубация) [7, 12]. Открытые методы дренирования (через гастроэнтероаппендикоцекостомы) не утратили своего практического значения, однако их применение ограничено из-за большого числа осложнений (развитие тяжелых водно-электролитных и метаболических нарушений). Надо отметить, что длительное назоинтестинальное или назогастральное дренирование приводит к инфицированию вышележащих отделов ЖКТ и трахеобронхиального дерева, что в сочетании с длительным вынужденным горизонтальным положением больного и продолженной искусственной вентиляцией легких является причиной прогрессивного увеличения числа экстраабдоминальных гнойно-септических осложнений при АС.
Особое значение в профилактике и лечении синдрома кишечной недостаточности при АС имеет своевременное назначение синтетического аналога соматостатина. Исследования, проведенные в различных центрах, а также в нашей клинике [9, 10], позволяют считать этот препарат не только эффективным средством лечения панкреатита, желудочно-кишечных кровотечений, панкреатических и кишечных свищей, но и системным энтеропротектором и адаптогеном пищеварительной системы.
Место соматостатина в лечении АС определяется его фармакодинамическими свойствами:
• ингибированием секреции в желудке и двенадцатиперстной кишке (профилактика стресс-язв);
• подавлением экскреторной функции поджелудочной железы;
• подавлением выброса гастроинтестинальных тканевых гормонов;
• способностью нормализовать параметры нутритивного и спланхнического кровотока;
• способностью блокировать цитокиногенез.
1. Б.Р. Гельфанд, В.А. Гологорский, С.З. Бурневич, Е.Б. Гельфанд, В.Е. Гиткович. Абдоминальный сепсис: современный взгляд на нестареющую проблему. Стратегия и тактика лечения. Часть II//Вестник интенсивной терапии. 1997. – № 1-2. – С. 73–79.
2. Abdominal infection: new approaches and management. Symposium, 1996, California, USA.
3. Cuesta MF, Doblas M, Castaneda L, Bengoechea E. Sequential abdominal reexploration with the zipper technique. World J Surg 1991;15:74–80.
4. Б.Р. Гельфанд, С.З. Бурневич, В.Е. Гиткович, Ш.М. Гайнулин. Абдоминальный сепсис: современный взгляд на нестареющую проблему (обзор литературы). Часть I//Вестник интенсивной терапии. 1996. – № 4. – С. 29–35.
5. Б.Р. Гельфанд, М.И. Филимонов, С.Г. Юсуфов, П.В. Подачин, С.М. Насибов, Д.В. Кулаев. Энтеросорбция при синдроме кишечной недостаточности // Анестезиология и реаниматология. 1997. – № 3. – С. 34–36.
6. П.В. Подачин, С.З. Бурневич, В.Е. Гиткович, П.А. Соболев, С.Г. Юсуфов. Выбор хирургической тактики при послеоперационном перитоните // Тезисы Всероссийской научно-прак