Что такое фокальное поражение
Фокальные эпилепсии у взрослых: клиническая лекция
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
У лиц старше 18 лет редко можно встретить самоограничивающиеся эпилептические синдромы детского возраста или разрушительные младенческие эпилептические энцефалопатии. При помощи электроэнцефалографического видеомониторинга лобные приступы удалось разделить на 6 групп: 1) фокальные клонические моторные; 2) асимметричные тонические; 3) гиперкинетические (психомоторные, гипермоторные, комплексные парциальные); 4) оперкулярные; 5) абсансы; 6) приступы, напоминающие медиальную височную эпилепсию. Височные эпилепсии можно разделить на 2 вида в соответствии с четко определенными синдромами: 1) медиальную, или амигдало-гиппокампальную, связанную с поражением лимбической системы в глубинных отделах височной доли; 2) латеральную, или неокортикальную, в основе которой лежит поражение височного неокортекса. Классические симптомы теменной эпилепсии представлены парестезиями, обычно контралатеральными очагу приступов. Пациенты могут описывать иктальные соматосенсорные симптомы как «ползание мурашек», «онемение», «покалывание», «сведение». При затылочной эпилепсии иктальные зрительные симптомы могут быть как позитивными в виде «ярких вспышек», «кругов», «мурашек», «птичек», «мерцающих ярких пятен» и т. д., так и негативными в виде «темноты перед глазами» (амавроза) или «черных пятен» (черных скотом). При затылочных приступах встречаются различные глазодвигательные симптомы, например тоническое отведение глазных яблок.
Ключевые слова: эпилепсия, лобная, височная, теменная, затылочная, клиника, диагностика, лечение.
Для цитирования: Котов А.С. Фокальные эпилепсии у взрослых: клиническая лекция. РМЖ. Медицинское обозрение. 2019;3(4(II)):95-99.
Moscow Regional Scientific Research Clinical Institute named after M.F. Vladimirsky
Self-limited childhood focal epilepsy or devastating infantile epileptic encephalopathy can be found in persons older than 18 years old. Frontal lobe seizures were divided into 6 groups within video-EEG monitoring: focal clonic of the motor area, asymmetric tonic, hyperkinetic (psychomotor, hyper motor, complex partial), opercular, absence, and seizures similar to medial temporal lobe epilepsy. Temporal lobe epilepsy can be divided into two distinct syndromes: medial, or amygdala-hippocampal, associated with the limbic system disorder in the temporal lobe deep parts, and lateral, or neocortical, which is based on the neocortical temporal disorder. Classic symptoms of parietal lobe epilepsy are presented by paresthesia, usually contralateral to the focus of seizures. Patients can describe ictal somatosensory symptoms as sensations of “crawling”, “numbness”, “pins and needles”, and “cramp”. In occipital lobe epilepsy, ictal visual symptoms can be both positive (described as bright flashes, circles, “crawlings”, “birds”, flickering bright spots, etc.) and negative (in the form of “darkness in front of eyes” (amaurosis) or “black spots” (scotomata). In addition, various oculomotor symptoms, as a tonic eye movement during an occipital seizure, can occur.
Keywords: epilepsy, frontal lobe, temporal lobe, parietal lobe, occipital lobe, clinic, diagnosis, treatment.
For citation: Kotov A.S. Focal epilepsy in adults: clinical lecture. RMJ. Medical Review. 2019;4(II):95–99.
Лекция посвящена проблеме фокальной эпилепсии у взрослых.
Введение
Лобная эпилепсия
Фокальные клонические моторные приступы
Асимметричные тонические приступы
Лобные гиперкинетические приступы
Абсансы
Пароксизмы, исходящие из височных долей мозга
Височная эпилепсия
Медиальная височная эпилепсия
Латеральная височная эпилепсия
Теменная эпилепсия
Затылочная эпилепсия
Заключение
Только для зарегистрированных пользователей
Классификация эпилепсии
Практическое клиническое определение эпилепсии рабочей группы при Международной противоэпилептической лиге (ILAE) 2014 г.
Эпилепсия — заболевание головного мозга, соответствующее любому из следующих состояний:
Критерии разрешения эпилепсии включают достижение определенного возраста у пациентов с зависящим от возраста эпилептическим синдромом либо отсутствие эпилептических приступов в течение 10 лет у пациентов, не получавших противосудорожные препараты более 5 лет.
Классификация эпилепсии (Международная противоэпилептическая лига (ILAE) 2017 г. )
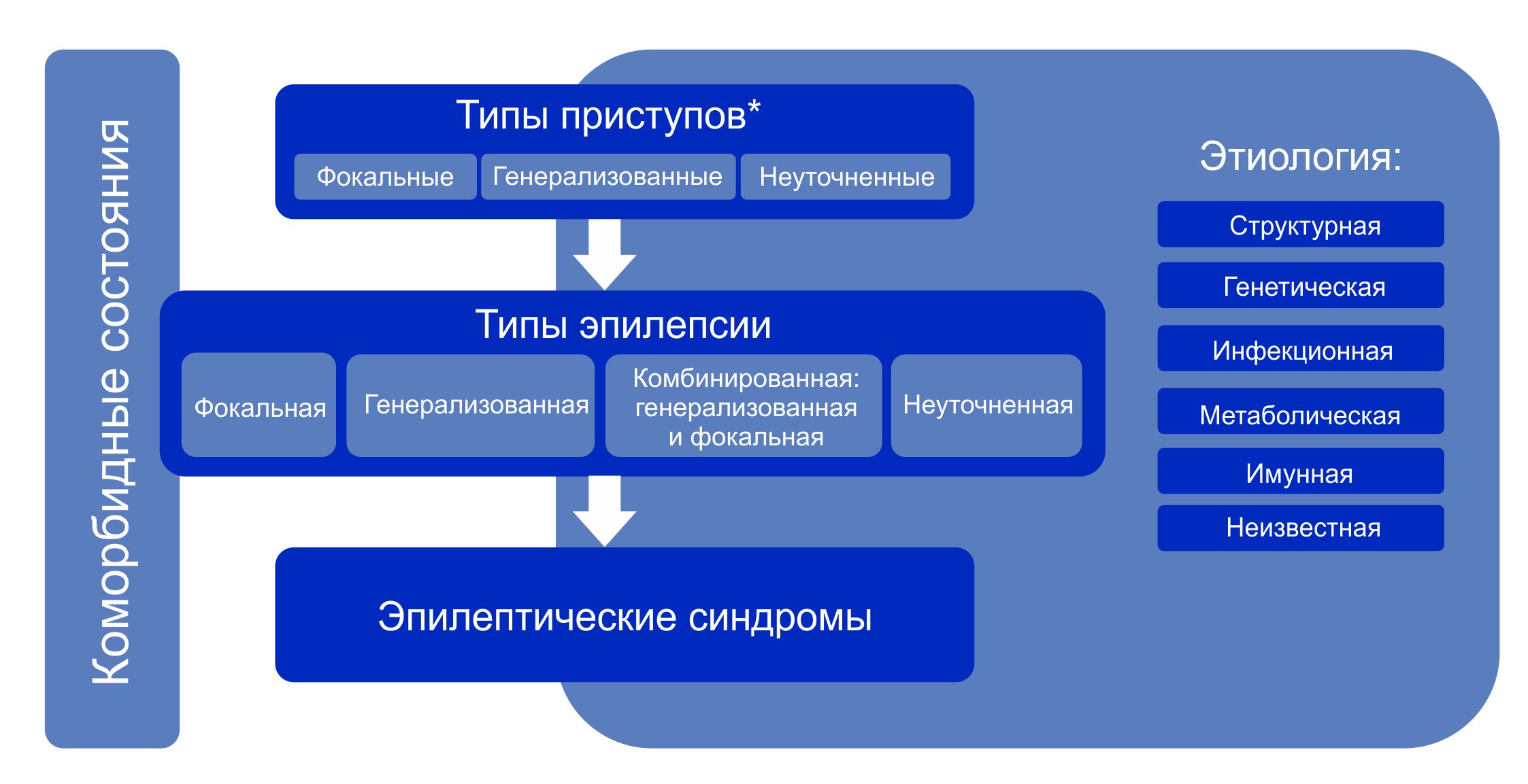
Классификация эпилепсии проводится после определения критериев диагностики эпилепсии (определение выше). Классификация проводится с использованием трехуровнего ранжирования — определение типа приступов, типа эпилепсии и синдрома эпилепсии. Нейроимиджинг, ЭЭГ и другие исследования, если они есть, помогают улучшить классификацию на всех трех уровнях. Где это возможно, следует установить диагноз на всех трех уровнях. Этиологию эпилепсии следует устанавливать с самого начала и на каждом этапе всего диагностического пути. Знание этиологии может способствовать оптимизации классификации и имеет важные лечебные последствия для пациента.
Структура Классификации эпилепсии ILAE 2017 г.
Примечание. * Оценивается по началу приступа.
Авакян Г. Н. Блинов Д. В. Лебедева А. В. Бурд С. Г. Авакян Г. Г. Классификация эпилепсии Международной Противоэпилептической Лиги: пересмотр и обновление 2017 года. Эпилепсия и пароксизмальные состояния. 2017; 9 (1): 6–25. DOI: 10.17749/2077–8333.2017.9. 1.006–025.
Алгоритм классификации эпилепсии:
Генерализованная эпилепсия
Пациенты с генерализованной эпилепсией имеют генерализованные типы приступов и могут иметь типичные интериктальные и / или иктальные ЭЭГ паттерны, которые сопровождают генерализованные типы приступов (например, генерализованный спайк-волна). Сопутствуют семейная история генерализованных типов приступов или генерализованная эпилепсия.
Генетическая / идиопатическая генерализованная эпилепсия представляет собой эпилепсию с генерализованными приступами, ассоциированнами с генерализованными эпилептиформными паттернами ЭЭГ, такими как генерализованная спайк-волновая активность, которая, считается, имеет генетическую этиологию. Однако это не всегда означает, что эти эпилепсии унаследованы или могут передаваться потомству, поскольку генетическая этиология может быть спонтанной новой мутацией или наследование может быть сложным. Таким образом, термин «идиопатическая генерализованная эпилепсия» используется как синоним генетической генерализованной эпилепсии, и клиницист может выбрать, какой термин использовать, в зависимости от важности акцента на генетическом наследовании для конкретного пациента. Генетические / идиопатические генерализованные эпилепсии включают детскую абсансную эпилепсию, юношескую абсансную эпилепсию, юношескую миоклоническую эпилепсию, и эпилепсию с генерализованными тонико-клоническими приступами.
Фокальная эпилепсия
Пациенты с фокальной эпилепсией имеют фокальные типы приступов и могут иметь типичные интериктальные и / или иктальные ЭЭГ-паттерны, которые сопровождают фокальные типы приступов (такие как фокальные острые волны или фокальное интериктальное замедление). Нейроимиджинг демонстрирует фокальную структурную аномалию мозга и способствует установке диагноза, хотя пациенты с генетической этиологией и нормальной визуализацией могут также иметь фокальную эпилепсию. Фокальные эпилепсии могут быть унифокальными, мультифокальными или полушарными.
Сочетанная генерализованная и фокальная эпилепсия
Пациенты могут иметь как генерализованные, так и фокальные типы приступов, с интериктальными и / или иктальными ЭЭГ-паттернами, которые сопровождают оба типа приступов. Пациенты с синдромом Драве и синдромом Леннокс-Гасто могут иметь генерализованную и фокальную эпилепсию.
Неизвестная эпилепсия
Термин «неизвестный» используется для обозначения в случае, когда понимается, что у пациента есть эпилепсия, но невозможно определить, является ли она фокальной, генерализованной или комбинированной: фокальной и генерализованной. Это бывает при недостаточной информации для классификации эпилепсии, например, если ЭЭГ является нормальной / неинформативной.
Синдромы эпилепсии
В то время как концептуализация эпилепсий по их этиологии очень важна, эпилепсии также могут быть организованы (в соответствии с установленными достоверными общепринятыми клиническими и ЭЭГ — характеристиками) в эпилептические синдромы. Такие синдромы имеют типичный возраст начала приступа, специфические типы приступов и характеристики ЭЭГ и часто другие признаки, которые вместе взятые позволяют диагностировать конкретный эпилептический синдром. Идентификация синдрома эпилепсии полезна, так как она предоставляет информацию о том, какие основные этиологии следует учитывать и какие антиконвульсанты могут быть наиболее полезными. Некоторые эпилептические синдромы демонстрируют аггравацию приступов при определенных антиконвульсантах, чего можно избежать при ранней диагностике синдрома эпилепсии.
Эпилептические синдромы
Неонатальный и младенческий период:
Детский возраст:
Подростковый и взрослый возраст:
Любой возраст:
Этиология эпилепсии
В последние годы значительно расширилось наше понимание основополагающих причин эпилепсии, подкрепленное достижениями в области современной нейровизуализации и генетического тестирования. Такая терминология, как «идиопатическая», «криптогенная» и «симптоматическая», больше не используется. Эпилепсии теперь описываются более точно конкретными основополагающими причинами.
Генетическая этиология
Понятие генетической эпилепсии заключается в том, что эпилепсия, насколько мы понимаем, является прямым результатом известного или предполагаемого генетического дефекта (ов), в котором судороги являются основным симптомом расстройства. Генетический дефект может возникать на хромосомном или молекулярном уровне. Важно подчеркнуть, что «генетический» не означает то же, что «унаследовано», поскольку мутации de novo не являются редкостью. Наличие генетической этиологии не исключает экзогенного влияния на возникновение эпилепсии.
Наиболее важные генетические причины эпилепсии, которые могут быть идентифицированы при клиническом тестировании:
Существует много способов, которыми генетические факторы могут способствовать развитию эпилепсии. Определенные генетические факторы, возможно, не были унаследованы и не могут быть переданы потомству. Вот некоторые важные генетические концепции, используемые на этом веб-сайте, и их определения:
Структурная этиология
Структурные эпилепсии определяются как имеющие выраженную структурную аномалию мозга, которая связана с существенно повышенным риском эпилепсии. Структурная аномалия мозга может быть приобретена (например, вследствие инсульта, травмы или инфекции) или может быть генетического происхождения; однако, как мы это понимаем в настоящее время, структурная аномалия мозга представляет собой отдельное нарушение, расположенное между приобретенным или генетическим дефектом и эпилепсией.
Нейроимиджинг
Магнитно-резонансная томография (МРТ) с использованием 1.5 Тесла аппарата является минимальным стандартным исследованием для исключения структурной аномалии. При этом исследовании важно выполнять протоколы, специфические для эпилепсии, которые позволяют тщательно изучать специфические приобретенные аномалии (например, склероз гиппокампа ) и тонкие пороки развития коры головного мозга, такие как фокальная дисплазия коры. Изображение с использованием 3 Тесла и использование передовых методов анализа программного обеспечения может помочь в выявлении структурных нарушений, не очевидных при обычной МРТ. Интериктальная и иктальная ЭЭГ вместе с дополнительными функциональными исследованиями нейровизуализации, такими как ПЭТ, ОФЭКТ и МЭГ, помогают внимательно изучить конкретную область мозга и идентифицировать тонкую аномалию. У детей младшего возраста в возрасте до 2 лет тонкие аномалии не могут быть выявлены из-за незаконченной миелинизации, и повторное исследование требуется в динамике.
Общие структурные аномалии мозга, связанные с эпилепсией:
Метаболическая этиология
Метаболические эпилепсии определяются как имеющие определенное метаболическое нарушение, связанное с выраженным риском развития эпилепсии. Метаболические расстройства имеют генетическое происхождение; однако, как мы это понимаем в настоящее время, метаболические аномалии представляют собой отдельное нарушение, стоящее между генетическим дефектом и эпилепсией.
Важные метаболические эпилепсии:
Иммунная этиология
Иммунные эпилепсии определены как имеющие выраженную иммунную опосредованную этиологию с подтверждением воспаления центральной нервной системы, что, как было показано, связано с существенно повышенным риском развития эпилепсии.
Важные иммуноопосредованные эпилепсии:
Инфекционная этиология
Наиболее распространенная этиология эпилепсии во всем мире является инфекционной, особенно в развивающихся странах. Инфекции в центральной нервной системе могут вызывать как острые симптоматические припадки (которые тесно связаны со сроками первичной инфекции), так и эпилепсией. Инфекционная этиология включает туберкулез, ВИЧ, церебральную малярию, нейроцистицеркоз, подострый склерозирующий панэнцефалит, церебральный токсоплазмоз. Эти инфекции иногда имеют структурный коррелят, однако основная причина эпилепсии определяется как инфекционный процесс. Инфекционная этиология может иметь специфические последствия лечения. Существуют также последствия для общественного здравоохранения, поскольку профилактика таких инфекций может снизить нагрузку на эпилепсию, особенно в развивающихся странах. Наиболее распространенные из таких инфекций следующие:
Неизвестная этиология
«Неизвестная» этиология должна рассматриваться нейтрально и обозначать, что природа основной причины возникновения эпилепсии пока неизвестна; это может быть фундаментальный генетический дефект или отдельное, пока еще установленное, нарушение.
Имитаторы эпилепсии
Существует ряд состояний, связанных с рецидивирующими пароксизмальными событиями, которые могут имитировать симптомы, и ошибочно диагностироваться как эпилепсия. Важно, чтобы эти расстройства учитывались при оценке пароксизмальных событий, так как частота ошибочных диагнозов при эпилепсии высока во всем мире. История заболевания и видеозапись приступов помогают установить правильный диагноз. Существуют некоторые состояния, при которых могут сосуществовать эпилептические и неэпилептические события.
Синкопальные и аноксические приступы
Поведенческие, психологические и психиатрические нарушения
Связанные со сном состояния
Пароксизмальные двигательные расстройства
Мигрень-ассоциированные расстройства
Различные события
Диагностика эпилепсии
С современных позиций определяется 5 этапов:
Институт детской неврологии и эпилепсии
ИДНЭ (с 2006 года), ИДВНЭ (с 2016 года), ЦЗиР (с 2017) и ОЦМУ (с 2019) им. Святителя Луки
ФОКАЛЬНАЯ ЭПИЛЕПСИЯ ДЕТСКОГО ВОЗРАСТА СО СТРУКТУРНЫМИ ИЗМЕНЕНИЯМИ В МОЗГЕ И ДОБРОКАЧЕСТВЕННЫМИ ЭПИЛЕПТИФОРМНЫМИ ПАТТЕРНАМИ НА ЭЭГ (ФЭДСИМ-ДЭПД) (ПРЕДВАРИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ)
Карта сайта
Контакты
+7 (495) 181 31 01
(Единый многоканальный номер регистратуры; включая запись на консультации и видео-ЭЭГ мониторинг)
+7 (495) 669-83-93
+7 (495) 840-52-52
(ИДНЭ, г. Троицк)
+7 (495) 437-61-16
(ИДВНЭ, ул. Академика Анохина)
+7 (495) 972-80-46
(Отделение сна и эпилепсии, Троицк; зав. отделением, к.м.н., доцент Л.Ю. Глухова)
+7 (903) 785-91-39
(Лаборатория прехирургической диагностики эпилепсии, зав. доцент к.м.н. Чадаев В.А.)
+7 (495) 181-12-03
(Центр здоровья и развития имени Святителя Луки)
Фокальные и мультифокальные периферические невропатии при сахарном диабете
Поражения периферической нервной системы относятся к наиболее частым осложнениям сахарного диабета (СД), наряду с поражением глаз и почек. Большинство случаев поражения периферической нервной системы при СД составляет полиневропатия, характеризующаяся диффузным симметричным поражением нервных волокон. К диагностике и лечению полиневропатии обычно привлечено основное внимание неврологов и эндокринологов, оказывающих помощь пациентам с СД. Между тем фокальные и мультифокальные формы поражения периферической нервной системы (радикулопатии и радикулоплексопатии, множественные и изолированные мононевропатии) хотя и встречаются реже, протекают более остро, драматично и зачастую вызывают сложные проблемы в диагностике и лечении. В их развитии ключевую роль играет сосудистый механизм, тогда как метаболические нарушения имеют более важное значение в формировании медленно прогрессирующих полиневропатий. Поскольку в развитии фокальных и мультифокальных форм диабетической невропатии решающее значение имеет диабетическая микроангиопатия, важным направлением в их терапии может считаться применение препаратов с вазомоторным действием (прежде всего пентоксифиллина), которые способны предотвращать или корригировать дисфункцию нервных волокон за счет улучшения перфузии и оксигенации нервной ткани.
Поражения периферической нервной системы относятся к наиболее частым осложнениям сахарного диабета (СД), наряду с поражением глаз и почек. Большинство случаев поражения периферической нервной системы при СД составляет полиневропатия, характеризующаяся диффузным симметричным поражением нервных волокон. К диагностике и лечению полиневропатии обычно привлечено основное внимание неврологов и эндокринологов, оказывающих помощь пациентам с СД. Между тем фокальные и мультифокальные формы поражения периферической нервной системы (радикулопатии и радикулоплексопатии, множественные и изолированные мононевропатии) хотя и встречаются реже, протекают более остро, драматично и зачастую вызывают сложные проблемы в диагностике и лечении. В их развитии ключевую роль играет сосудистый механизм, тогда как метаболические нарушения имеют более важное значение в формировании медленно прогрессирующих полиневропатий. Поскольку в развитии фокальных и мультифокальных форм диабетической невропатии решающее значение имеет диабетическая микроангиопатия, важным направлением в их терапии может считаться применение препаратов с вазомоторным действием (прежде всего пентоксифиллина), которые способны предотвращать или корригировать дисфункцию нервных волокон за счет улучшения перфузии и оксигенации нервной ткани.
Поражения периферической нервной системы относятся к наиболее частым осложнениям сахарного диабета (СД), наряду с поражением глаз и почек. По данным различных исследований, частота периферических невропатий среди больных СД варьирует в широких пределах – от 10 до 90% в зависимости от методологии исследования и применяемых критериев диагностики. В среднем она составляет около 25%, при углубленном неврологическом исследовании возрастает до 50%, а при применении электрофизиологических методов исследования, исследовании вегетативных функций и количественной оценке чувствительности – до 90%. У 5–10% пациентов неврологические нарушения являются первыми симптомами заболевания и позволяют в последующем диагностировать СД [1–3].
Большинство случаев поражения периферической нервной системы при СД составляет полиневропатия, характеризующаяся системным избирательным поражением нервных волокон. К диагностике и лечению полиневропатии обычно привлечено основное внимание неврологов и эндокринологов, оказывающих помощь пациентам с СД. Между тем другие фокальные и мультифокальные формы поражения периферической нервной системы хотя и встречаются реже, протекают более драматично и зачастую вызывают проблемы в диагностике и лечении. Во многом это объясняется тем, что фокальные и мультифокальные невропатии возникают на ранней стадии СД, когда основной диагноз еще не поставлен [1, 4, 5].
Классификация диабетической невропатии
Варианты диабетической невропатии различаются по клинике, патогенезу, гистологическим изменениям, течению, реакции на лечение, прогнозу (см. таблицу). Как и другие заболевания периферической нервной системы, диабетические невропатии условно могут быть разделены [1, 6]:
Полиневропатия – наиболее частая форма поражения периферической нервной системы при СД, которая характеризуется диффузным поражением нервных волокон, вовлекающим их независимо от того, в состав какого нерва они структурно входят, и проявляющимся относительно симметричной симптоматикой. Особенностью СД является комбинация различных форм поражения периферической нервной системы, поэтому выделить чистые формы представляется возможным далеко не всегда [1, 7].
По течению диабетические невропатии можно разделить на острые (краниальные и другие мононевропатии, радикулопатии, радикулоплексопатия, острая сенсорная полиневропатия и др.) и хронические (дистальная сенсомоторная и вегетативная полиневропатии, туннельные невропатии и т.д.). Первые часто бывают обратимыми, могут развиться на любой стадии диабета, в том числе на ранней, а их тяжесть плохо коррелирует с уровнем гипергликемии. Невропатии с грубым дефектом могут развиться даже на фоне умеренной гипергликемии. Они чаще возникают у пациентов с СД 2 типа, особенно у мужчин среднего и пожилого возраста, и могут не сопровождаться другими осложнениями СД. Вторые наблюдаются более часто и, как правило, возникают у лиц, длительно страдающих СД и имеющих другие его осложнения. Они примерно с одинаковой частотой наблюдаются у пациентов с СД 1 и 2 типов, у мужчин и женщин. Их тяжесть в большей степени соответствует уровню и длительности гипергликемии.
По распределению симптомов невропатии могут быть разделены на симметричные и асимметричные. По определению только первые могут быть формально отнесены к полиневропатиям и в данной статье не рассматриваются.
Асимметричные формы связаны с фокальным и мультифокальным поражением периферической нервной системы.
Весьма вероятно, что в основе различных вариантов диабетической невропатии могут лежать неодинаковые механизмы. В частности, при остро развивающихся асимметричных невропатиях ключевую роль играет сосудистый механизм, тогда как метаболические нарушения имеют более важное значение в развитии медленно прогрессирующих симметричных полиневропатий.
Диабетическая радикулоплексопатия характеризуется мультифокальным поражением корешков, спинномозговых нервов и сплетений преимущественно на пояснично-крестцовом уровне (диабетическая пояснично-крестцовая радикулоплексопатия – ДПКРП). В прошлом для ДПКРП использовали термины «диабетическая моторная невропатия», «диабетическая амиотрофия», «синдром Брунса – Гарланда», «проксимальная диабетическая невропатия», «диабетическая полирадикулопатия» и т.д.
Клинически ДПКРП проявляется двумя формами, различия между которыми весьма условны: асимметричной, как правило с более быстрым развитием, и симметричной – с более медленным развитием и преимущественным поражением дистальных участков проксимальных моторных ветвей. Хотя асимметричную форму чаще связывают с ишемическим повреждением нервных волокон вследствие микроангиопатии, а симметричную – с метаболическим поражением, по-видимому, они образуют единый спектр и имеют общие механизмы патогенеза. Одним из полюсов этого спектра можно считать односторонние радикулопатии, которые рассмотрены ниже [3, 6, 8].
В последние годы накапливаются данные о том, что в части случаев ДПКРП обусловлена аутоиммунным микроваскулитом, который вызывает ишемию нервных стволов с развитием аксональной дегенерации и сегментарной демиелинизации, в связи с чем предпринимаются попытки ее лечения иммунотропными средствами [3].
Распространенность ДПКРП неизвестна, однако, по некоторым данным, она развивается примерно у 1% больных СД. ДПКРП может быть первым проявлением диабета, но чаще возникает при длительном его течении. Несмотря на то что ДПКРП часто вызывает тяжелые неврологические расстройства, она тем не менее имеет благоприятный прогноз – в течение нескольких месяцев (иногда одного-двух лет) у подавляющего большинства больных происходит спонтанное восстановление.
Асимметричная форма ДПКРП (асимметричная проксимальная моторная полиневропатия, диабетическая амиотрофия второго типа) преимущественно характеризуется мультифокальным повреждением верхнепоясничных корешков и/или поясничного сплетения.
Первым проявлением обычно бывает интенсивный болевой синдром, преимущественно по передней поверхности бедра, в пояснице, иногда ягодице, который часто ошибочно принимается за вертеброгенную люмбоишиалгию. Однако в отличие от вертеброгенной боли пациенты с диабетической невропатией, чтобы приглушить боль, которая часто усиливается ночью, вынуждены вставать с постели и ходить по комнате. В отличие от дистальной полиневропатии больные часто могут назвать день, когда у них развилось заболевание. Боль может быть различного характера: простреливающая или пронизывающая, жгучая, глубинная мозжащая и т.д. Иногда боль бывает столь сильной, что требует введения наркотических анальгетиков.
Вслед за болевым синдромом в течение нескольких дней или недель развиваются слабость и атрофия передних мышц бедра и мускулатуры тазового пояса, иногда с фасцикуляциями мышц. Из-за слабости мышц и боли у больных особенно затруднены вставание со стула и подъем по лестнице. Нарушения чувствительности обычно минимальны или отсутствуют. Иногда выявляются гипералгезия и механическая аллодиния, характеризующаяся тем, что тактильные раздражения ощущаются как болевые.
Нередко отмечается усиление или появление боли при разгибании тазобедренного сустава (положительный симптом Вассермана). Первоначально односторонняя, симптоматика со временем становится более распространенной и, как правило, переходит на другую сторону, оставаясь асимметричной. У части пациентов вовлекаются не только проксимальные, но и дистальные отделы конечностей. Иногда амиотрофия сопровождается необъяснимым снижением массы тела (на 10–50%) и диабетической кахексией. У таких больных часто подозревают злокачественные новообразования.
Осмотр выявляет слабость и атрофию передних мышц бедра, слабость сгибателей бедра (подвздошно-поясничной мышцы) и мышц, приводящих бедро. В то же время функция ягодичных мышц и задней группы мышц бедра остается относительно сохранной. Снижение чувствительности может быть выражено минимально. Коленный рефлекс обычно выпадает. Хотя функция разгибателей и сгибателей стоп часто остается сохранной и больные могут успешно ходить как на пятках, так и на носках, у многих больных одновременно отмечаются проявления дистальной симметричной полиневропатии.
Чаще всего вовлекаются мышцы, иннервируемые бедренным и запирательным нервами, что указывает на поражение корешков L2–L4 или поясничного сплетения. Различить эти два состояния можно лишь с помощью электромиографии (ЭМГ), которая выявляет денервационные изменения в параспинальных мышцах только при радикулопатии, но не при плексопатии. У больных нередко отмечаются фасцикуляции мышц, как спонтанные, так и провоцируемые перкуссией. Изредка амиотрофия возникает в области верхних конечностей.
При стимуляции бедренного нерва выявляется уменьшение амплитуды М-ответа при негрубом снижении скорости проведения по моторным волокнам, при игольчатой ЭМГ – признаки денервации и реиннервации в проксимальных и дистальных мышцах, свидетельствующие об аксональном типе поражения. Тем не менее при исследовании биоптата промежуточного кожного нерва бедра и запирательного нерва иногда отмечаются признаки демиелинизации, а также воспалительная инфильтрация vasa nervorum. Иногда выявляется увеличение латенции F-волны. Анализ данных электронейромиографии может затрудняться и из-за наличия признаков сопутствующей дистальной сенсомоторной полиневропатии [4, 8].
При исследовании цереброспинальной жидкости может отмечаться повышение уровня белка, в некоторых случаях – минимальный лимфоцитарный плеоцитоз. Иногда выявляется увеличение скорости оседания эритроцитов. При проведении магнитно-резонансной томографии могут выявляться изменения интенсивности сигнала от пояснично-крестцовых корешков и сплетения.
Даже в тяжелых случаях, когда больные на некоторое время утрачивают способность к самостоятельному передвижению, прогноз относительно благоприятен. Боль обычно проходит в течение нескольких недель, но иногда длится шесть – девять месяцев. Парез и атрофия сохраняются в течение многих месяцев. Иногда восстановление занимает несколько лет, а у некоторых больных сохраняется резидуальный дефект. Восстановление коленного рефлекса происходит лишь у 50% больных.
Дифференциальную диагностику приходится проводить с радикулопатиями и плексопатиями недиабетической природы (в частности, с гематомой или лимфомой ретроперитонеального пространства), со сдавлением конского хвоста (например, при травме или опухоли), стенозом поясничного позвоночного канала, а также с ишемией мышц бедра, возникающей иногда при тяжелом СД и проявляющейся острой болью, локальной болезненностью и отеком бедра. Особенно часто поражаются латеральная головка четырехглавой мышцы, отводящие мышцы и двуглавая мышца бедра.
Симметричная форма ДПКРП (симметричная проксимальная моторная полиневропатия, или диабетическая амиотрофия первого типа) встречается существенно реже, ее выделение в отдельную форму оспаривается многими авторами. Она характеризуется подостро, на протяжении нескольких недель или месяцев, нарастающей слабостью и атрофией проксимальных мышц ног (прежде всего четырехглавой мышцы бедра, подвздошно-поясничной мышцы и задних мышц бедра), иногда – мышц плечевого пояса и плеча. У некоторых больных возникает слабость в дистальных отделах конечностей. Как и при асимметричной форме, может отмечаться тяжелый болевой синдром, однако нарушения чувствительности выражены минимально или отсутствуют. Сухожильные и периостальные рефлексы выпадают. Электрофизиологически выявляются признаки как сегментарной демиелинизации, так и аксонопатии. При исследовании цереброспинальной жидкости обычно выявляется умеренное повышение уровня белка – до 1 г/л. На фоне нормогликемии обычно наблюдается хорошее восстановление в течение нескольких месяцев, однако иногда оно бывает неполным.
Данное состояние иногда ошибочно принимают за первичное мышечное поражение или миелопатию. Избежать ошибки помогают тщательный осмотр, выявляющий нарушение чувствительности и выпадение рефлексов на верхних и нижних конечностях, отсутствие проводниковых нарушений, данные электронейромиографии, а также исследование активности креатинфосфокиназы, повышение которой характерно для многих миопатий.
Другие варианты фокальной диабетической невропатии
Диабетическая радикулопатия близка к описанной выше радикулоплексопатии и некоторыми авторами рассматривается как ее разновидность. Радикулопатия чаще всего вовлекает грудные, поясничные и крестцовые, реже шейные корешки. Обычно она сопровождается болью и потерей чувствительности, гиперестезией или аллодинией в соответствующей зоне иннервации. В результате поражения нижнегрудных (D6–D12) корешков развивается так называемая торакоабдоминальная радикулоневропатия. Клинически обычно выявляется поражение одного-двух смежных корешков. Иногда симптоматика бывает двусторонней и сопровождается признаками поражения верхнепоясничных корешков.
Характерна интенсивная опоясывающая боль в средней или нижней части грудной клетки, иррадиирующая в верхние или средние отделы живота, которую нередко ошибочно принимают за проявление патологии органов брюшной полости, сердца, плевры. Иногда таких больных даже подвергают операции (особенно часто холецистэктомии). Вследствие тактильной аллодинии малейшее соприкосновение с одеждой или постельным бельем может усиливать боль.
При исследовании выявляется гипестезия или гиперестезия в соответствующих дерматомах. Одновременно страдают и двигательные волокна, но их поражение чаще остается субклиническим. При вовлечении нескольких смежных корешков, иннервирующих мышцы стенки живота, возможно формирование абдоминальной грыжи. Клинически состояние напоминает опоясывающий герпес до появления высыпаний.
Денервация параспинальных мышц при ЭМГ свидетельствует о поражении корешка или спинномозгового нерва. Боль обычно проходит в течение нескольких дней, тогда как нарушение чувствительности регрессирует в течение четырех – шести недель.
Радикулопатии возникают преимущественно у пожилых больных СД 2 типа и реже при продолжительном СД 1 типа. Быстрое развитие симптомов часто наводит на мысль об остром торакальном или абдоминальном заболевании, что заставляет врачей проводить ряд диагностических процедур, оказывающихся тщетными (следует отметить, что боль при инфаркте миокарда может отсутствовать при развитии вегетативной невропатии) [9].
Радикулопатия проявляется строго унилатеральными симптомами и часто сопровождается признаками легкой полиневропатии. Разрешение симптомов происходит самое большее в течение трех месяцев.
Мононевропатии чаще всего представлены компрессионными (туннельными), реже некомпрессионными невропатиями, которые, как правило, возникают на фоне полиневропатии и бывают двусторонними. Особенно часто выявляется компрессия срединного нерва в области запястного канала и локтевого нерва в области локтя. Выраженные нарушения чувствительности или амиотрофии в области кисти у больных с минимальным вовлечением ног обычно обусловлены именно синдромом запястного канала. На ногах чаще поражаются большеберцовый, бедренный нервы, латеральный кожный нерв бедра, малоберцовый нерв. Поражение нервов сопровождается интенсивной болью. Соответствия между их возникновением, состоянием углеводного обмена и проводимой антидиабетической терапией не выявляется [10].
Краниальная невропатия особенно часто вовлекает глазодвигательный (III) нерв, реже – отводящий (VI), очень редко – блоковый (IV) (острая диабетическая офтальмоплегия). Обычно поражаются лица старше 50 лет. Поражение нервов обычно имеет ишемическую природу. Заболевание начинается остро с односторонней интенсивной, иногда плохо переносимой боли в периорбитальной области, которая опережает появления слабости на несколько дней. При осмотре наблюдается ограничение подвижности глазного яблока при сохранных зрачковых реакциях. Это объясняется тем, что при ишемии страдают центральные волокна нерва, тогда как парасимпатические волокна, расположенные по периферии, остаются сохранными. При компрессии нерва, например аневризме задней соединительной артерии, первым симптомом обычно бывает расширение зрачка. Прогноз благоприятный – полное восстановление в течение трех – шести месяцев. Однако иногда процесс несколько затягивается. В отдельных случаях краниальные невропатии рецидивируют.
Множественная мононевропатия проявляется острым ишемическим поражением отдельных периферических нервов, одновременным или последовательным. Некоторые авторы предлагают не выделять данную форму как самостоятельную, а рассматривать ее как вариант радикулоплексопатии.
Патогенез диабетической невропатии
Любая форма диабетической невропатии в конечном итоге связана с гипергликемией. Ключевая роль гипергликемии подтверждается тем фактом, что развитие невропатии можно предотвратить, если поддержать нормальный уровень глюкозы в крови в течение длительного времени. Однако при фокальной и мультифокальной невропатии патогенная роль гипергликемии опосредована поражением микроваскулярного русла.
Нервная ткань характеризуется высоким уровнем метаболизма, причем основным источником энергии является процесс окисления углеводов. Парадоксально, но избыток внутриклеточной глюкозы оказывает неблагоприятное воздействие на функцию нервов. В эксперименте показано, что при СД выработка энергии нейронами снижается на 20–30%.
Следствием повышенного содержания глюкозы в клетках является интенсификация неферментативного гликирования. Это ведет к быстрому накоплению в клетках токсичных конечных продуктов гликирования, которые могут играть важнейшую роль в развитии многих осложнений СД. Содержание конечных продуктов гликирования в нервных волокнах и vasa nervorum у больных СД 2 типа существенно выше нормы, более того – коррелирует с плотностью миелинизированных волокон в периферическом нерве. В эксперименте показано, что, воздействуя на специфические рецепторы, конечные продукты гликирования повышают продукцию моноцитами и эндотелиальными клетками цитокинов и адгезивных молекул.
Диабетическая микроангиопатия, поражающая vasa nervorum, вызывает ишемическое повреждение и дегенерацию нервных волокон. Микроангиопатия при СД характеризуется повреждением эндотелиальных клеток за счет накопления гликогенсодержащих структур, дегенерацией перицитов (клеток, формирующих слой, наружный по отношению к эндотелию микрососудов, и, возможно, играющих роль в поддержании гематоневрального барьера), а также утолщением базальной мембраны, что приводит к сужению просвета капилляров и нарушает микроциркуляцию в пораженных областях. При биопсии нервов у больных СД выявляются утолщение стенок и изменение калибра капилляров, микротромбозы, частичная или полная закупорка капилляров.
Главным фактором, вызывающим повреждение сосудистых стенок, по-видимому, является гипергликемия, на фоне которой происходит увеличение поглощения глюкозы эндотелиоцитами.
Накопление конечных продуктов гликирования, продуктов воспаления, интенсификация перекисного окисления липидов могут быть основными факторами, приводящими к дисфункции эндотелия. О дисфункции эндотелиальных клеток свидетельствует повышение уровня эндотелина в плазме, что в свою очередь усугубляет поражение сосудистой стенки.
Дисфункция эндотелия приводит к снижению продукции NO, простациклина PGI2 и увеличению содержания в плазме фактора Виллебранда. В результате могут повышаться свертывающая активность крови и уровень активации тромбоцитов.
Дисфункция тромбоцитов при СД выражается в повышении метаболизма арахидоновой кислоты и продукции тромбоксана, а также в снижении продукции NO. Таким образом, снижение продукции NO может быть результатом дисфункции как эндотелиальных клеток, так и тромбоцитов.
Ключевое значение в развитии диабетической невропатии имеют повышенная продукция свободных радикалов и истощение антиоксидантных механизмов с развитием окислительного стресса.
Предполагают, что определенную роль в развитии диабетической невропатии, особенно радикулоплексопатии и множественной мононевропатии, играют воспалительные аутоиммунные процессы. В частности, у больных диабетической радикулоплексопатией выявлялась повышенная продукция провоспалительных цитокинов, а при исследовании биоптата нервов – признаки васкулита.
Лечение диабетической невропатии
Диабетическую невропатию проще предупреждать, чем лечить. Хороший контроль СД позволяет существенно снизить риск ее развития. В исследовании DCCT (1993), включавшем более тысячи больных СД 1 типа, было показано, что на фоне интенсивной инсулинотерапии частота развития невропатии и микроангиопатий через шесть с половиной лет была на 60% ниже, чем при традиционной терапии инсулином.
Аналогичные выводы были сделаны и в исследовании UKPDS, включавшем более 5000 больных СД 2 типа. Показано, что при проведении интенсивной терапии, при которой уровень глюкозы поддерживался на уровне ниже 6 ммоль/л, частота полиневропатии к концу девятого года исследования была на 16%, к концу пятнадцатого года – на 40% ниже, чем в группе пациентов, у которых концентрация глюкозы поддерживалась на более высоком уровне (≤ 15 ммоль/л).
Связь между улучшением контроля гипергликемии и более благоприятным течением невропатии особенно четко прослеживается у пациентов с СД 1 типа, в то же время у пациентов с СД 2 типа ситуация менее определенная. В нескольких исследованиях не удалось показать, что более интенсивная терапия СД 2 типа ускоряет регресс симптомов или хотя бы замедляет прогрессирование невропатии. Нет убедительных данных о том, что перевод больных СД 2 типа, страдающих диабетической невропатией, с пероральных противодиабетических препаратов на инсулин способствует стабилизации или улучшению их состояния. Тем не менее при развитии диабетической радикулоплексопатии (диабетической амиотрофии) на фоне плохо контролируемого СД 2 типа часто рекомендуют временно перейти на терапию инсулином.
В целом следует отметить, что оптимизация контроля гипергликемии – единственный известный метод предупреждения развития диабетической невропатии и главная составляющая ее лечения, но, к сожалению, она не решает всех проблем, связанных с этим осложнением СД [9, 11–13]. Таким образом, сохраняется потребность в лекарственных средствах, воздействующих на различные звенья патогенеза диабетической невропатии.
Применение препаратов нейрометаболического действия
Для лечения диабетической невропатии в разные годы были предложены различные средства нейрометаболического действия, однако в клинической практике наиболее широкое распространение получили препараты жирорастворимых производных тиамина и тиоктовой кислоты.
Механизм действия тиамина при диабетической невропатии может быть связан прежде всего с его способностью тормозить гликолиз, образование лактата и конечных продуктов гликирования. Благодаря этому ослабляется токсический эффект гипергликемии. Тормозя гликирование белков, тиамин и его активный метаболит – тиаминпирофосфат могут препятствовать развитию невропатии у больных СД и способствовать регрессу поражения нервных волокон.
Бенфотиамин создает более высокую концентрацию тиамина в крови, чем традиционные препараты, причем после его приема достаточно высокая концентрация поддерживается в течение более длительного времени [14]. Кроме того, бенфотиамин значительно лучше проникает через гематоневральный барьер и создает более высокую концентрацию внутри нервного волокна. Применение бенфотиамина может способствовать регрессу болевого синдрома, нарушений чувствительности, вегетативных проявлений невропатий. Бенфотиамин назначается в виде монотерапии или в комбинации с другими витаминами группы В.
Благоприятное влияние тиоктовой кислоты на микроциркуляцию у больных диабетической полиневропатией доказано с помощью видеокапилляроскопии. Клиническая эффективность тиоктовой кислоты при диабетической невропатии подтверждена результатами нескольких рандомизированных двойных слепых плацебоконтролируемых исследований. Применение препаратов тиоктовой кислоты позволяет уменьшить как субъективные, так и объективные проявления диабетической невропатии, болевой синдром, улучшает чувствительность [13, 15]. При выраженных симптомах полиневропатии тиоктовую кислоту первоначально назначают внутривенно в дозе 600 мг ежедневно в течение 10–15 дней. В наиболее тяжелых случаях внутривенные инфузии проводят более длительно – до трех-четырех недель. Следует иметь в виду, что тиоктовая кислота – фоточувствительное соединение, поэтому разведенный препарат должен быть защищен от света во время инфузии.
По окончании курса внутривенных инфузий препарат назначают перорально по 600 мг один раз в сутки натощак, обычно за 30–45 минут до завтрака. Лечение проводят курсами – один-два месяца с перерывом три месяца.
При ДПКРП, в основе которой может лежать аутоиммунный васкулит, имеется положительный опыт применения глюкокортикостероидов и иммуноглобулина (внутривенно) [3, 4, 8]. Глюкокортикостероиды обычно применяют коротким курсом. В тяжелых случаях с выраженным болевым синдромом используют высокие дозы метилпреднизолона (500 мг внутривенно капельно в течение трех – пяти дней). В период лечения глюкокортикостероидами следует тщательно контролировать уровень глюкозы в крови и своевременно корригировать дозу инсулина или пероральных противодиабетических препаратов. Пациентам с СД не рекомендуется назначать глюкокортикостероиды через день во избежание резких колебаний уровня глюкозы в крови.
При применении иммуноглобулина (0,5 г/кг/сут в течение четырех дней) следует учитывать повышенный риск развития при СД острого тубулярного некроза с развитием почечной недостаточности. Для поддержания эффекта после первого курса лечения может потребоваться повторное ежемесячное внутривенное введение иммуноглобулина (0,5 г/кг). При плазмаферезе у пациентов с подтвержденной или подозреваемой вегетативной невропатией риск весьма серьезных побочных эффектов не уравновешивается относительно скромными клиническими достижениями.
Применение пентоксифиллина при диабетической невропатии
Поскольку в развитии фокальных и мультифокальных форм диабетической невропатии решающее значение имеет диабетическая микроангиопатия, поражающая vasa nervorum и приводящая к снижению кровотока (нейроваскулярная недостаточность с явлениями эндоневральной гипоксии), важным направлением терапии может стать применение препаратов с вазомоторным действием, которые в этом случае потенциально способны предотвращать или корригировать дисфункцию нервных волокон вследствие улучшения перфузии и оксигенации нервной ткани.
Наиболее убедительные преклинические предпосылки и результаты клинических испытаний имеет применение пентоксифиллина. Пентоксифиллин – производное метилксантина – обладает широким спектром клинико-фармакологических эффектов. Как показывают клинические и экспериментальные данные, пентоксифиллин улучшает микроциркуляцию и реологические свойства крови. По фармакологическому действию он относится к неселективным ингибиторам фосфодиэстеразы и может вызывать вазодилатацию как за счет эндотелийзависимого, так и за счет эндотелийнезависимого механизма. Кроме того, пентоксифиллин тормозит продукцию фактора активации тромбоцитов, снижая их способность к агрегации, повышает эластичность (деформируемость) мембраны эритроцитов и (что может быть особенно важным) тормозит продукцию воспалительных цитокинов, особенно фактора некроза опухоли альфа [3].
Показано, что диабетическая невропатия сопряжена с повышением уровня циркулирующего фактора некроза опухолей. Фактор некроза опухоли альфа нарушает кровоснабжение нервных волокон, в том числе за счет активации протеинкиназы С и стимуляции нуклеарного фактора каппа В в эндотелиальных клетках. В результате усиливается синтез эндотелина 1, снижается продукция NO и изменяется экспрессия молекул адгезии. Пентоксифиллин блокирует этот механизм, нарушающий микроциркуляцию в vasa nervorum.
Пентоксифиллин обладает антиоксидантным действием – уже упоминалась роль окислительного стресса при СД, способствующего развитию эндотелиальной дисфункции и эндоваскулярного дефицита.
Снижение агрегации тромбоцитов под действием пентоксифиллина, вероятно, зависит от торможения фосфодиэстеразы тромбоцитов и повышения в них уровня циклического аденозинмонофосфата (цАМФ). Это снижает продукцию тромбоксана, что само по себе, как показывают экспериментальные данные, способствует повышению проводимости по двигательным волокнам при диабетической невропатии.
Усиление проводимости и кровотока в нервных волокнах с помощью пентоксифиллина может блокироваться ингибиторами циклооксигеназы, но не ингибитором синтетазы NO. Это свидетельствует о том, что позитивное действие пентоксифиллина на кровоток в сосудах нервов и нервную проводимость может опосредоваться повышением уровня простациклина [1, 5].
Простациклин способствует дилатации сосудов за счет расслабления гладких мышц через цАМФ-зависимый механизм. Таким образом, основное действие пентоксифиллина может быть связано с торможением фосфодиэстеразы, вызывающим повышение уровня цАМФ и способствующим вазореклаксирующему действию эндогенного простациклина. Это позволяет частично компенсировать снижение уровня синтеза простациклина в сосудах нервных волокон и объясняет способность аналогов простациклина в эксперименте улучшать проводимость и кровоток нервных волокон. Повышение кровотока в нервных волокнах сопровождается относительным увеличением артериовенозного шунтирования, что находится в соответствии со способностью пентоксифиллина потенцировать действие простаноидов. Действие пентоксифиллина может усиливаться гамма-линоленовой кислотой, также способствующей повышению синтеза простаноидов.
Клинические наблюдения показывают, что пентоксифиллин способствует уменьшению как субъективных, так и объективных признаков невропатии и, как следствие, может применяться для лечения фокальных или мультифокальных форм диабетической невропатии.
Важно, что он также является препаратом выбора при перемежающейся хромоте у пациентов с атеросклерозом нижних конечностей, который нередко развивается у пациентов с СД.
В зависимости от клинической картины пентоксифиллин может назначаться как внутривенно капельно в дозе 100–200 мг в начале лечения, так и перорально в дозе 400 мг два-три раза в сутки в течение 8–24 недель. Максимальная суточная доза препарата составляет 1200 мг.
Сравнительные исследования продемонстрировали более высокую эффективность и безопасность оригинального препарата пентоксифиллина (Трентал) по сравнению с таковыми шести его дженериков [16].