в какой среде окислительные свойства перманганата калия kmno4 выражены наиболее сильно
В какой среде окислительные свойства перманганата калия kmno4 выражены наиболее сильно
Репетитор по химии и биологии
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Хватит бояться ОВР! 9.6. Галерея классических окислителей. Перманганат
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Вначале давайте вспомним, кто такие окислители и чем они отличаются от восстановителей?
2) Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
3) Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (равна номеру группы).
3) Степень восстановления атома Mn+7 зависит от рН среды
Внимательно прочитайте примеры ОВР с участием перманганата калия в различных средах и попробуйте прописать их самостоятельно.
1) Перманганат в кислой среде
2) Перманганат в нейтральной среде
3) Перманганат в щелочной среде
На закуску дарю небольшую подборку вариантов 30-х заданий ЕГЭ с перманганатом калия. Попробуйте выполнить задания и написать ОВР методом полуреакций. Правильность написания ОВР можно проверить по готовым молекулярным уравнениям реакции.
Задание 30 (5 вариантов с решением)
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Допустимо использование водных растворов веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) перманганат калия, иодид калия, сульфат аммония, ацетат натрия, сульфат магния
2) бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия
3) перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия
4) нитрит калия, перманганат калия, нитрат натрия, хромат натрия, хлорид бария
5) перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова (II)
Ссылки на статьи, в которых очень подробно разобрана технология написания окислительно-восстановительных реакций:
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья ВК, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Пишите мне в WhatsApp +7(903)186-74-55
Приходите ко мне на занятия, я помогу вам изучить химию и биологию, научу решать любые задачи, даже самые сложные.
Окислительные свойства перманганата калия в кислой, щелочной и нейтральной средах.



|
Восстановитель: SO3 2- + H2O → SO4 2- + 2H + 5

Вопросы для самоконтроля
1. Назовите виды химических реакций.
2. Дайте определение окислительно-восстановительным реакциям.
3. На какие типы разделяются все окислительно-восстановительные реакции?
4. Назовите важнейшие окислители и восстановители.
5. Как отличается протекание окислительно-восстановительной реакции в зависимости от среды?
Вопросы для закрепления
Пользуясь справочными таблицами «Окислительные свойства перманганата калия» и «Окислительные свойства бихромата калия» составьте возможные уравнения реакций, уравняйте методом полуреакций ( электронно-ионный метод).
В какой среде окислительные свойства перманганата калия kmno4 выражены наиболее сильно
— это реакции, протекающие с изменением степеней окисления элементов. В ходе таких реакций происходит отдача (отрыв) электронов от одного элемента и присоединение их к другому.
Важно запомнить следующие термины: окислитель, восстановитель, окисление, восстановление
Восстановителями могут быть элементы в низших степенях окисления:
— простые вещества металлы,
Окислителями могут быть элементы в высших степенях окисления:
— KMnO4, K2CrO4, K2Cr2O7,
— H2SO4 (конц), HNO3 в любой концентрации, ее соли (KNO3, NaNO3), CO2
— простые вещества F2, О3
И окислителями и восстановителями могут быть элементы с промежуточной степенью окисления:
— простые вещества неметаллы H2, Cl2, Br2, I2, S, P, N2, C
— соединения металлов в промежуточной степени окисления (FeSO2, FeCl2, Cr2(SO4)3, MnO2, K2MnO4)
— H2O2, HClO3 и ее соли
Важно : нередко в реакциях один и тот же элемент может одновременно повысить и понизить степень окисления. Такие реакции называют реакциями диспрапорционирования
В ОВР часто в реакцию вступает третье вещество, которое не является ни окислителем, ни восстановителем. Такие вещества создают среду раствора. Она может быть кислой (за счет H2SO4), нейтральной (H2O), щелочной (KOH или NaOH). Среда раствора определяет по какому пути пойдет реакция
Соединения марганца
Марганец имеет несколько степеней окисления, наиболее характерными являются +2, +4, +6, +7.
В зависимости от с.о. соединения Mn будут проявлять различную окислительно-восстановительную способность:
Соли марганца (II)
Оксид марганца (IV) MnO2
КBr не может быть окислителем, т.к. Br находится в низшей с.о. (-1)
Перманганат калия KMnO4
В зависимости от среды, в реакциях будут образовываться различные продукты восстановления Mn:
— в кислой среде образуются соли Mn (+2), например MnCl2, MnSO4
— в нейтральной среде выпадает осадок MnO2 бурого цвета
— в щелочной среде образуется манганат K2MnO4? где Mn (+6)
FeSO4 + KMnO4 + H2SO4 = Fe2(SO4) + MnSO4 + K2SO4 + H2O
KMnO4 + KNO2 + H2O = KNO3 + MnO2 + KOH
Cr2(SO4)3 + KMnO4 + KOH = K2CrO4 + K2MnO4 + K2SO4 + H2O
Соединения хрома
Хром имеет несколько степеней окисления, наиболее характерны из которых +3 и +6.
Соединения Cr (+2) не стабильны, легко окисляются до +3, являясь сильнейшими восстановителями
Соединения хрома (III)
Цвета растворимых солей располагаются в лилово-зеленой гамме в зависимости от формулы и температуры. Гидроксид хрома (III) имеет грязно-зеленый оттенок.
При взаимодействии Cr (+3) с сильными окислителями, он окисляется до Cr (+6), т.е. до хромата или бихромата (зависит от кислотности среды):
— в кислой среде образуется оранжевый бихромат (К2Cr2О7)
Хроматы и бихроматы
Ядовиты. Редко вступают в реакции ионного обмена. Так, хроматы могут реагировать с солями бария и серебра образуя желтый осадок хромата бария и кроваво-красный осадок хромата серебра.
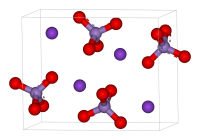
Перманганат калия ГОСТ 20490-75
| Перманганат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Перманганат калия |
| Традиционные названия | Марганцовокислый калий, марганцовка |
| Хим. формула | KMnO4 |
| Состояние | твердое (хрупкие кристаллы) |
| Молярная масса | 158,034 г/моль |
| Плотность | 2,703 г/см³ |
| Т. разл. | 240 °C |
| Мол. теплоёмк. | 119,2 Дж/(моль·К) |
| Энтальпия образования | -813,4 кДж/моль |
| Растворимость в воде | 6,38 (20 °C) |
| Рег. номер CAS | ГОСТ 5777-84 ГОСТ 20490-75 |
| Рег. номер CAS | 7722-64-7 |
| PubChem | 516875 |
| Рег. номер EINECS | 231-760-3 |
| SMILES | |
| Рег. номер EC | 231-760-3 |
| RTECS | SD6475000 |
| Номер ООН | 1490 |
| ChemSpider | 22810 |
| Токсичность | низкая |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Содержание
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Химические свойства
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4 на MnO2 и KMnO4.
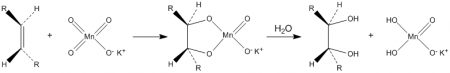
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
| Другие названия | |
|---|---|
| Лекарственные формы | |
| Классификация | |
| Химическое соединение | |
| Перманганат калия | |
| Kalii permanganas | |
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO₄ |
| CAS | 7722-64-7 |
| PubChem | 516875 |
| DrugBank | 13831 |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | D08AX06 |
| порошок для приготовления раствора | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |
| Перманганат калия | |
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на неё анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Способ применения и дозы
Наружно, в водных растворах для промывания ран ( 0,1—0,5 % ), для полоскания рта и горла ( 0,01—0,1 % ), для смазывания язвенных и ожоговых поверхностей ( 2—5 % ), для спринцевания ( 0,02—0,1 % ) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Предосторожности
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами (сахарозой, танинами, глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина, или безводным — всегда) и может привести к взрыву.
Другие сферы применения
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Ограничение на покупку
Входит в IV список прекурсоров ПККН в России (допускается исключение некоторых мер контроля).
14 июня 2013 года на Украине был признан прекурсором и внесён в список наркотических веществ.
Перманганат калия
Калия перманганат (распространённое название в быту — марганцовка) (лат. Kalii permanganas) — калиевая соль марганцевой кислоты ( K Mn O 4).
Содержание
Получение [ ]
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Физические свойства [ ]
Термодинамические свойства [ ]
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия образования S | 171,71 Дж/моль·K (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/моль·K (т) (при 298 К) |
Химические свойства [ ]
Сильный окислитель. Стандартные окислительно-восстановительные потенциалы приведены в таблице.
В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия :
Однако надо отметить, что в последняя реакция (в щелочной среде) идёт по указаной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный оксофторид :
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция коммутации в принципе обратна дисмутации ( диспропорционирование ) K2MnO4 на MnO2 и KMnO4.
Применение [ ]
Применение этой соли основано на высокой окисляющей способности перманганат-иона.
См. также [ ]
bg:Калиев перманганат bs:Kalijum permanganat cs:Manganistan draselný da:Kaliumpermanganat de:Kaliumpermanganat en:Potassium permanganate eo:Kalia permanganato es:Permanganato de potasio fi:Kaliumpermanganaatti fr:Permanganate de potassium hu:Kálium-permanganát it:Permanganato di potassio ja:過マンガン酸カリウム lt:Kalio permanganatas lv:Kālija permanganāts nl:Kaliumpermanganaat no:Kaliumpermanganat pl:Manganian(VII) potasu pt:Permanganato de potássio ro:Permanganat de potasiu simple:Potassium permanganate sk:Manganistan draselný sr:Калијум перманганат sv:Kaliumpermanganat zh:高锰酸钾





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)


_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)