в какой реакции оксид серы 4 является восстановителем so2 2naoh
В какой реакции оксид серы 4 является восстановителем so2 2naoh
14-14. Оксид серы (IV) является восстановителем в реакции, уравнение которой
4) 2SO2 + O2 = 2SO3
14-15. Ангидридом серной кислоты является: 2) SO3
14-16. Для оксида серы (IV) характерно взаимодействие с каждым из веществ:
4) оксид кальция и кислород
14-17. Для оксида серы (VI) характерно взаимодействие с каждым из веществ:
4) водой и оксидом кальция
14-18. Оксид серы (VI) взаимодействует с каждым из двух веществ
3) оксидом кальция и гидроксидом натрия
14-19. Оксид серы(IV) взаимодействует с каждым из веществ
2) Ва(ОН2 и СаО
14-20. Сместить равновесие 2SO2 + O2 ⇄ 2SO3 + Q в сторону исходных веществ можно при
4) повышении температуры и разбавлении исходной смеси аргоном
14-21. Диоксид серы получают при взаимодействии
1) сульфита калия и серной кислоты (конц. )
14-22. Диоксид серы в промышленности можно получить
А обжигом сульфидных руд на воздухе
Г сжиганием серы на воздухе
Д сжиганием Н2S при недостатке О2
1) А, Б, Г 2) А, В, Г 3) Б, В, Д 4) Б, Г, Д
14-23. Для поглощения сернистого газа (оксида серы(IV)) можно использовать сосуд, заполненный раствором
2) гидроксида лития
14-24. Верны ли следующие суждения об оксиде серы(VI)?
А. При растворении этого оксида в воде образуется кислота.
Б. Этот оксид реагирует как с гидроксидом натрия, так и оксидом бария.
3) верны оба суждения
14-25. Оксид серы(IV) не реагирует с
3) оксидом углерода(IV)
4) соляной кислотой
РАЗБОР ЗАДАНИЙ ИЗ ТЕСТОВ ЕГЭ. 1.В какой реакции оксид серы (IV) является восстановителем?
1.В какой реакции оксид серы (IV) является восстановителем?
3) SO2 + H2O 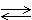
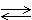
Решение. Восстановитель – это вещество, отдающее электроны. При протекании окислительно-восстановительной реакции степень окисления одного из элементов, входящего в состав вещества, повышается.
Для ответа на вопрос задания необходимо определить степень окисления серы до и после реакции. Степень окисления серы в SO2 равна +4. В первом варианте степень окисления серы в продукте реакции Na2SO3 также равна +4, т.е. реакция не является окислительно-восстановительной.
В третьем случае степень окисления серы в сернистой кислоте равна +4, т.е. такая же, как была до реакции. Этот вариант также не подходит.
2.Наибольшую степень окисления сера проявляет в соединении
2.Установите соответствие между формулой вещества и
продуктом, который образуется на катоде в результате электролиза его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ ЭЛЕКТРОЛИЗА | |
| А | Cu(NO3)2 | металл |
| Б | AgNO3 | водород |
| В | СaCl2 | кислород |
| Г | Na2SO4 | хлор |
| оксид серы (IV) |
Решение: При электролизе растворов солей на катоде происходят следующие процессы. Малоактивные металлы, стоящие в ряду напряжений после водорода, разряжаются:
Активные металлы, стоящие в ряду напряжений левее алюминия (и сам алюминий) при электролизе водных растворов не разряжаются.
Решение. При электролизе растворов солей на катоде малоактивные металлы, в нашем случае медь и серебро, стоящие в ряду напряжений после водорода, разряжаются:
Cu 2+ + ze = Cu 0 ; Ag + + e = Ag 0
Активные металлы, стоящие в ряду напряжений левее алюминия в нашем случае натрий и кальций при электролизе водных растворов не разряжаются. Вместо них разряжается вода с выделением молекулярного водорода:
ЗАДАНИЯ ИЗ ТЕСТОВ ЕГЭ
А1.Степень окисления элемента равна +3 в ионе
А2. Высшую степень окисления хром проявляет в соединении:
А3. Степень окисления + 2 кислород проявляет в следующем соединении:
А4. Как положительную, так и отрицательную степень окисления в соединениях может проявлять элемент:
1) цинк 2) хлор 3) фтор 4) криптон
А5.Атомы азота в нитрате аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
А6. В какой молекуле степень окисления элемента равна нулю, а валентность равна единице?
А7. Азот проявляет одинаковую степень окисления в каждом из двух соединений:
А8. При взаимодействии кальция и фосфора образуется соединение, в котором фосфор проявляет следующую степень окисления:
А9. Реакции, уравнение которой 4NH3 +5O2 à 4NO + 6H2O соответствует схема превращения азота
А10. Верны ли следующие суждения об окислительно-восстановительных реакциях:
А) Окисление- это процесс отдачи электронов
Б) Восстановитель всегда понижает степень окисления1. Верно только А 2.Верно только Б3. Верны оба утверждения 4. Оба утверждения неверны
А11.Формула вещества, в котором сера может проявлять только окислительные свойства, следующая:
А12.Окислительно-восстановительнойне являетсяреакция
А13. Восстановительные свойства Fe +2 проявляет в реакции:
4) FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
А14. В уравнении реакции KMnO4 + HCl = Cl2 + MnCl2 + KCl + H2O
коэффициент перед формулой вещества, являющегося окислителем:
А15.Реакции, уравнение которой MnO2 + HCl = MnCl2 + Cl2 +H2O соответствует процесс восстановления:
3) Mn +4 → Mn +2 4) O2 → 2O
А16. Верны утверждения:
А) При электролизе растворов соединений, содержащих металлы, стоящие в ряду напряжений левее алюминия, на катоде выделяется сам металл.
Б) На катоде протекают процессы окисления.
1.Верно только А 2.Верно только Б
3. Верны оба утверждения 4. Оба утверждения неверны
А17. При электролизе водного раствора какой соли на катоде и аноде будут выделяться газообразные вещества:
А18. Выделение кислорода происходит при электролизе соли:
А19. Водород выделяется при электролизе соли:
А20.Азотная кислота накапливается при пропускании электрического тока в электролизере раствора:
А21. При электролизе водного раствора соли нельзя получить
1) натрий и хлор 2) водород и кислород
3) серную кислоту и кислород 4) гидроксид калия и иод
А22. При электролизе раствора хлорида меди (II) на аноде преимущественно происходит
1) окисление ионов хлора 2) окисление воды
3) растворение меди 4) восстановление ионов меди
А23.Не выделяется на аноде кислород при электролизе раствора
1) сульфида калия 2) нитрата меди (II)
3) карбона натрия 4) сульфата алюминия
А24. Могут разряжаться на катоде и водород, и металл при электролизе:
1) сульфата алюминия 2) бромида меди (II)
3) хлорида цинка 4) нитрата серебра
В1. Установите соответствие между формулой соединения и значением степени окисления хлора в нем.
В2. Установите соответствие между схемой химической реакции и изменением степени окисления окислителя.
В3. Установите соответствие между формулой иона и его способностью проявлять окислительно-восстановительные свойства
В4.Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней восстановителем.
| СХЕМА РЕАКЦИИ | ОССТАНОВИТЕЛЬ | |
| А | 4NH3 + 6NO = 5 N2 + 6H2O | NH3 |
| Б | NO2 + Mg ® MgO + N2 | NО |
| В | SO2 + O2 ® SO3 | Mg |
| Г | NO2 + SO2 ® SO3 + NO | NO2 |
| SO2 | ||
| O2 |
| А | Б | В | Г |
В5. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора или расплава на инертных электродах.
| формула Вещества | продукты ЭЛЕктролиза | |
| А | BaBr2 (раствор) | H2, O2 |
| Б | AgNO3 раствор) | Ba, Br2 |
| В | Ba(NO3)2 (раствор) | Ba(OH)2, HBr |
| Г | BaBr2 (расплав) | Ag, O2, HNO3 |
| Ag, NO2 | ||
| Ba(OH)2, Br2, H2 |
В6. Установите соответствие между формулой вещества и продуктом, который образуется на аноде в результате электролиза его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ ЭЛЕКТРОЛИЗА | |
| А | Na2SO4 | натрий |
| Б | KI | бром |
| В | NaBr | кислород |
| Г | KOH | водород |
| йод | ||
| калий |
В7. Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ ЭЛЕКТРОЛИЗА | |
| А | AgNO3 | алюминий |
| Б | AlBr3 | бром |
| В | Na2SO4 | натрий |
| Г | AuCl3 | водород |
| серебро | ||
| золото |
ЧАСТЬ С
| Инструкция для учащихся. Запишите полное решение на отдельном листе. Ответы записывайте четко и разборчиво. За задание части С1- 3 балла, С2 максимально по 5 баллов, С3- 8 баллов |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
С2. При полном электролизе 7143 мл (плотность 1,12 г/мл) раствора сульфата двухвалентного металла, массовая доля соли в котором 5% было получено 160 г металла. На катоде газов не образовалось. Определите металл.
С3. После завершения электролиза хлорида неизвестного металла на катоде выделилось 1,3177 г металла. При растворении этой массы металла в концентрированной азотной кислоте образовалось 224 мл бурого газа (н.у.) Определите состав хлорида и его массу в растворе.
ЛИТЕРАТУРА
1. ГИА- 2011: Экзамен в новой форме: Химия: 9-й
Кл.: Тренировочные варианты экзаменационных работ для
проведения государственной итоговой аттестации в новой
форме ∕ авт. –сост. Д. Ю. Добротин, А. А. Каверина. –М.: АСТ:
2. Самое полное издание типовых вариантов реальных заданий
ЕГЭ 2011 \Химия\ авт.- сост. А. С. Корощенко, М. Г. Снатина
М.: АСТ: Астрель, 2009- ФИПИ
3. Оржековский П.А. ЕГЭ 2012. Химия: сборник заданий ∕
П. А. Оржековский, Н. Н. Богданова, Е. Ю. Васюкова и др.-М.:
4. ЕГЭ 2010.Химия: сборник экзаменационных заданий ∕ авт. –
Эксмо, 2009- Федеральный банк экзаменационных материалов
4. ЕГЭ 2009. Химия. Методическое пособие для учителей химии ∕
Екатеринбург, изд-во Уральского госуниверситета, 2009
5. ЕГЭ 2009. Химия. Методическое пособие для учеников ∕ авт.-
сост. Гусева А. Ф., Черемичкина И. А., Балдина Л. И. –
Екатеринбург, изд-во Уральского госуниверситета, 2009
Начала химии. Современный курс для поступающих в ВУЗы: в
2 томах.: Федеративная Книготорговая компания. 1997
Пособие по химии для поступающих в вузы. Программы.
Вопросы, упражнения, задачи. Образцы экзаменационных
Сборник задач и упражнений по химии для школьников и
абитуриентов.- М.: Дрофа, 2001
Химия: Решение задач – СПб.: Издательский дом «Литера»,
10. Хомченко Г. П, Хомченко И. Г.
Сборник задач по химии для поступающих в ВУЗы: М.:
Издательство Новая Волна, 2000
Химия: неорган. Химия. Орган. Химия: учеб. Для 9 кл.
общеобразоват. Учреждений М.: Просвещение, 2008
13. Габриелян О. С. Лысова Г. Г.
Химия. 11 класс: учеб для общеобразоват. учереждений.-М:
Решите срочно тест по химии!
Оксид
14-14. Оксид серы (IV) является восстановителем в реакции, уравнение которой
1) SO2 + 2NaOH = Na2SO3 + H2O 2) SO2 + 2H2S = 3S + 2H2O
3) SO2 + H2O = H2SO3 4) 2SO2 + O2 = 2SO3
14-15. Ангидридом серной кислоты является: 1) SO2 2) SO3 3) H2S 4) FeS2
14-16. Для оксида серы (IV) характерно взаимодействие с каждым из веществ:
1) оксид углерода (IV) и фосфорная кислота 2) медь и оксид углерода (IV)
3) фосфорная кислота и хлорид калия 4) оксид кальция и кислород
14-17. Для оксида серы (VI) характерно взаимодействие с каждым из веществ:
1) кислородом и оксидом кремния 2) оксидом азота (V) и фосфорной кислотой
3) фосфорной кислотой и кислородом 4) водой и оксидом кальция
14-18. Оксид серы (VI) взаимодействует с каждым из двух веществ
1) водой и соляной кислотой 2) кислородом и оксидом магния
3) оксидом кальция и гидроксидом натрия 4) водой и медью
14-19. Оксид серы(IV) взаимодействует с каждым из веществ
1)Н2О и КС1 2) Ва(ОН)2 и СаО 3) СаСО3 и ZnSO3 4)Са(ОН)2 и N2
14-20. Сместить равновесие 2SO2 + O2 ⇄ 2SO3 + Q в сторону исходных веществ можно при
1) повышении давления и поглощении оксида серы(VI) водой
2) понижении температуры и увеличении концентрации кислорода
3) повышении давления и понижении температуры
4) повышении температуры и разбавлении исходной смеси аргоном
14-21. Диоксид серы получают при взаимодействии
1) сульфита калия и серной кислоты (конц.)
2) сульфита натрия и азотной кислоты (конц.)
3) сульфата калия и иодоводородной кислоты
4) сульфида натрия и хлорной воды
14-22. Диоксид серы в промышленности можно получить
А) обжигом сульфидных руд на воздухе
Б) обработкой сульфитов серной кислотой
В) действием на сульфатные руды смесью непредельных углеводородов
Г) сжиганием серы на воздухе
Д) сжиганием Н2S при недостатке О2
1)А, Б, Г 2)А, В, Г 3)Б, В, Д 4) Б, Г, Д
14-23. Для поглощения сернистого газа (оксида серы(IV)) можно использовать сосуд, заполненный раствором
1) разбавленной серной кислоты 2) гидроксида лития
3) концентрированной серной кислоты 4) концентрированной соляной кислоты
14-24. Верны ли следующие суждения об оксиде серы(VI)?
А. При растворении этого оксида в воде образуется кислота.
Б. Этот оксид реагирует как с гидроксидом натрия, так и оксидом бария.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
14-25. Оксид серы(IV) не реагирует с
1) водой 2) кислородом 3) оксидом углерода(IV)
4) соляной кислотой 5) сероводородом 6) гидроксидом бария
14-14. Оксид серы (IV) является восстановителем в реакции, уравнение которой
4) 2SO2 + O2 = 2SO3
14-15. Ангидридом серной кислоты является: 2) SO3
14-16. Для оксида серы (IV) характерно взаимодействие с каждым из веществ:
4) оксид кальция и кислород
14-17. Для оксида серы (VI) характерно взаимодействие с каждым из веществ:
4) водой и оксидом кальция
14-18. Оксид серы (VI) взаимодействует с каждым из двух веществ
3) оксидом кальция и гидроксидом натрия
14-19. Оксид серы(IV) взаимодействует с каждым из веществ
2) Ва(ОН)2 и СаО
14-20. Сместить равновесие 2SO2 + O2 ⇄ 2SO3 + Q в сторону исходных веществ можно при
4) повышении температуры и разбавлении исходной смеси аргоном
14-21. Диоксид серы получают при взаимодействии
1) сульфита калия и серной кислоты (конц.)
14-22. Диоксид серы в промышленности можно получить
А) обжигом сульфидных руд на воздухе
Г) сжиганием серы на воздухе
Д) сжиганием Н2S при недостатке О2
1)А, Б, Г 2)А, В, Г 3)Б, В, Д 4) Б, Г, Д
14-23. Для поглощения сернистого газа (оксида серы(IV)) можно использовать сосуд, заполненный раствором
2) гидроксида лития
14-24. Верны ли следующие суждения об оксиде серы(VI)?
А. При растворении этого оксида в воде образуется кислота.
Б. Этот оксид реагирует как с гидроксидом натрия, так и оксидом бария.
3) верны оба суждения
14-25. Оксид серы(IV) не реагирует с
3) оксидом углерода(IV)
4) соляной кислотой
Основные свойства оксида серы 4, с какими веществами взаимодействует
Оксид серы (IV) или диоксид — что это за вещество
Оксид серы (IV) является кислотным оксидом, бесцветным газообразным веществом, обладающим резким запахом (как у загорающейся спички) и хорошо растворимым в воде.
Источник: wikipedia.org Источник: wikipedia.org
Химическая формула диоксида серы:
Основные физические и химические свойства, с какими веществами взаимодействует
Физические характеристики оксида серы (IV):
Оксид серы (IV) относится к кислотным оксидам. Благодаря содержанию в веществе серы в степени окисления + 4 S O 2 способен играть роль и окислителя, и восстановителя в химических реакциях.
Являясь кислотным оксидом, сернистый газ вступает в химические реакции со щелочами и оксидами щелочных и щелочноземельных металлов.
Взаимодействие оксида серы (IV) с гидроксидом натрия сопровождается образованием либо кислой соли (при условии избытка сернистого газа), либо средней соли (если щелочь в избытке):
S O 2 + 2 N a O H ( и з б ) → N a 2 S O 3 + H 2 O
S O 2 ( и з б ) + N a O H → N a H S O 3
Уравнение реакции оксида серы (IV) с основным оксидом натрия:
S O 2 + N a 2 O → N a 2 S O 3
В процессе реакции оксида серы (IV) с водой образуется сернистая кислота. Данный процесс является обратимым. Это связано со способностью сернистой кислоты распадаться в значительной степени в водном растворе, что приводит к образованию оксида и воды.
S O 2 + H 2 O ↔ H 2 S O 3
У S O 2 наиболее ярко выражены восстановительные свойства. В процессе взаимодействия вещества с окислителями повышается степень окисления серы.
Окисление оксида серы кислородом на катализаторе в жестких условиях (процесс является обратимым):
2 S O 2 + O 2 ↔ 2 S O 3
Обесцвечивание бромной воды сернистым ангидридом:
S O 2 + B r 2 + 2 H 2 O → H 2 S O 4 + 2 H B r
Процесс окисления сернистого газа с помощью азотной кислоты протекает легко:
S O 2 + 2 H N O 3 → H 2 S O 4 + 2 N O 2
Процесс окисления оксида серы (IV) с помощью озона:
S O 2 + O 3 → S O 3 + O 2
Окисление сернистого газа оксидом свинца (IV):
S O 2 + P b O 2 → P b S O 4
При контакте с сильными восстановителями S O 2 может проявлять окислительные свойства.
Взаимодействие с сероводородом приводит к восстановлению сернистого газа до молекулярной серы:
S O 2 + 2 Н 2 S → 3 S + 2 H 2 O
Окисление оксидом серы (IV) угарного газа и углерода:
S O 2 + 2 C O → 2 С О 2 + S
S O 2 + С → S + С O 2
Качественные реакции, как проходит горение
Качественная реакция на сернистый газ и на сульфит-ион представляет собой процесс обесцвечивания раствора перманганата калия:
5 S O 2 + 2 H 2 O + 2 K M n O 4 → 2 H 2 S O 4 + 2 M n S O 4 + K 2 S O 4
Двуокись серы является продуктом горения серы или горящих материалов, в состав которых входит сера:
Δ H = − 297 к Д ж / м о л ь
С целью повышения интенсивности горения сжиженную серу (140-150°C, 284–302°F) распыляют с помощью специальной насадки, что приводит к образованию мелких капель серы, обладающих большой площадью поверхности. Реакция является экзотермической. В процессе температура повышается до 1000-1600°C. Произведенное тепло по большей части утилизируют с помощью производства пара, который в дальнейшем может быть преобразован в электрическую энергию. Сходным образом происходит горение сероводорода и сероорганических соединений. К примеру:
2 Н 2 S + 3 О 2 → 2 Н 2 О + 2 S O 2
В процессе обжига сульфидных руд, например, пирита, сфалерита и сульфида ртути, аналогично происходит выделение :
4 F e S 2 + 11 O 2 → 2 F e 2 O 3 + 8 S O 2
2 Z n S + 3 O 2 → 2 Z n O + 2 S O 2
H g S + O 2 → H g + S O 2
4 F e S + 7 O 2 → 2 F e 2 O 3 + 4 S O 2
Как получить, особенности применения
Существуют разные способы получения оксида серы (IV).
Сжигание серы на воздухе:
Горение сульфидов и сероводорода:
2 H 2 S + 3 O 2 → 2 S O 2 + 2 H 2 O
2 C u S + 3 O 2 → 2 S O 2 + 2 C u O
Оксид серы (IV) получают в результате реакции взаимодействия сульфитов с более сильными кислотами. В качестве примера можно привести реакцию сульфита натрия с серной кислотой:
N a 2 S O 3 + H 2 S O 4 → N a 2 S O 4 + S O 2 + H 2 O
C u + 2 H 2 S O 4 → C u S O 4 + S O 2 + 2 H 2 O
Сферы применения оксида серы (IV):
Оксид серы (IV)
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
4. Обработка концентрированной серной кислотой неактивных металлов.
Химические свойства оксида серы (IV)
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S