в каком виде встречаются неметаллы в природе приведите примеры химия 9 класс
Неметаллы. Физические и химические свойства
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
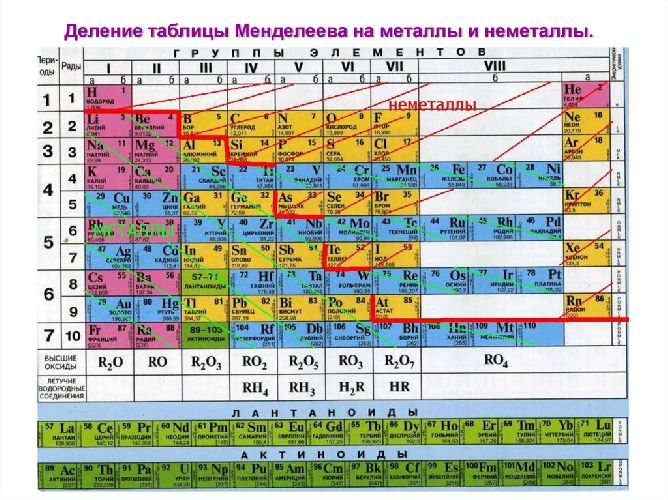
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
В настоящее время открыто 22 неметаллических элемента.
Неметаллы
Общая характеристика неметаллов
Неметаллы в периодической системе расположены справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII, VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат, а также благородные газы: гелий, неон, криптон, ксенон, радон.
Среди неметаллов два элемента – водород и гелий – относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s 1 ), у атомов гелия – два электрона (1s 2 ), у атома бора – три электрона (2s 2 2p 1 ). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns 2 np 2 у атомов элементов главной подгруппы IV группы до ns 2 np 6 у атомов инертных газов.
Физические свойства
Элементы – неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
Газы: гелий, неон, криптон, ксенон, радон, водород, кислород, азот, фтор, хлор.
Жидкость: бром
Твердые вещества: йод, углерод, кремний, фосфор, и др.
7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2 (H2, O2, N2, F2, Cl2, Br2, I2).

Кристаллические решетки металлов и твердых веществ-неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электрический ток, не обладают пластичностью.
Химические свойства
Неметаллы как окислители
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель, вытесняет йод в свободном виде из раствора йодида калия:
Неметаллы как восстановители
Стоит отметить, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смещаются к атомам элементов- окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы.
— взаимодействие с кислотами-окислителями:
— взаимодействие с солями-окислителями:
Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород:
Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и в роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.
Реакции самоокисления – самовосстановления
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления – самовосстановления (диспропорционирования). Например:
Скачать:
Скачать бесплатно реферат на тему: «Неметаллы» Неметаллы.docx (378 Загрузок)
Скачать рефераты по другим темам можно здесь
Неметаллы и их значение в жизни человека: описание, примеры
Содержание:
В периодической системе 22 элемента являются неметаллами. Самыми распространенными макроэлементами являются:
Кислород. В организме человека кислород можно обнаружить в составе белков, жиров, углеводов, гормонов, ферментов и других биологических веществ. Он принимает участие в реакциях обмена веществ в организме, в процессах разложения погибших животных и отмерших растений. Кислород широко используется в медицине: применяется при лечении сердечно-сосудистых, инфекционных заболеваний, а также злокачественных опухолей. Он может оказывать снотворное действие и возбуждать центральную нервную систему. Озон обеззараживает воду и воздух, вызывает гибель бактерий, грибов, вирусов. Образует озоновый слой Земли, который задерживает вредное для всего живого ультрафиолетовое излучение солнца.
Углерод. Составляет основу жизни на Земле. Обеспечивает построение всех живых организмов и их жизнедеятельность. В биологических молекулах углерод образует цепи полимеров и прочно соединяется со всеми макроэлементами. Участвует практически во всех биохимических процессах. Окисляется под действием кислорода до воды и углекислого газа, во время этого процесса выделяется энергия. В организм человека попадает с пищей, а выводится с выдыхаемым воздухом (в виде углекислого газа) и мочой (в виде мочевины).
Из углерода образованы основные виды топлива на Земле – природный газ, нефть, каменный уголь.
В самородном виде в природе существуют две аллотропные модификации углерода: графит и алмаз. Они различаются строением кристаллических решеток и, следовательно, свойствами. Алмаз используется для обработки твердых металлов, для шлифования, резки и гравировки стекла, а также в качестве ювелирных украшений. Графит используют в карандашной промышленности, при изготовлении электродов, некоторых красок, в ядерных реакторах для замедления нейтронов.
Азот. В природе встречается в виде двухатомного газа. Инертен. Активны его соединения. Входит в состав:
Нехватка азота возникает при несбалансированном питании (дефицит белков и витаминов). Это ведет к нарушению обмена веществ, мышечной дистрофии, иммунодефициту, депрессии, гиподинамии.
При избытке белка нарушается работа почек и печени.
Сера. Участвует в пространственной организации молекул белка. Защищает организм от токсического воздействия. Входит в состав ферментов и гормонов. Больше всего её содержится в нервной и соединительной тканях. Недостаток серы в организме проявляется в виде симптомов заболеваний печени, суставов, кожи. Переизбыток ведет к стойким головным болям, параличам, расстройству желудочно-кишечного тракта и дыхательной системы.
В природе сера встречается в самородном виде.
Фосфор. Входит в состав костной ткани, клеточных мембран, нуклеиновых кислот. Участвует в обмене веществ, в выделении глюкозы и в работе нервной системы. При недостатке фосфора в первую очередь разрушаются кости и зубы. Снижается работоспособность и умственная деятельность. Начинают болеть суставы и мышцы. Аппетит снижается, появляется раздражительность. При избытке фосфора страдают почки, нервная система, может возникнуть остеопороз.
Водород. Входит в состав молекул воды и органических соединений: белков, липидов, углеводов, нуклеиновых кислот. Образует водородные связи и этим поддерживает четвертичную структуру белка, а также осуществляет принцип комплементарности при построении нуклеиновых кислот. Ионы водорода участвуют в энергетическом обмене, фотосинтезе, биосинтезе, азотфиксации, в процессах мембранного транспорта и поддержании гомеостаза.
Неметаллы

Всего получено оценок: 1535.
Всего получено оценок: 1535.
Неметаллы – элементы, которые обладают неметаллическими свойствами и занимают положение в правом верхнем углу в таблице Менделеева. Каков же характер неметаллов, а также чем они отличаются от других соединений узнаем в этой статье.
Общая характеристика
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Физические свойства

Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера.
Химические свойства и соединения
Водородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
В результате получается натриевая соль соляной кислоты

соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы находят применение в разных отраслях промышленности. Вот список отраслей, где их использование является наиболее востребованным.
| Область применения | Примеры, перечень неметаллов, применяемых в той или иной промышленности |
| промышленность | Сера, азот и фосфор часто используют для получения кислот. Серу также используют на производстве резины. |
| транспорт | важным неметаллом в транспортной промышленности является водород. Его используют в качестве топлива. При сгорании такой вид топлива не загрязняет окружающую среду. |
| аграрная отрасль | сера используется для борьбы с вредными насекомыми и болезнями растений |
| медицина | Кислород используют для восстановления дыхания (кислородные подушки), уголь в форме активированного угля, который способен выводить из организма вредные вещества. |
| пищевая промышленность | азот используют для продления срока годности продуктов |
Что мы узнали?
В этой статье за 9 класс химии кратко излагается основная информация о неметаллах, их строении, и о том, с чем реагируют неметаллы. Неметаллами могут быть газы, жидкости и твердые вещества с кристаллической решеткой. Самым активным неметаллом является фтор, который имеет степень окисления-1.
Урок химии по теме «Неметаллы. Общая характеристика неметаллов». 9-й класс
Разделы: Химия
Класс: 9
Тема: Неметаллы. Общая характеристика неметаллов.
Цели:
Тип урока: урок усвоения новых знаний.
Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные (схемы); наглядные (мультимедийное наглядное пособие); проблемно-поисковый.
ФОПД: фронтальная, индивидуально-обособленная, групповая (динамические группы).
Технологии: элементы технологии «Сотрудничества», личностно-ориентированного обучения. Информационно-коммуникационные технологии.
Ход работы:
I. Организационный момент.
II. Актуализация знаний.
Ответьте на вопросы:
III. Изучение
1. Положение неметаллов в ПС
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат. Самым активным является фтор.
2. Особенности строения атомов неметаллов.
Во внешнем электронном слое атомов неметаллов находится от трёх до восьми электронов.
Для атомов неметаллов, по сравнению с атомами металлов характерны:
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
3. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
4. Сообщения.
5. Физические свойства неметаллов.
6. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
7. Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.
| -4 | -3 | -2 | -1 |
| RH4 → | RH3 → | H2R → | HR |
Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
2) Соединения, разлагаемые водой:
3) Летучие водородные соединения
По периоду в ПС химических элементов с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
Выводы:
IV. Закрепление изученного. Рефлексия.
1) Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные электроны, являются ____
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Какую высшую степень окисления имеют следующие элементы?
| Азот | +6 |
| Хлор | +5 |
| Сера | +4 |
| Кремний | +7 |
7) Определите, окислителем или восстановителем является сера в следующих реакциях:
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____.
9) Наиболее электроотрицательными являются атомы…..
• серы • фосфора • кремния • хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
Поменяйтесь тестом с соседом и проверьте тест вместе со мной.
V. Читаем по учебнику состав воздуха стр. 74
VI. Решаем упражнения 1–4 стр.75
VII. Оценки и домашнее задание.
Условные обозначения:
ПС – периодическая система
е – электрон
Э.О. – электроотрицательность
А. – аллотропия
Х.р. – химическая реакция






