можно ли вылечить лейкоз у ребенка
Можно ли вылечить лейкоз у ребенка
Онколог: «Детский рак можно полностью излечить»
— «Дети» и «рак» – два этих слова не хочется ставить вместе. Но, к сожалению, в жизни так бывает. Нельзя прятать голову в песок, а надо бороться. Ведь чаще всего этот диагноз – не приговор.
Наш эксперт – заведующая детским онкологическим отделением НМИЦ онкологии им. Н. Н. Петрова, главный внештатный детский специалист-онколог Комитета по здравоохранению Санкт-Петербурга, доктор медицинских наук Светлана Кулева.
– Сколько детей в России заболевают раком?
– Регистрируется около 3,5 тыс. новых случаев в год. За последние 10 лет этот показатель вырос на 70%. Но специалистов это не пугает, ведь рост заболеваемости связан с улучшением диагностики, благодаря которой всё чаще удаётся выявлять ранние формы рака. Гораздо важнее, чтобы не росли, а уменьшались показатели смертности. В последние годы они снижаются, но, к сожалению, около 2% заболевших детей ежегодно погибают (в 2018 г. их было около 100).
– Чем отличается детский рак от взрослого?
– Начать надо с того, что злокачественные опухоли у детей и взрослых различны по морфологическому строению. Отсюда все отличия в лечении и в прогнозе. Если у взрослых главный лечебный метод – операция, то у детей – химио- и лучевая терапия, к которым высоко чувствительны эти опухоли. В некоторых случаях для излечения достаточно только «химии». Если у взрослых цель лечения – ремиссия (длительная, а в идеале пожизненная), то детские опухоли могут быть излечены полностью. Никаких ограничений перенесённая болезнь не накладывает: можно выбирать любую профессию, рожать детей и жить до глубокой старости.
– Какими видами онкологии дети болеют чаще?
– Первое место занимают гемобластозы (лейкозы и лимфомы) – на их долю приходится от 44 до 49%. На втором месте (15–19%) – опухоли центральной нервной системы, на третьем (6–8%) – нефробластомы. Далее идут опухоли симпатической нервной системы (6–7%), костей (5–6%) и мягких тканей (4%).
– Какой возраст наиболее уязвимый?
– Самая высокая заболеваемость у детей до года (224 случая на 1 млн детей). В основном это эмбриональные опухоли (нейро-, нефро-, ретинобластомы и др.). С возрастом риск несколько уменьшается, достигая минимальных значений к 7–10-летнему возрасту, а в подростковом периоде мы опять видим увеличение до 200 на 1 млн, но уже за счёт саркомы костей, репродуктивной системы и др.
– Агрессивнее всего рак протекает у младенцев?
– Нет. При эмбриональных опухолях выживаемость доходит до 80% (а при некоторых локализациях и до 100%). Самая уязвимая группа – это подростки. К сожалению, за последние 30 лет не было достигнуто существенного прогресса в лечении пациентов старше 15 лет. И хотя общая выживаемость онкологических больных резко возросла в последние годы, результаты у подростков оказались наименее впечатляющими. Причины этого кроются в особенностях биологии опухолей у молодых пациентов и отсутствии чёткого понимания у врачей о выборе необходимой стратегии лечения («детской» или «взрослой»). Также негативно влияет недостаток внимания к психологическим особенностям переходного возраста, зачастую снижающим приверженность лечению у подростков.
– Как не пропустить болезнь?
– Чаще всего течение рака бессимптомное или имеет стёртую картину, такие опухоли обнаруживаются случайно: при обследовании по поводу другой патологии или при профилактическом осмотре. Иногда рак может симулировать ОРЗ (бронхит, пневмонию) или острую хирургическую патологию (аппендицит, инвагинацию). Отсутствие онкологической насторожённости у родителей и педиатров нередко приводит к тяжёлым, а порой и необратимым последствиям, связанным с запущенностью злокачественного процесса. Тревожных звоночков много. Все они требуют обязательной срочной консультации у педиатра и невролога.
– Какие новые возможности появились сегодня в лечении рака у детей?
– Сегодня акцент делается на инновационной терапии. К традиционным методам добавляются таргетные и иммунные препараты, с которыми мы, онкологи, связываем большие надежды. Так, 20 лет назад среди детей с нейробластомой (одной из самых частых и агрессивных детских опухолей) выживали не более 20%. Благодаря иммунотерапии этот показатель можно увеличить до 75%, при этом речь идёт не о ремиссии, а о полном излечении. В нашем центре курс иммунотерапии прошли 10 детей с нейробластомой последней, IV стадии. С момента завершения лечения первого ребёнка прошло более 3,5 года, и большинство пролеченных детей живы.
– Какие проблемы в детской онкологии самые насущные?
– Наиболее остро стоит вопрос с лекарственным обеспечением. Вся медицинская помощь детям, больным раком, оказывается бесплатно. Исключения составляют лишь незарегистрированные на территории Российской Федерации лекарственные препараты, оплачивать которые приходится самим родителям пациентов (часто при помощи благотворительных фондов). Необходимо как можно быстрее рассмотреть вопрос об ускоренной регистрации жизненно необходимых препаратов с доказанной эффективностью. Также следует отменить протекционистское правило «третий лишний» и начать закупать более проверенные и менее токсичные препараты для лечения детей с онкогематологическими заболеваниями.
– Лечение рака долгое и тяжёлое. И ещё неизвестно, кому хуже: ребёнку или его родителям. Как тем и другим выстоять и не сломаться?
– Психологические факторы крайне важны для онкологического больного, ведь ему нужно адаптироваться сначала к факту заболевания, а затем к медицинским и социальным последствиям. Все этапы болезни (от страха и растерянности до адекватной оценки) проходят и родители, и им тоже необходима психологическая поддержка. Нередко их первые реакции непредсказуемы (от истерики и депрессии до полного отрицания болезни). У большинства из них стресс усугубляется выраженной астенией (общей слабостью, быстрой утомляемостью, физическим и умственным напряжением, нарушением сна). Ещё страшнее становится родителям после выписки из стационара, когда они лишаются каждодневного врачебного контроля. В этом случае страх перед рецидивом вырастает в разы. Поэтому на всех этапах диагностики, лечения и реабилитации родителям и детям необходима и информационная, и психологическая поддержка. Во многих центрах, например в нашем, работают школы пациентов, которые такую поддержку оказывают.
На что обратить внимание
Опасные симптомы у детей:
Лейкозы у детей: симптомы, диагностика, лечение
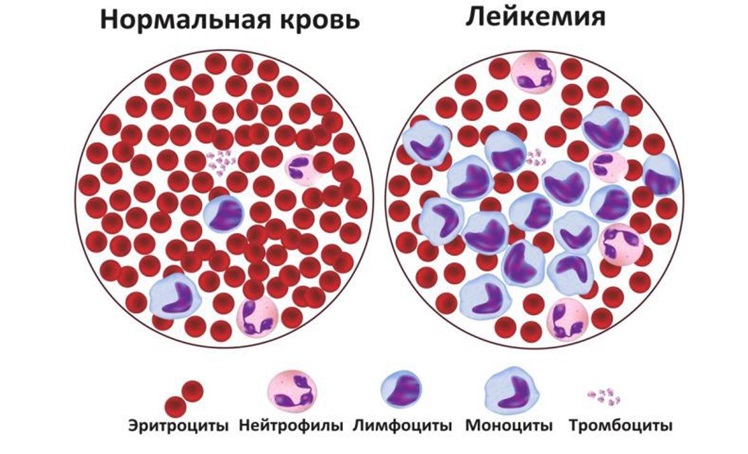
Лейкозы относятся к большой группе злокачественных новообразований системы крови под названием «гемобластозы». Лейкоз (от греческого слова «leukos» — белый) — злокачественная опухоль, возникающая из ранних незрелых кроветворных клеток костного мозга и метастазирующая из костного мозга в кровь, лимфатические узлы, печень, селезенку, головной мозг, спинной мозг и другие органы и ткани.
Все лейкозы можно разделить на острые лимфобластые, острые миелоидные лейкозы (ОМЛ) и хронический миелолейкоз.
Острый лимфобластный лейкоз
Более 80% всех лейкозов у детей составляет острый лимфобластный лейкоз (ОЛЛ). Причиной его развития является химерный ген TEL/AML, формирование которого происходит внутриутробно, возможно, в результате спонтанных ошибок в процессе репликации и репарации ДНК. Накопление генетических аномалий в опухолевом клоне ведет к блоку нормальной клеточной дифференцировки и нарушениям в процессе пролиферации и апоптоза.
В соответствии с франко-американо-британской (FAB) классификацией выделяют три морфологических варианта: L1, L2, L3.
Клинические симптомы ОЛЛ обусловлены степенью инфильтрации костного мозга лимфобластами, а также наличием экстрамедуллярного распространения процесса. Нередко отмечаются общие симптомы опухолевой интоксикации, а именно, повышение температуры тела, снижение аппетита, слабость, вялость. В течение процесса выделяют несколько периодов: начальный, развернутый, период ремиссии.
Развернутый период характеризуется бурным началом, многообразием клинических симптомов. К симптомам общей интоксикации присоединяются костные боли вследствие лейкозной инфильтрацией костной ткани (чаще поражаются диафизы длинных трубчатых костей), артралгии, вызванные лейкемической инфильтрацией суставов. Кожные покровы и слизистые становятся бледными. К сожалению, нередко на них появляются кровоизлияния, обусловленные геморрагическим синдромом, а также кровотечения (носовые, желудочно-кишечные, почечные). Увеличение периферических лимфатических узлов (шейно-надключичных, подмышечных, паховых) является одним из основных симптомов заболевания. Практически у всех пациентов отмечается обусловленное пролиферацией лейкозных клеток увеличение печени и селезенки. В некоторых случаях у пациентов поражение кожи и слизистых оболочек проявляется в виде лейкемидов, некроза, гингивита и стоматита.
Таким образом, можно выделить несколько симптомокомплексов, характерных для ОЛЛ:
При диагностике оцениваются морфологические особенности бластов костного мозга и периферической крови. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения при окраске по Романовскому – Гимзе, проводятся следующие методы исследования:
Для подтверждения диагноза ОЛЛ необходимо комплексное обследование, в котором ведущая роль отводится морфологическому методу.
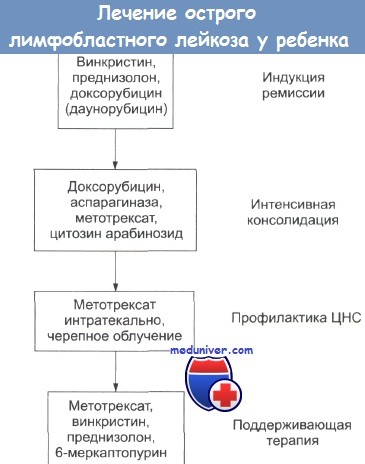
В настоящее время используются программы лечения BFM (БФМ: Берлин-Франкфурт-Мюнстер) и МВ (МБ: Москва-Берлин).
Все лечение можно разделить на базисное и сопроводительное. Базисная терапия представляет собой системную и локальную химиотерапию и, при необходимости, лучевую терапию. Сопроводительное лечение обязательно назначается для профилактики инфекционных осложнений и коррекции постцитостатических реакций. Выделяют следующие этапы в лечении злокачественных процессов: индукция ремиссии, консолидация ремиссии (как правило, несколько фаз), поддерживающее лечение.
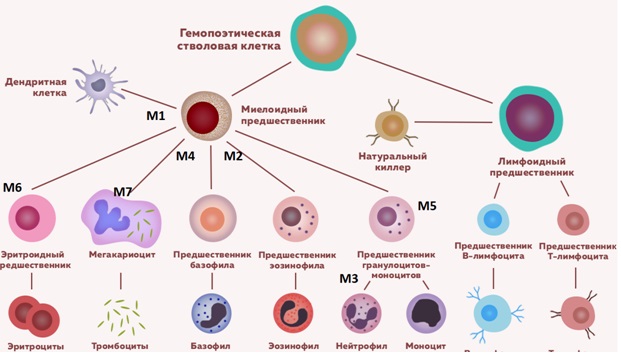
Острый миелоидный лейкоз
Острый миелоидный лейкоз составляет 15% всех острых лейкозов у детей. Существующая FAB-классификация (Франко-Американо-Британская) позволяет разделить ОМЛ на следующие варианты:
Схема гемопоэза с клетками предшественниками острого миелоидного лейкоза
Клиническая картина ОМЛ также складывается из анемического, геморрагического и токсического синдромов, которые являются следствием снижения продукции эритроцитов, тромбоцитов и гранулоцитов.
У 50% пациентов отмечается увеличение размеров печени (гепатомегалия) и селезенки (спленомегалия) вследствие инфильтрации органов опухолевыми клетками.
Внекостномозговые проявления заболевания связаны с лейкозной инфильтрацией центральной нервной системы и метастатическим поражением оболочек и вещества головного и спинного мозга (нейролейкемия). В этих ситуациях отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига.
Решающую роль в диагностике также имеет цитохимическое, иммунофенотипическое и морфологическое исследование бластов в костном мозге и периферической крови.
Ремиссию заболевания можно достичь посредством проведения высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Благодаря адаптивным протоколам удается достичь ремиссии у 90% детей.
Хронические миелолейкоз
Хронический лейкоз – это вариант гемобластоза, субстратом которого являются созревающие клетки. У детей встречается только хронический миелолейкоз, который характеризуется пролиферацией гранулоцитарного ростка, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированной с хромосомной транслокацией t(9;22)(q34;q11), в результате которой образуется химерный онкоген BCR-ABL.
В течение хронического миелолейкоза выделяют три фазы:
В дебюте заболевание трудно диагностировать, поскольку основные симптомы обусловлены общим опухолевым симптомокомплексом и носят преходящий характер. Наиболее частые симптомы, присоединяющиеся позднее – гепатомегалия и спленомегалия. Нарастающая интоксикация приводит к появлению слабости, утомляемости, повышению температуры тела, болям в костях.
В периферической крови отмечается гиперлейкоцитоз (до 200 – 300 х 10 9 /л и более) с увеличением содержания гранулоцитов до 95% и преобладанием незрелых клеток гранулоцитарного ряда: промиелоцитов, миелоцитов, метамиелоцитов, миелобластов, базофилов (до 10%) и эозинофилов (до 5%). Характерна анемия и повышение СОЭ. Уровень тромбоцитов преимущественно в норме, однако может отмечаться гипертромбоцитоз (до 600 х 10 9 /л и более).
В пунктате костного мозга отмечается увеличение числа миелокариоцитов за счет пролиферирующего пула клеток гранулоцитарного ряда с увеличением базофилов и эозинофилов. Позднее отмечается угнетение эритронормобластического и мегакариоцитарного ростков кроветворения.
Основным средством терапии и стандартом лечения хронического миелолейкоза в настоящее время является применение ингибиторов тирозинкиназы (ИТК). Данные препараты имеют механизм таргетного (целенаправленного) воздействия на BCR-ABL-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза. Для оценки эффективности и переносимости терапии ИТК рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента.
Список литературы
Авторская публикация:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова
Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук НМИЦ онкологии им Н.Н. Петрова
Можно ли вылечить лейкоз у ребенка
Индукция и консолидация ремиссии при острой лейкемии. Существует риск смертельного исхода в первые несколько недель индукционной терапии. Этот риск можно свести к минимуму поддерживающими мероприятиями в процессе проведения химиотерапии или перед ее началом. Необходимо корректировать анемию.
Если почки увеличены или повышается уровень креатинина, то сильно возрастает риск возникновения синдрома лизиса опухоли. Необходимо принять меры для предотвращения и лечения этих осложнений. В более тяжелых случаях, таких как В-клеточная ОЛЛ и ОМЛ, может оказаться необходимой терапия, направленная на поддержание уровня тромбоцитов.
Инфекции необходимо выявлять на ранних стадиях и принимать решительные меры (см. также острая лейкемия у взрослых, поддерживающая терапия). Обычно гематологическая и клиническая ремиссия при ОЛЛ достигается использованием винкристина, преднизолона и L-аспарагиназы. В период индукции необходимы усиленная гидратация, аллопуринол и лекарства, понижающие кислотность мочи.
При таких мероприятиях обычно до 95% пациентов достигает состояния ремиссии в течение трех недель. У детей с В-клеточной ОЛЛ и в случае других плохих прогнозов эти стандартные приемы терапии не дают эффекта. Необходимы более интенсивные процедуры с использованием циклофосфамида, цитозинарабинозида, антрациклинов и метотрексата.
При ОМЛ ремиссия индуцируется цитозином и даунорбуцином. Новейшими исследованиями была дана оценка использованию дополнительных препаратов, таких как тиогуанин и этопозид. Миелосупрессия намного более выражена при использовании этих препаратов и необходима привычная поддерживающая терапия.
Полной или частичной ремиссии при ОЛЛ достигают интенсификацией лечения с использованием аспарагиназы, антрациклина (даунорбуцина, доксорбуцина), цитозинарабинозида и циклофосфамида. Метотрексат в высоких дозах увеличивает продолжительность ремиссии. Эти лекарства являются миелосупрессорами, но на данной стадии костный мозг восстанавливается вслед за гибелью большинства популяций лейкемических клеток.
Интенсификация при ОМЛ ставит большую проблему в лечении. Результат стандартной интенсивной химиотерапии улучшается в тех случаях, когда удачно проведена аллогенная трансплантация. Для многих детей трудно подобрать доноров, остается единственная возможность использовать подходящего неродственного донора для пациентов с высоким риском рецидива после достигнутой ремиссии, в таких случаях как моносомия 7 или аутологичная ТКМ (обычно назначаемая после нескольких циклов интенсивной стандартной терапии). В настоящее время эти различные подходы изучаются.
Поддерживающая терапия при детской лимфобластиой лейкемии
Продолжительность «поддерживающей» химиотерапии не может быть установлена. При более интенсивных мероприятиях индукции и консолидации представляется возможным снижение длительности поддерживающей терапии. Широко используют лекарства, такие как 6-меркаптопурин и метотрексат, часто в сочетании с винкристином и преднизолоном. В случаях плохих прогнозов используют более жесткие режимы, например лучевую терапию.
В конце курса лечения берут биопсию яичников (если профилактическое облучение не применяли) для определения латентного заболевания. Рецидивы, в некоторых случаях возникающие через год после лечения, прекращаются. Тиогуанин не используют при поддерживающей терапии, поскольку его длительное применение повышает риск возникновения спленомегалии и портальной гипертензии из-за закупорки протоков печени (без цирроза).
Профилактика заболеваний центральной нервной системы
Важность профилактики нарушений со стороны ЦНС была продемонстрирована в начале 1970-х годов. До этого времени инфильтрация мозговых оболочек лейкемическими клетками являлась причиной возникающих рецидивов в половине всех случаев. Лимфобласты проникают в мозговые оболочки диффузно и распространяются до оболочек спинного мозга и черепно-мозговых нервов.
Профилактика в значительной мере уменьшает частоту рецидивов со стороны нервной системы. В настоящее время обычный режим включает в себя черепное облучение (18 Гр в 8-10 фракциях в течение 2 недель) и интратекальное введение метотрексата (10 мг/см2 4 раза в период облучения). Однако отдаленные последствия облучения ЦНС заставляют искать способы избежать профилактического облучения.
Результаты непросто интерпретировать. Кажется, что для «типичного риска» (WBC ниже 50 х 109/л) интратекальное введение метотрексата является адекватной профилактической мерой, а облучение ЦНС необходимо в случаях повышенного риска. Непонятно, как дополнительные лекарства (такие как цитозинарабинозид) способствуют улучшению состояния.
В случае установленных поражений ЦНС (которые сейчас возникают в 5-10% случаев) применяют интратекальное введение метотрексата дважды в неделю вместе с черепным облучением в более высоких дозах (24 Гр в течение 2-3 недель) и вместе (или с последующим) облучением спинного мозга. В постоянном контроле состояния ЦНС, однако, нет необходимости. Пациентам, которые устойчивы к метотрексату, необходимо интратекальное введение цитозинарабинозида.
Профилактика и лечение тестикулярных нарушений
Рецидив заболеваний яичек происходит часто. Это одна из причин худшего прогноза для мальчиков при ОЛЛ. Частота тестикулярных рецидивов может быть снижена в режимах, использующих высокую дозу метотрексата. Это происходит у 25% мальчиков пубертатного возраста, но менее распространено у более взрослых детей. Рецидив клинически может проявляться не всегда видимой первичной припухлостью, которая позднее иногда затвердевает.
Возникает обычно в обоих яичках, тестикулярная биопсия выявляет претубулярную лейкемическую инфильтрацию. В лечении применяют облучение яичек обычно в дозах порядка 24 Гр в течение 2-3 недель. Необходимость профилактического облучения до сих пор не выяснена.
Лечение рецидивов острой лейкемии у ребенка
Если рецидив у детей возникает при поддерживающей терапии или через год после прекращения лечения, прогноз плохой и необходима ТКМ. Поздние рецидивы купируются с помощью режимов интенсивной терапии и достигаемые ремиссии достаточно устойчивы, хотя и не в каждом случае, однако необходимость ТКМ может рассматриваться и для этой группы больных.
Аллогенная ТКМ применялась в попытках улучшить результаты у детей с плохим прогнозом при ОЛЛ. Эта процедура не имеет достоверно показанного преимущества в выживании в сравнении с химиотерапией рецидива в группе стандартного риска при ОЛЛ.
Следующие клинические ситуации рассматривают как показания к применению аллогенной ТКМ: вторая или третья ремиссия, особенно если рецидив возник во время проведения поддерживающей терапии; случаи плохого прогноза, такие как t(4;11), острая недифференцируемая лейкемия (AUL), t(8;14) В-клеточная ОЛЛ и Ph’-положительная ОЛЛ. Такие дети могут иметь преимущества перед теми, кому ТКМ назначают после первой ремиссии.
Результаты ТКМ при первой ремиссии в группе высокого риска обнадеживают. В 55% случаев отмечают период трех лет жизни без рецидивов. В группе стандартного риска при второй ремиссии — в 65% случаев фиксируют 5-летний период жизни без рецидивов. Результаты в значительной мере зависят от факторов, используемых при отборе пациентов.
Аутологичная ТКМ или трансплантация стволовых клеток имеет, в целом, меньший успех, чем аллогенная, возможно потому, что костный мозг оказывается инфицированным, а также, потому, что некоторые высокодозовые режимы не включают в себя тотальное облучение тела (ТО). Новые лечебные режимы, включающие в себя комбинацию химиотерапии и ТО, могут дать улучшение результатов ТКМ. При аллогенной ТКМ смертность выше, чем при аутологичной, частично потому, что происходит отторжение трансплантата.
Если, несмотря на профилактику, возникают рецидивы со стороны ЦНС, можно вызвать ремиссию интратекальным введением метотрексата или краниоспинальным облучением. Метотрексат можно вводить через резервуар Оммая или Рикхама, который позволяет непосредственно доставлять лекарство в церебрально-вентрикулярную систему. Систематические рецидивы неизбежны, поэтому в дальнейшем обычно требуется систематическая терапия.
Рецидив ОМЛ является серьезным событием. При традиционной реиндукционной химиотерапии только 20% детей остается живыми в течение двух лет, поэтому предприняты попытки интенсификации процедур индукции ремиссии после первого рецидива с использованием аллогенной и аутологичной трансплантации. Представляется возможным, что хотя бы каждый третий ребенок с рецидивом ОМЛ мог быть излечен этим методом.
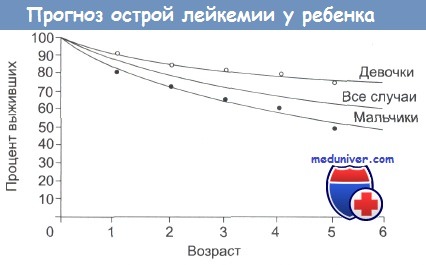
Прогноз острой лейкемии у ребенка
Важные прогностические признаки представлены в таблице ниже. Выживаемость среди девочек выше, чем среди мальчиков. Последствия лечения продолжают рассматриваться. Они включают в себя неврологические осложнения после облучения ЦНС и позвоночника, которые приводят к рассмотрению целесообразности уменьшения дозы облучения и использования в случаях небольшого риска.
Осложнение в виде опухоли мозга, индуцированное облучением ЦНС, наиболее распространено у детей, проявляющих полиморфизм по ферменту, детоксицирующему меркаптопурин (тиопуринметилтрансфераза), что делает их в большей степени подверженными острой токсичности и развитию вторичной ОМЛ. Эти соображения являются основными для введения адаптированных к риску стратегий лечения, которые включают известные прогностические факторы, но превносят быстрый результат и минимальные остаточные проявления болезни. Использование технологии микрозондирования может сделать возможным дальнейшее улучшение в решении задач лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лейкоз у детей и подростков
Что такое лейкоз?
Лейкоз — это рак крови и костного мозга. Он является наиболее распространенным онкологическим заболеванием у детей и подростков. В США ежегодно диагностируется около 3500–4000 случаев лейкоза у детей.
Острый лимфобластный лейкоз (ОЛЛ)
Острый миелоидный лейкоз (ОМЛ)
Хронический миелоидный лейкоз (ХМЛ)
Ювенильный миеломоноцитарный лейкоз (ЮММЛ)
Острый лимфобластный лейкоз (ОЛЛ) у младенцев
Рецидив острого лимфобластного лейкоза (ОЛЛ)
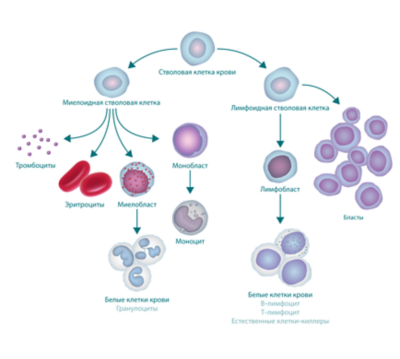
У пациентов с лейкозом не происходит правильного созревания кроветворных клеток. Кровь вырабатывает слишком много незрелых клеток крови или лейкозных клеток.
Когда это происходит, функция крови нарушается. В ней становится недостаточно:
Острые лейкозы чаще всего возникают у детей.
Процесс кроветворения, приводящий к образованию бластов.
Признаки и симптомы лейкоза
К признакам и симптомам относятся:
Диагностика лейкоза
Лечение лейкоза
Другие возможные методы лечения:
Прогноз (исход) при лечении лейкоза
Острые лейкозы
Общая 5-летняя выживаемость при остром лимфобластном лейкозе (ОЛЛ) у детей составляет примерно 90%.
Общая 5-летняя выживаемость детей с острым миелоидным лейкозом (ОМЛ) составляет 65–75%. Тем не менее, коэффициенты выживаемости варьируются в зависимости от подвида ОМЛ и других факторов. Например, показатель эффективности лечения для острого промиелоцитарного лейкоза (ОПМЛ), одного из подвидов ОМЛ, в настоящее время выше 90%, но показатели для некоторых других подвидов ОМЛ ниже.
Хронические лейкозы
Для хронических лейкозов показатель 5-летней выживаемости менее полезен, поскольку дети могут долгое время жить с лейкозом без фактического излечения. В прошлом показатели 5-летней выживаемости при хроническом миелоидном лейкозе (ХМЛ) составляли 60–80%, но в настоящее время они намного выше.
—
Дата изменения: июнь 2018 г.
Химиотерапия
Химиотерапия — это лечение рака с помощью мощных лекарственных препаратов. Они уничтожают злокачественные клетки или останавливают их рост.
Подробнее о химиотерапии
Острый лимфобластный лейкоз (ОЛЛ)
Острый лимфобластный лейкоз (ОЛЛ) является наиболее распространенным онкологическим заболеванием у детей, злокачественным заболеванием крови и костного мозга.