Что такое уровень сероконверсии
Авидность антител в диагностике инфекционных заболеваний
Расширение возможностей в лечении и профилактике инфекционных заболеваний нуждается в быстрой и точной диагностике. Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические (профилактические) мероприятия. Установление первичного инфицирования возбудителями внутриутробных инфекций играет существенную роль в предотвращении врожденных патологий.
Традиционные иммунодиагностические методы, используемые для серологической диагностики острой фазы вирусных, бактериальных и паразитарных инфекций, имеют ряд ограничений. Часто невозможно провести четкую дифференциацию между первичной инфекцией, реинфекцией или обострением инфекционного процесса, особенно при серодиагностике инфекций с нетипичной динамикой антителообразования, когда наличие иммуноглобулинов класса М (IgM) не является достоверным и достаточным признаком для дифференциации стадий заболевания.
Определение IgM, как показателя первичной инфекции, в ряде случаев утратило свое значение, так как было доказано, что их можно выявить в сыворотке периферической крови спустя месяцы или даже годы после наступления сероконверсии (так называемые хронические IgM). Кроме того, выявление IgM может дать ложнопозитивные результаты. Например, вследствие вторичной инфекции (экзогенная реинфекция или эндогенная реактивация инфекции). Было показано, что специфические IgA также могут присутствовать в сыворотке периферической крови через 2-3,5 года с момента зарегистрированной сероконверсии.
Серологическая диагностика, основанная на определении титра специфических иммуноглобулинов класса G (IgG) может быть полезной при дифференциации активного периода болезни от перенесенной в прошлом и уже неактивной инфекции. Однако этот метод имеет ряд ограничений: не позволяет дифференцировать первичную и реинфекцию; у пациентов с реактивацией хронического процесса не всегда наблюдается достоверный рост уровня IgG; метод экономически невыгоден.
Для того, чтобы установить точный момент инфицирования и разграничивать первичную, реинфекцию или реактивацию инфекционного процесса, был предложен тест на определение авидности IgG антител.
Различают два понятия: аффинность антител (или аффинитет) и авидность (или авидитет).
Аффинность — это степень специфического сродства активного центра к антигенной детерминанте. Авидностью антител или функциональной аффиностью называется прочность связи между антителом и антигеном. Величина авидности зависит от аффиности специфических антител (выше аффиность — выше авидность) и количества связывающих центров. Первичный иммунный ответ на ранее не встречаемые организмом антигены начинается с продукции иммуноглобулинов класса М. Специфические IgG появляются позже. При первичном иммунном ответе они сменяют ранние антитела IgM и накапливаются в организме в больших количествах.
Под воздействием антигена происходит процесс отбора и стимуляции В-клеток, что приводит к увеличению аффинности IgG антител, низкой после первого контакта с антигеном и возрастающей в течение последующих недель или месяцев (от 1 до 7).
Соматические мутации в генах, кодирующих вариабельные участки IgG, приводят к возрастанию прочности связывания в комплементарных участках антигенов и антител. В конце первого месяца после инфицирования вариабельные участки антител становятся более специфичными по отношению к антигену, и аффинность IgG антител возрастает. Этот процесс называют «созреванием» (от maturation — созревание) антител. Высокоаффинные антитела остаются в организме длительное время. За счет этих антител развивается быстрый вторичный иммунный ответ в случае повторного попадания возбудителя в организм.
Под воздействием антигена происходит процесс отбора и стимуляции В-клеток, что приводит к увеличению аффинности IgG антител, низкой после первого контакта с антигеном и возрастающей в течение последующих недель или месяцев (от 1 до 7). Соматические мутации в генах, кодирующих вариабельные участки IgG, приводят к возрастанию прочности связывания в комплементарных участках антигенов и антител. В конце первого месяца после инфицирования вариабельные участки антител становятся более специфичными по отношению к антигену, и аффинность IgG антител возрастает. Этот процесс называют «созреванием» (от maturation — созревание) антител. Высокоаффинные антитела остаются в организме длительное время. За счет этих антител развивается быстрый вторичный иммунный ответ в случае повторного попадания возбудителя в организм.
Уровень авидности пропорционален дозе и природе антигена, а также индивидуальному уровню соматических мутаций. Низкие дозы антигена приводят к более быстрому возрастанию авидности, а высокие дозы — к более медленному. Таким образом, низкоавидные антитела продуцируются в течение первой стадии инфекции, когда содержание антигенов обычно высокое.
С возрастом эффективность селекции специфических антител падает, а следовательно процесс созревания антител замедляется, этим объясняется меньшая устойчивость к инфекциям лиц старше 60-65 лет и неэффективность вакцинации в этом возрасте. Выявление в испытуемой сыворотке антител с индексом авидности ниже 15-50% (у разных производителей и разных возбудителей этот показатель разный и указывается в бланке исследования) указывает на свежую первичную инфекцию. Показатель авидности. равный или превышающий 50%, свидетельствует о наличии в сыворотке высокоавидных антител — маркеров перенесенной в прошлом инфекции или персистирующей инфекции. Показатель авидности антител в интервале 31-49% может свидетельствовать о поздней стадии первичной инфекции или недавно перенесенной инфекции только при условии выявления антител в высокой концентрации. Интерпретацию результатов определения индекса авидности необходимо проводить в соответствии с рекомендациями фирмы — производителя, так как величина ИА для одной и той же стадии заболевания может колебаться в широких пределах.
Если в исследуемой сыворотке крови при наличии или отсутствии IgM обнаруживаются IgG с низкой авидностью, то это свидетельствует о первичной (недавней) инфекции. Наличие же высокоавидных антител IgG говорит о вторичном иммунном ответе в случае попадания возбудителя в организм или обострения (реактивации).
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ОПРЕДЕЛЕНИЯ НИЗКОАВИДНЫХ АНТИТЕЛ
Применение метода определения авидности антител представляет интерес при диагностике инфекций.
Краснуха обладает бесспорным тератогенным действием, т.е. приводит к формированию пороков развития эмбриона и плода. У беременных краснуха может протекать тяжело, легко и бессимптомно. Внутриутробное заражение плода возможно при любой форме краснушной инфекции. Распознавание инфекции, особенно в период вспышек, больших затруднений не вызывает.
Однако для точной диагностики необходимо выделение вируса, которое технически не всегда выполнимо. Лабораторная диагностика обычно заключается в определении IgG и IgM антител, в основном у беременных, так как риск рождения неполноценного или мертвого ребенка у инфицированной матери очень высок и обычно рекомендуется прерывание беременности. Однако диагностика, основанная на определении антител, может давать ложноположительные и ложноотрицательные результаты. Так, при повторной инфекции у вакцинированных, которая может произойти в случаях низкого иммунного ответа при вакцинации, или может быть вызвана мутантными штаммами вируса, IgM антитела не образуются, возрастание титров IgG антител также наблюдается не всегда. У новорожденных с первичной инфекцией вследствие внутриутробного инфицирования, IgM антитела могут не синтезироваться в силу ряда причин:
незрелость иммунной системы; блокирование вирусного антигена материнскими антителами; инфицирование на поздних стадиях беременности; иммунная толерантность. Если происходит стимуляция клонов лимфоцитов вируса краснухи, может возникать ложноположительный антительный ответ, особенно для антител класса IgM. Было показано, что IgM антитела могут персистировать в течение года или возникать в случаях реинфекции, особенно у иммунодепрессивных пациентов. Кроме того, могут возникать ложноположительные результаты вследствие наличия ревматоидного фактора или подобных соединений, даже в ловушечном варианте теста. Только определение низкоавидных антител может быть диагностическим маркером первичной инфекции вирусом краснухи, что особенно важно при диагностическом обследовании беременных, когда необходимо дифференцировать первичную инфекцию от вторичной или реактивации инфекции.
Токсоплазмоз. Известно, что проявление клинических симптомов при приобретенном токсоплазмозе имеет низкое диагностическое значение для точного определения длительности инфекционного процесса.
Увеличение лимфоузлов может возникать в разное время с момента первичной инфекции, а нередко может сохраняться длительное время или даже возобновляться в более поздний период болезни, независимо от применения специфического противопаразитарного лечения.
До настоящего времени единственными доступными серологическими тестами для определения острой фазы токсоплазмоза являлись определение IgM антител и определение IgG антител в возрастающих титрах в двух или трех образцах сывороток, что, однако, приводит к задержке постановки диагноза. Кроме того, у пациентов с реактивацией хронического токсоплазмоза значительный рост уровня антител IgG отмечается не всегда, особенно это касается детей и подростков с поражением глаз при врожденном токсоплазмозе.
Интерпретация результатов исследований других иммуноглобулинов также вызывает затруднения. Основной недостаток определения IgM антител — длительная персистенция в крови, в связи с чем возникают трудности в установлении окончания острой фазы заболевания. У 40% пациентов IgM антитела выявляются в течение года с момента заражения при использовании ИФА, у 60% — при использовании высокочувствительного метода иммуноадсорбции. Также как IgM, специфические IgA присутствовали в сыворотке периферической крови через 45 месяцев с момента зарегистрированной сероконверсии, в течение 2-летнего периода серологического наблюдения и через 8 месяцев с момента появления признаков лимфоаденопатии. С другой стороны, у определенных категорий пациентов, например у детей, IgM антитела вообще не образуются.
Определение авидности IgG антител является высокоспецифичным и чувствительным методом диагностики острого первичного токсоплазмоза, что особенно важно при обследовании беременных для устранения потенциального риска появления врожденного токсоплазмоза у детей.
Недавно была разработана методика измерения антигенсвязывающей авидности (функциональной аффинности) IgG антител к Toxoplasma gondii, позволяющая разделить низкоаффинные антитела от высокоаффинных, которые указывают на перенесенную в прошлом инфекцию. С помощью этой методики первичная инфекция может быть идентифицирована с использованием единственной порции сыворотки.
Инфекции, вызываемые вирусом простого герпеса. Частота инфицирования новорожденных у женщин субклинической формой простого герпеса составляет 3-5% при хронической инфекции и доходит до 30-50% при заражении во время беременности (первичная инфекция). Инфекции, вызываемые вирусами простого герпеса, цитомегаловирусом относятся к инфекциям с нетипичной динамикой антителообразования (когда наличие IgM не является достоверным и достаточным признаком для дифференциации стадий заболевания). Определение IgM антител может давать ложноотрицательные результаты, поскольку они могут вообще не образовываться, или присутствовать в количествах, трудных для определения.
Ложноположительные результаты могут возникать по следующим причинам: длительная персистенция IgM антител или их присутствие может быть не связано с инфекцией; IgM антитела могут определяться при реактивации инфекции или при вторичной инфекции, например, вирусом иммунодефицита человека; различные вирусы могут иметь общие эпитопы (например, вирус простого герпеса и вирус варицелла-зостер), что приводит к возникновению перекрестных реакций. Диагностика активной фазы инфекции по 4-кратному возрастанию титра IgG также может вызывать затруднения, поскольку титр IgG антител может увеличиваться достаточно быстро (в течение 1-2 суток) после проявления симптомов заболевания.
Таким образом, определение серологических маркеров этих инфекциях не может служить специфичным тестом для дифференциации между первичной инфекцией и реактивацией. Заражение вирусом простого герпеса (ВПГ) ведет к пожизненной персистенции с возможностью реактивации вируса и перекрестного заражения другим серотипом ВПГ. Преобладание хронических и бессимптомных форм течения болезни, а также возможность атипичных проявлений ставит под сомнение диагностику по внешним признакам. Приблизительно 20% больных ВПГ-2 не имеют симптомов вообще, а 60% лиц имеют признаки, которые невозможно диагностировать и которые не принимаются врачом и самими больными за герпес (нетипичные проявления). Обе эти группы имеют риск заразить своих партнеров. Специфические IgM не могут быть использованы в качестве достоверного маркера для диагностики острой и, особенно, первичной инфекции, так как IgM к ВПГ могут образовываться как при первичном инфицировании, так и при реинфекции и реактивации вируса, но в то же время они способны вырабатываться в достаточном для диагностики количестве только у 30% людей.
Единственным способом, позволяющим сразу и достоверно диагностировать первичную инфекцию, является определение индекса авидности специфических антител.
Цитомегаловирусная инфекция (ЦМВИ) — самая распространенная внутриутробная инфекция и одна из наиболее частых причин невынашивания беременности. Риск внутриутробного инфицирования и характер поражения плода зависят от наличия антител у матери и срока инфицирования плода. При первичном инфицировании серонегативной беременной риск передачи плоду составляет примерно 50%.
Диагностика первичной ЦМВИ обычно основывается на определении сероконверсии, наличия высокого титра специфичных IgM или четырехкратного возрастания титра специфических IgG. В связи с тем, что момент сероконверсии и возрастание титров IgG диагностировать достаточно трудно, IgM антитела являются наиболее часто используемым маркером для диагностики острой инфекции. Однако у некоторых больных IgM антитела сохраняются длительное время, что приводит к гипердиагностике острой инфекции.
Определение авидности антител IgG рассматривается как наиболее важный серологический маркер, поскольку низко- и высокоавидные антитела IgG доминируют соответственно при недавней или длительно текущей инфекции.
Использование теста на авидность IgG при позитивной реакции на IgM антитела помогает подтвердить или исключить наличие первичной ЦМВИ и в ряде случаев помогает избежать необоснованных инвазивных процедур.
Вирусный гепатит С. Лабораторная диагностика гепатита С (ВГС) основана на выявлении специфических маркеров инфицирования (IgM и IgG антитела к ВГС, РНК ВГС). lgM-ответ в острой фазе гепатита С не следует классическому пути антителообразования: IgM анти-HCV могут выявляться одновременно и даже позднее, чем анти-ВГС класса IgG. Поэтому обнаружение IgM анти-ВГС не может быть использовано как маркер острой HCV-инфекции. Вместе с тем, длительность циркуляции антикор-lgM (3-5 месяцев) является фактором, прогнозирующим персистентную инфекцию, а их появление при хроническом гепатите С свидетельствует о реактивации вируса, т.е. об обострении процесса. Единственным достоверным фактором подтверждения первичной инфекции ВГС является сероконверсия.
Индекс авидности IgG при первичной ВГС инфекции имеет низкие значения и возрастает с течением времени, что подтверждает целесообразность использования определения авидности IgG антител для дифференциальной диагностики первичной инфекции от хронической или перенесенного гепатита С.
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.
Варилрикс™, вакцина против ветряной оспы
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Порошок лиофилизированный для инъекций в комплекте с растворителем,
Состав
Одна доза (0.5 мл) содержит
вспомогательные вещества: неомицина сульфат, альбумин человеческий, лактоза, сорбитол, маннитол, аминокислоты для инъекций.
Описание
Фармакотерапевтическая группа
Вакцины против ветряной оспы.
Иммунологические свойства
Варилрикс™ отвечает требованиям Всемирной Организации Здравоохранения для биологических веществ и для вакцин против ветряной оспы.
Определенной степени защиты можно добиться, проведя вакцинацию в течение 72 часов после контакта с больным ветряной оспой. Если после проведения вакцинации у пациента обнаруживаются антитела, это расценивается как признак развивающейся защиты против заболевания.
У детей в возрасте от 11 до 21 месяца уровень сероконверсии после введения первой дозы составляет 89.6%, после введения второй дозы уровень сероконверсии достигает 100%.
У детей в возрасте от 9 месяцев до 12 лет было установлено, что уровень сероконверсии превышал 98 % через 6 недель после вакцинации одной дозой.
У детей, вакцинированных в возрасте 12-15 месяцев, антитела сохраняются не менее 7 лет после вакцинации одной дозой.
У детей в возрасте от 9 месяцев до 6 лет коэффициент сероконверсии достигал 100 % через 6 недель после введения второй дозы. После введения второй дозы отмечалось увеличение титров антител.
У детей в возрасте 13 лет и старше коэффициент сероконверсии достигал 100 % через 6 недель после введения второй дозы. Через год после вакцинации все вакцинированные субъекты оставались серопозитивными.
Большинство привитых лиц, которые впоследствии подверглись воздействию вируса, были либо полностью защищены от ветряной оспы или развивали умеренную форму болезни (незначительное количество везикул, отсутствие лихорадки).
В клинических исследованиях подтвердилась 100% защитная эффективность вакцины против клинических случаев ветряной оспы либо ее развитие в легкой форме.
Пациенты группы высокого риска
У пациентов группы высокого риска развития инфекций уровень сероконверсии составляет ≥ 80 %.
Через 6 недель после первичной вакцинации рекомендуется определить уровень антител против ветряной оспы для выявления необходимости повторной вакцинации.
У пациентов, получающих массивную терапию иммунодепрессантами, после введения вакцины могут развиться реакции, связанные с вакцинацией (преимущественно папуловезикулярные высыпания и повышение температуры тела), в большинстве случаев слабо выраженные.
Показания к применению
Профилактика ветряной оспы у непереболевших ветряной оспой ранее:
— здоровые дети старше 9 месяцев
— здоровые люди, находящиеся в тесном контакте с заболевшими (в течение 72 часов после контакта)
— пациенты группы высокого риска (больные лейкозом, пациенты на иммунодепрессивной и кортикостероидной терапии по поводу злокачественных солидных опухолей, при серьезных хронических заболеваниях, таких как хроническая почечная недостаточность, аутоиммунные заболевания, диффузные болезни соединительной ткани, тяжелое течение бронхиальной астмы, после трансплантации органов). Вакцинация пациентам этой группы рекомендована при полной гематологической ремиссии основного заболевания и соблюдении следующих условий:
— у пациентов с острой фазой лейкоза химиотерапия должна быть отменена на срок равный одной неделе до и одной неделе после вакцинации. Не вакцинируются пациенты в период проведения рентгенотерапии.
— общее количество лимфоцитов должно составлять не менее 1200/мкл при отсутствии других симптомов, указывающих на недостаточность клеточного иммунитета
— при трансплантации органов вакцинация должна проводиться за 6 недель до начала проведения иммунодепрессивной терапии
Способ применения и дозы
Варилрикс™ предназначен для подкожного введения. Детям до 1 года препарат вводят в переднюю наружную область бедра (латеральная часть четырехглавой мышцы). Детям от 1 года и старше вакцину вводят в область дельтовидной мышцы плеча.
В 0.5 мл приготовленного раствора вакцины содержится одна иммунизирующая доза.
Дети в возрасте от 9 месяцев до 12 лет включительно
Рекомендуется вводить 2 дозы вакцины.
Введение второй дозы рекомендуется через 6 недель после первичной вакцинации.
Ни при каких обстоятельствах введение второй дозы не должно быть раньше, чем через 4 недели!
Дети в возрасте от 13 лет и старше
Рекомендуется вводить 2 дозы вакцины.
Введение второй дозы рекомендуется через 6 недель после первичной вакцинации.
Ни при каких обстоятельствах введение второй дозы не должно быть раньше, чем через 4 недели!
Пациентам группы высокого риска независимо от возраста может потребоваться введение дополнительной дозы вакцины. Через 6 недель после повторной вакцинации рекомендуется определить уровень антител против ветряной оспы для выявления случаев необходимости повторной вакцинации.
Правила приготовления раствора вакцины
Вакцину следует растворять путем добавления растворителя во флакон, содержащий лиофилизированый порошок. Смесь необходимо хорошо встряхнуть по полного растворения лиофилизата. Из-за незначительных изменений pH цвет раствора восстановленной вакцины может варьировать от персикового до розового.
Приготовленный раствор вакцины перед введением следует осмотреть на наличие инородных тел. При наличии инородных тел вакцина не подлежит использованию.
После обработки места инъекции спиртом или другим веществом, применяющимся для дезинфекции, следует подождать, пока это вещество испарится, поскольку при контакте с дезинфицирующими средствами может произойти инактивация вируса вакцины.
Содержимое флакона вводится полностью.
После приготовления раствора вакцину рекомендуется ввести сразу, но
восстановленная вакцина может храниться в течение 90 минут при комнатной температуре (25 °C) и до 8 часов в холодильнике (от 2 °C до
Если восстановленная вакцина не была использована в течение установленного времени, остаток неиспользованной вакцины подлежит уничтожению.
Варилрикс™ не следует вводить внутрикожно.
Варилрикс™ ни при каких обстоятельствах нельзя вводить внутривенно.
Побочные действия
Больше чем 7 900 здоровых лиц участвовали в клинических испытаниях вакцины. Профиль безопасность применения вакцины Варилрикс был изучен на 5369 дозах применяемых у детей, подростков и взрослых.
Нежелательные реакции, приведенные ниже, сгруппированы по системам органов и частоте встречаемости: очень часто ≥ 10%, часто ≥ 1% и 0.01% и 39 °C или ректальной температуры
— боли в животе, диарея
Частота побочных эффектов после введения второй дозы была не выше, чем после введения первой. Частота покраснения в месте инъекции у детей до 13 лет оставалась на том же уровне, что и после введения первой дозы.
Так же не было выявлено различий между пациентами, которые до введения вакцины были серопозитивными и серонегативными.
Пациенты группы высокого риска
Данные пост- маркетинговых исследований
— судороги, мозжечковая атаксия**.
** Реакция, описанная после вакцинации, является последствием инфекции ветряной оспы штаммом вируса дикого типа. Увеличения риска возникновения данных реакций после прививки по сравнению с заболеванием ветряной оспы от штамма дикого типа нет (единичные сообщения > 0.001% и
Сероконверсия
Сероконверсия (Seroconversion) – выработка организмом специфических антител или повышение их титров в ответ на присутствие какого-либо антигена, который попадает в организм, как правило, в результате инфекции или вакцинации. Понятие «сероконверсия» часто используется в диагностике как признак инфекции или критерий эффективности вакцинации. В обоих случаях для доказательства наличия сероконверсии требуется исследование парных образцов сыворотки, первый из которых был взят до начала или в самом начале антигенного воздействия (до болезни или вакцинации), а последующие — в период ожидаемого иммунного ответа. Сероконверсия устанавливается путем одновременного титрования парных образцов сыворотки с помощью соответствующих серологических реакций, причем достоверным признается увеличение титра, равное или превышающее два шага разведения. Если при постановке серологической реакции сыворотки разводятся 1:2; 1:4; 1:8, то сероконверсией можно считать четырехкратное и большее увеличение титра антител.
Таким образом, сероконверсия используется для оценки эффективности вакцинации и серологической диагностики заболеваний.
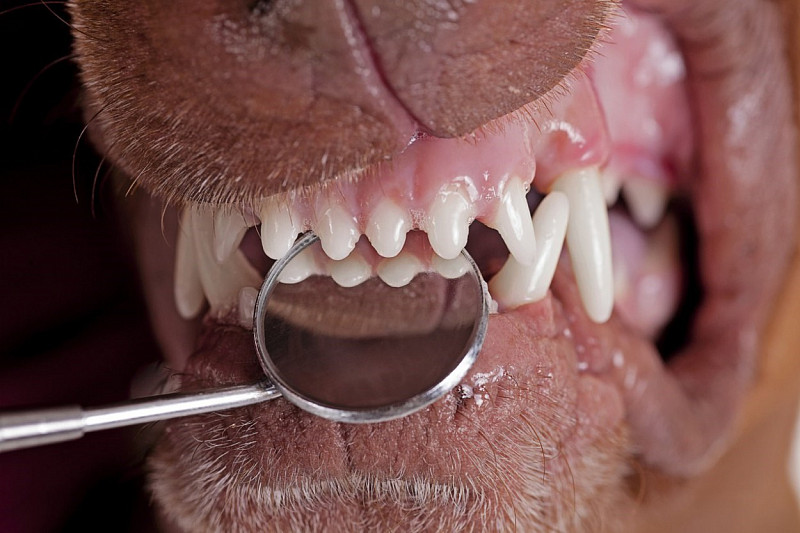
Наиболее распространёнными стоматологическими заболеваниями у собак является пародонтит и гингивит. Реже наблюдаются пародонтозы, периодонтиты и стоматиты.
Пародонтит – это воспалительное заболевание пародонта, сопровождающееся разрушением структур удерживающих зуб с образованием патологических зубодесневых карманов, а затем пародонтальных.
• Microsporum canis (поражает кошек, собак и, в меньшей степени, крупных животных)
• Trichophyton mentagrophytes, T. verrucosum и T. erinacei (поражает ежей)
• M. gypseum.