что такое свойства кислорода
Кислород
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение
Общая характеристика элемента
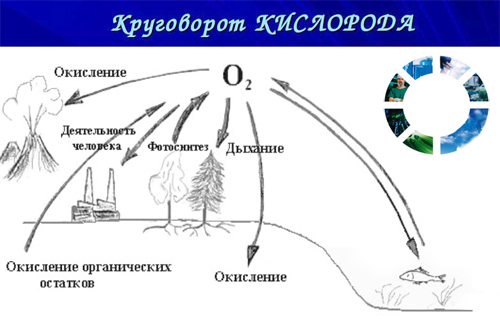
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16 О, 17 О и 18 О (преобладает 16 О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км 3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.
Строение молекулы озона
3О2 = 2О3 – 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2. В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:
2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
3. Разложением пероксида водорода:
2H2O2 = H2O + O2↑ (катализатор MnO2)
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода

Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s 2 2p 4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.

Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.

Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 o C или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H2S + O2 → 2S + 2H2O (недостаток кислорода),
4NH3 + 5O2 → 4NO + 6H2O (в присутствии катализатора Pt ),
Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I — в растворе Kl:
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Кислород (O, Oxygenium)
История кислорода
Открытие кислорода произошло дважды, во второй половине XVIII столетия с разницей в несколько лет. В 1771 году кислород получил швед Карл Шееле, нагревая селитру и серную кислоту. Полученный газ был назван «огненным воздухом». В 1774 английский химик Джозеф Пристли проводил процесс разложения оксида ртути в полностью закрытом сосуде и открыл кислород, но принял его за ингредиент воздуха. Только после того, как Пристли поделился своей находкой с французом Антуаном Лавуазье, стало понятно, что открыт новый элемент (calorizator). Пальма первенства данного открытия принадлежит Пристли потому, что Шееле опубликовал свой научный труд с описанием открытия лишь в 1777 году.
Общая характеристика кислорода
Кислород является элементом XVI группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 8 и атомную массу 15,9994. Принято обозначать кислород символом О (от латинского Oxygenium – порождающий кислоту). В русском языке название кислород стало производным от кислоты, термина, который был введён М.В. Ломоносовым.
Нахождение в природе
Кислород является самым распространённым элементом по нахождению в земной коре и Мировом океане. Соединения кислорода (в основном – силикаты) составляют не менее 47% массы земной коры, кислород вырабатывается в процессе фотосинтеза лесами и всеми зелёными растениями, большая часть приходится на фитопланктон морских и пресных вод. Кислород – обязательная составная часть любых живых клеток, также находится в большинстве веществ органического происхождения.
Физические и химические свойства
Кислород – лёгкий неметалл, состоит в группе халькогенов, имеет высокую химическую активность. Кислород, как простое вещество, представляет собой газ без цвета, запаха и вкуса, имеет жидкое состояние – светло-голубая прозрачная жидкость и твёрдое – светло-синие кристаллы. Состоит из двух атомов кислорода (обозначается формулой О₂).
Полезные свойства кислорода и его влияние на организм
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Биологическая роль кислорода
Кислород – основа основ жизнедеятельности всех живых организмов на Земле, является основным биогенным элементом. Находится в составе молекул всех важнейших веществ, которые отвечают за структуру и функции клеток (липиды, белки, углеводы, нуклеиновые кислоты). Каждый живой организм содержит гораздо больше кислорода, чем какого-либо элемента (до 70%). Для примера, организм взрослого среднестатического человека массой 70 кг содержит 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и человек) благодаря органам дыхания и поступлению воды. Помня о том, что в организме человека самый главный орган дыхания – это кожа, становится понятно, сколько кислорода может получать человек, особенно летом на берегу водоёма. Определить потребность человека в кислороде достаточно сложно, ведь она зависит от многих факторов – возраст, пол, масса и поверхность тела, система питания, внешняя среда и т.д.
Применение кислорода в жизни
Кислород применяется практически повсеместно – от металлургии до производства ракетного топлива и взрывчатых веществ, применяемых для дорожных работах в горах; от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E941, как пропеллент и упаковочный газ.
Кислород. Свойства кислорода.
Кислород – элемент 6 группы периодической таблицы Д.И, Менделеева.
Изотопы кислорода.
Существует 3 устойчивые формы кислорода: 16 О, 17 О и 18 О, среднее содержание которых составляет соответственно 99,759%, 0,037% и 0,204% от общего числа атомов.
Наиболее часто встречающийся 16 О, так как он наиболее легкий (состоит из 8 протонов и 8 электронов), что делает его весьма устойчивым.
Физические свойства кислорода.
Температура плавления, °С
Температура кипения, °С
Ковалентный радиус, Å
Потенциал ионизации, эв
Способы получения кислорода.
Существует 4 способа получения кислорода:
2. Промышленный способ: перегонка воздушной смеси (кислород, как более тяжелый элемент остается в смеси, а азот улетучивается)
3. Лабораторные способы разложения оксидов, пероксидов, солей:
4. Из пероксидов (используют в космосе для регенерации O2 из углекислого газа):
Химические свойства кислорода.
С металлами реагирует уже при комнатной температуре:
С неметаллами (при нагревании):
O2 взаимодействует со сложными соединениями:
Нахождение кислорода в природе.
Кислород образует большое количество минералов: силикаты, кварц, оксиды железа, карбонаты, сульфаты, нитраты. Он входит в состав клеток живых организмов, участвует в процессах дыхания, диффузии, кровотока, в реакция окисления и восстановления.
Кислород
| Кислород | |
|---|---|
| Газ без цвета, вкуса и запаха; голубоватая жидкость (при низких температурах) | |
 |
жидкость: 1,141 г/см³
Кислород (O, лат. oxygenium ) — химический элемент 16-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VI группы, или к группе VIA), второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygene ), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 10 15 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца (IV):
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
Разложение оксида ртути (II) (при t = 100 °C) было первым методом синтеза кислорода:
2HgO → 100oC 2Hg + O2↑
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.