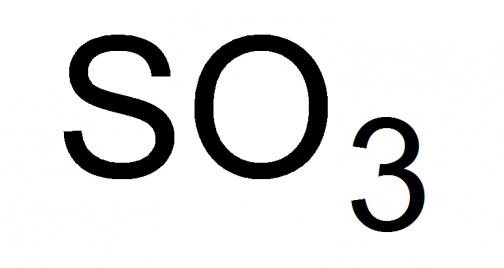что такое so2 в воздухе
Диоксид серы
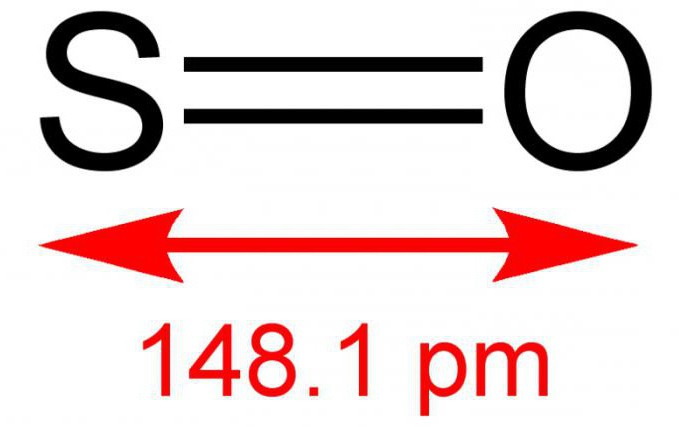
SO2 – бесцветный газ с острым запахом
Класс опасности (опасный)
Источники
ТЭЦ, металлургические предприятия, выбросы дизельного автотранспорта.Выделяется в атмосферу в основном при сжигании бурого угля и мазута, а также серосодержащих нефтепродуктов.
Увеличение концентраций диоксида серы является индикатором использования резервных видов топлива предприятиями теплоэнергетического комплекса (мазут, уголь, газ низкого качества)
Воздействие на организм
Дыхательные пути
При повышении уровня оксидов серы в воздухе учащаются заболевания дыхательных путей, например, бронхиты. Воздействие диоксида серы в концентрациях выше предельно-допустимой концетрации (ПДК) может вызвать нарушение функций дыхания и существенное увеличение предрасположенности к болезням дыхательных путей.
Легкие
Особенно высокая чувствительность к действию диоксида серы наблюдается у людей с хроническими нарушениями органов дыхания, с астмой. При совместных концентрациях диоксида серы и взвешенных частиц (в виде сажи) в среднем за сутки выше 0,2 мг/м 3 у взрослых и детей наблюдаются небольшие изменения в деятельности легких. В газообразной форме SO2 может вызывать раздражение органов дыхания, а в случае краткосрочного воздействия высоких доз в зависимости от индивидуальной чувствительности может наблюдаться обратимый эффект на функцию легких.
Вторичный продукт H7SO4 в основном оказывает влияние на функцию дыхания. Такие его соединения, как полиядерные аммиачные соли или сульфаторганические вещества, оказывают механическое воздействие на альвеолы и, будучи легко растворимыми химическими соединениями, свободно проникают через слизистые оболочки дыхательных путей в организм.
Общее воздействие
Отмечается раздражение слизистых оболочек, воспаления носоглотки, трахеи, учащается кашель, возможна хрипота и боль в горле.
Воздействие на окружающую среду
Кислотные дожди
При растворении в воде диоксид серы образует кислотные дожди, которые губят растения, закисляют почву, увеличивают кислотность озер.
Растения
Оксид серы в природе и жизни человека
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.
Общие данные о моноокисиде серы
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.
В промышленности получают сжиганием серы или обжигом ее сульфидов:
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
Окисление SO2 при помощи NO2:
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
Урок 12. оксид серы (iv). сернистая кислота и ее соли
Соединения серы: сернистый газ и сульфаты
Ключевые слова конспекта: соединения серы, сернистый газ, сульфаты, строение, получение, использование.
Оксид серы (IV) — сернистый газ
Оксид серы (IV) SO2 – вещество молекулярного строения, молекула имеет угловую конфигурацию. При обычных условиях оксид серы (IV) SO2 – бесцветный газ с удушливым запахом, растворим в воде (1 объём воды при комнатной температуре растворяет 36 объёмов SO2).
Оксид серы (IV) SO2 – кислотный оксид.
В водном растворе она ступенчато диссоциирует:
Наличие ионов водорода обусловливает изменение окраски индикатора. Например, при пропускании сернистого газа через раствор лакмуса окраска меняется с фиолетовой на красную.
SO2 + 2КОН = K2SO3 + H2О или SO2 + КОН = KHSO3
Так как в SO2 степень окисления серы промежуточная +4, для диоксида серы характерна окислительно-восстановительная двойственность. В реакциях с более сильными восстановителями SO2 – окислитель:
А в реакциях с более сильными окислителями SO2 – восстановитель:
В промышленности сернистый газ получают при обжиге пирита (FeS2) и других сульфидов:
или сжиганием серы в кислороде: S + O2 = SO2
В лаборатории сернистый газ получают действием сильных кислот на сульфиты. Обычно используют концентрированную H2SO4 и твёрдый сульфит натрия Na2SO3:
Сульфаты
Сульфаты – соли серной кислоты. Серная кислота образует два ряда солей: средние (содержат сульфат–ион SO4 2– ) и кислые (содержат гидросульфат-ион HSO4 – ).
Сульфаты можно рассматривать как ионные соединения, в узлах кристаллической решётки – катионы металлов и сульфат-анионы.
Сульфаты – твёрдые кристаллические вещества. Большинство сульфатов бесцветны, но окраска может быть обусловлена наличием того или иного катиона (например, медный купорос – кристаллы синего цвета, железный купорос – кристаллы светло–зелёного цвета и т. п.). Растворимость сульфатов в воде различна. Часто сульфаты кристаллизуются в виде кристаллогидратов.
Для распознавания сульфатов можно воспользоваться качественной реакцией на сульфат-ион. Реагентом является растворимая соль бария Ba(NO3)2, ВаCl2, (СН3СОО)2Ва. При взаимодействии реагента с раствором сульфата выпадает белый кристаллический осадок:
Наиболее распространёнными сульфатами являются:
Конспект урока «Соединения серы: сернистый газ и сульфаты».
Видео
Качественные реакции, как проходит горение
Качественная реакция на сернистый газ и на сульфит-ион представляет собой процесс обесцвечивания раствора перманганата калия: 5SO2+2H2O+2KMnO4→2H2SO4+2MnSO4+K2SO4 Двуокись серы является продуктом горения серы или горящих материалов, в состав которых входит сера: S+O2→SO2 ΔH=−297кДж/моль
Химические свойства оксида серы (IV)
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Диоксид серы
Диоксид серы (пищевая добавка Е220, двуокись серы, сернистый газ, сернистый ангидрид) — соединение серы с кислородом состава SO2. относится к консервантам синтетического происхождения, добавляется в технологических целях в пищевые продукты в процессе производства для увеличения длительности хранения. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле и серной кислоте. Один из основных компонентов вулканических газов.
Диоксид серы относится к группе искусственных пищевых консервантов.
Существует три способа получения пищевой добавки Е220:
В обычном состоянии представляет собой бесцветный газ с неприятным характерным запахом. Под давлением 4–5 кгс/см 2 образуется подвижная прозрачная жидкость.
Применение
Большая часть диоксида серы используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка Е220). Диоксид серы существует в вине в свободной и связанной формах, а также их комбинациях. Максимально допустимое количество диоксида серы в вине должно быть в пределах 350 частей на миллион и зависит от сорта вина и страны, в которой вино реализуется. Так, например, в ЕС эта норма составляет 160 частей на 1 000 000 для красных вин и 210 частей на миллион для белых и розовых вин. Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Диоксид серы используется для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таком его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и, как следствие присутствия воды, H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре. Диоксид серы применяется также для получения различных солей сернистой кислоты.
Польза и вред
Научные данные о пользе применения добавки Е220 для здоровья человека в настоящий момент отсутствуют.
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких. Серьёзное отравление (вплоть до летального) может наступить лишь при непосредственном вдыхании газа.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Предельно допустимая концентрация:
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Центр науки в интересах общества (CSPI) (некоммерческая организация, занимающаяся защитой прав потребителей в сфере продуктов питания) в США считает, что ряду людей следует избегать употребления пищевой добавки Е220, так как она разрушает витамин B1 и, самое главное, может вызвать тяжёлые аллергические реакции, особенно у астматиков. Для нечувствительных людей, сульфиты являются безопасными. Пищевой консервант может спровоцировать отёк Квинке.
Биологическая роль
Роль эндогенного сернистого газа в физиологии организма млекопитающих ещё окончательно не выяснена. Сернистый газ блокирует нервные импульсы от рецепторов растяжения лёгких и устраняет рефлекс, возникающий в ответ на перерастяжение лёгких, стимулируя тем самым более глубокое дыхание.
Показано, что эндогенный сернистый газ играет роль в предотвращении повреждения лёгких, уменьшает образование свободных радикалов, оксидативный стресс и воспаление в лёгочной ткани, в то время как экспериментальное повреждение лёгких, вызываемое олеиновой кислотой, сопровождается, наоборот, снижением образования сернистого газа и активности опосредуемых им внутриклеточных путей и повышением образования свободных радикалов и уровня оксидативного стресса. Что ещё более важно, блокада фермента, способствующего образованию эндогенного сернистого газа, в эксперименте способствовала усилению повреждения лёгких, оксидативного стресса и воспаления и активации апоптоза клеток лёгочной ткани. И напротив, обогащение организма подопытных животных серосодержащими соединениями, такими, как глютатион и ацетилцистеин, служащими источниками эндогенного сернистого газа, приводило не только к повышению содержания эндогенного сернистого газа, но и к уменьшению образования свободных радикалов, оксидативного стресса, воспаления и апоптоза клеток лёгочной ткани.
Считают, что эндогенный сернистый газ играет важную физиологическую роль в регуляции функций сердечно-сосудистой системы, а нарушения в его метаболизме могут играть важную роль в развитии таких патологических состояний, как лёгочная гипертензия, гипертоническая болезнь, атеросклероз сосудов, ишемическая болезнь сердца, ишемия-реперфузия и др.
Показано, что у детей с врождёнными пороками сердца и лёгочной гипертензией повышен уровень гомоцистеина (вредного токсичного метаболита цистеина) и снижен уровень эндогенного сернистого газа, причём степень повышения уровня гомоцистеина и степень снижения выработки эндогенного сернистого газа коррелировала со степенью выраженности лёгочной гипертензии. Предложено использовать гомоцистеин как маркёр степени тяжести состояния этих больных и указано, что метаболизм эндогенного сернистого газа может быть важной терапевтической мишенью у этих больных.
Также показано, что эндогенный сернистый газ понижает пролиферативную активность клеток гладких мышц эндотелия сосудов, угнетая активность MAPK-сигнального пути и одновременно активируя аденилатциклазный путь и протеинкиназу A. А пролиферация гладкомышечных клеток стенок сосудов считается одним из механизмов гипертензивного ремоделирования сосудов и важным звеном патогенеза артериальной гипертензии, а также играет роль в развитии стеноза (сужения просвета) сосудов, предрасполагающего к развитию в них атеросклеротических бляшек.
Эндогенный сернистый газ оказывает эндотелий-зависимое вазодилатирующее действие в низких концентрациях, а в более высоких концентрациях становится эндотелий-независимым вазодилататором, а также оказывает отрицательное инотропное действие на миокард (понижает сократительную функцию и сердечный выброс, способствуя снижению артериального давления). Этот вазодилатирующий эффект сернистого газа опосредуется через АТФ-чувствительные кальциевые каналы и кальциевые каналы L-типа («дигидропиридиновые»). В патофизиологических условиях эндогенный сернистый газ оказывает противовоспалительное действие и повышает антиоксидантный резерв крови и тканей, например при экспериментальной лёгочной гипертензии у крыс. Эндогенный сернистый газ также снижает повышенное артериальное давление и тормозит гипертензивное ремоделирование сосудов у крыс в экспериментальных моделях гипертонической болезни и лёгочной гипертензии. Последние (на 2015 год) исследования показывают также, что эндогенный сернистый газ вовлечён в регуляцию липидного метаболизма и в процессы ишемии-реперфузии.
Эндогенный сернистый газ также уменьшает повреждение миокарда, вызванное экспериментальной гиперстимуляцией адренорецепторов изопротеренолом, и повышает антиоксидантный резерв миокарда.
Влияние на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие её в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида. Необходимо отметить также, что диоксид серы имеет максимум в спектре поглощения света в ультрафиолетовой области (190–22 нм), что совпадает с максимумом в спектре поглощения озона. Это свойство диоксида серы позволяет утверждать, что наличие этого газа в атмосфере имеет также положительный эффект, предотвращая возникновение и развитие онкологических заболеваний кожи человека. Диоксид серы в атмосфере Земли существенно ослабляет влияние парниковых газов (диоксид углерода, метан) на рост температуры атмосферы. Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Статус
В России и на Украине пищевая добавка Е220 входит в список разрешённых пищевых добавок. В продукты консервант Е220 разрешено добавлять в количестве, не наносящем серьезного вреда здоровью.
Что такое so2 в воздухе
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.