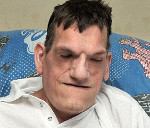
что такое синдром протея
Протейная инфекция у детей
Протейные инфекции – большая группа заболеваний, называемых протеозами. Вызываются протеями (Proteus), которые существуют практически во всех странах мира. Могут существовать в почве, воде, атмосферном воздухе. В больницах и госпиталях протеи «селятся» на медаппаратуре, предметах ухода за больными, санитарно-гигиеническом оборудовании.
Бактерии широко распространяются, новые госпитальные штаммы регулярно формируются из-за широкого применения антибиотиков и высокой резистентности протея к большинству этих препаратов. Протеи в отделениях для грудничков могут вызвать экзогенную нозокомиальную инфекцию.
Инфекцию распространяют больные люди разных возрастов и бактериовыделители без ярко выраженной симптоматики. Самое большое количество возбудителей протеоза выделяют с испражнениями больные с кишечной протейной инфекцией. В 1 г фекалий содержится до 10 7 —10 8 бактерий. Также большое количество возбудителя попадает во внешнюю среду при гнойно-воспалительных процессах: нагноении ожоговых поверхностей, операционных ран, отите, остеомиелите, флегмонах и т. д. То же касается и болезней мочевых путей, вызванных Proteus.
Данному заболеванию подвержены в том числе новорожденные, груднички и дети дошкольного возраста, лица, имеющие аномалии и поражения мочевых путей, а также ослабленные хирургическими вмешательствами и/или разными болезнями.
Пути передачи протейной инфекции:
Заболевания протеозами фиксируют на протяжении всех пор года, в основном заболеваемость спорадическая (без эпидемических вспышек).
Что провоцирует / Причины Протейной инфекции у детей:
Существует пять видов рода протеев:
Разница между видами заключается в антигенной структуре. Протеи на данный момент считаются условно-патогенными микроорганизмами, возбудителями нозокомиапьных инфекций по типу пиелонефрита, острого гастроэнтерита, омфалита и т.д.
Патогенез (что происходит?) во время Протейной инфекции у детей:
Инфекция попадает в организм ребенка через ЖКТ, раневые и ожоговые поверхности, мочевые пути. В месте внедрения протеи подавляют «родную» флору, выделяют ряд токсически действующих факторов (бактериоцины и лейкоцидин). Последние угнетают барьерные функции клеточных систем макроорганизма. Микроорганизмы становятся устойчивыми к бактерицидной активности сыворотки крови.
Протеи вырабатывают уреазу – фермент, который расщепляет мочевину. Это грозит ощелачиванием мочи, нарушением целостности эпителия мочевых путей и снижением его резистентности. Таким образом возбудитель болезни колонизирует мочевые пути.
Протеи в тонком кишечнике приводят к развитию энтероколита, энтерита. Формирование того или иного симптома зависит от состояния макроорганизма, дозы и вирулентности штамма возбудителя. Почти сразу после заражения какая-то доза бактерий попадает в стенку кишки и в органы, где и сохраняется. Предположительно, там он и размножается несколько суток. Если есть соответствующие условия, появляются вторичные очаги, которые в условиях снижения резистентности организма ребенка могут приводить к локальным инфекционным процессам или вторичной бактериемии.
Таким образом, протеи при экзогенном заражении могут спровоцировать не только кишечную инфекцию, но и сделать кишечник источником потенциальной эндогенной инфекции различной локализации (месторасположения).
Симптомы Протейной инфекции у детей:
Среди основных симптомов протеозов:
В детском организме поражается прежде всего желудочно-кишечный тракт, а также мочевая система. При кишечной инфекции заражение происходит во время контакта с заболевшим диереей человеком или во время употребления зараженной протеем еды. От 2-3 часов до 2 суток колеблется инкубационный период. Болезнь имеет острое начало, проявляются общеинфекционные симптомы, нарушается функция ЖКТ.
В первые же сутки после начала заоболевания температура «прыгает» до уровня до 37,5—38,5 °С, повышенной она остается 5-7 суток или дольше. Фиксируют ухудшение аппетита, в тяжелых случаях может развиться анорексия. Часто появляются гастроэнтерит и энтерит, а в более редких случаях — гастроэнтероколит и энтероколит. Рвота обычно повторяется (известна в научной литературе как повторная рвота), в первые 2-3 дня количество приступов составляет от 3 до 5 раз в сутки.
Стул больного водянистый, желто-зеленый, имеет очень неприятный запах. В стуле можно заметить непереваренные комочки пищи, может быть присемь слизи. Дефекация происходит 5-10 раз в сутки. В 1/3 случаев среди симптомов – метеоризм и боли в животе. В ½ случаев фиксируют увеличение печени, а в 1/3 случаев – селезенка.
У детей до 12-ти месяцев при заражении протейной инфекцией начинается кишечный токсикоз с эксикозом I—II степени. Фиксируют потерю массы тела, сухость слизистых оболочек и кожи, снижение эластичности кожи и тургора мягких тканей. Происходят нарушения сердечно-сосудистой системы: относительная тахикардия, приглушение тонов сердца, в некоторых случаях – систолический шум.
Патологические изменения легких проявляются такими симптомами:
В пик болезни фиксируют олигурию с умеренным количеством белка в моче. Под олигурией понимают уменьшение количества отделяемой почками мочи. Анализ крови показывает у ½ больных детей нейтрофилез, лейкоцитоз, палочкоядерный сдвиг, умеренно повышенную СОЭ.
Кишечная инфекция длится 5-10 дней. Самый длительный симптом – дисфункция кишечника с вторичными нарушениями пищеварения. Морфологические изменения в кишечнике представляют собой острый серозный энтерит. Гистологические методы исследования показывают отек стенок кишок, полнокровие, поверхностные дефекты. Лимфогистиоцитарные инфильтратыобнаруживаются обнаруживают в слизистой оболочке и подслизистом слое кишки. Дистрофические процессы наблюдаются в других внутренних органах. Есть вероятность развития пневмонии. Затяжной энтероколит может привести к возникновению глубоких множественных язв, диаметр которых от 0,2 до 0,5 мм. Язвы имеют приподнятые края. Редко они находятся в области единичных лимфатических фолликулов.
У детей с аномалией развития почек и органов мочевой системы может быть поражение мочевых путей. Частое поражение мочевых путей объясняется выработкой протеями фермента уреазы, которая способствует нарушению целостности эпителия мочевых путей и внедрению возбудителя в эти ткани. После попадания в мочевую систему возбудитель закрепляется в паренхиме почек, что приводит к развитию пиелонефрита.
Симптоматика протейных пиелонефритов:
Анализ мочи показывает умеренное количество лейкоцитов, небольшое число эритроцитов и повышение уровня белка в 2-3 раза. Ренгтен позволяет обнаружить уменьшение тени почек, «изъеденность» паренхимы чашечек.
Особенности протейной инфекции у новорожденных и детей до 12-ти месяцев. Нередкими являются вспышки протеозов в отделениях для новорожденных. Заражение может произойти через аппаратуру. Протейная инфекция может локазалироваться по-разному у новорожденных. Протейная диарея имеет острое начало, температура тела поднимается до уровня 37,5—38 ˚С. Проявляются такие симптомы как рвота и жидкий стул со слизью и зеленью, болезненность живота, вздутие, урчание по ходу расположения кишечника.
На протяжении 2-3 первых дней развивается дегидратация на фоне общеинфекционного токсикоза. Дети начинают плохо питаться (отталкивают грудь), наблюдается вялость, появляется токсическая одышка.
Есть вероятность инфекции пупочной ранки — омфалита в сочетании с инфекцией пупочных сосудов в виде септического артериита и флебита, захватывающего пупочную и портальную вены.
Диагностика Протейной инфекции у детей:
Для постановки диагноза нужны бактериологические исследования такого биологического материала как испражнения, рвотные массы, моча, кровь, отделяемое из воспалительных очагов на коже. Иногда исследуют на присутствие бактерий воду, пищевые продукты, смывы с предметов, которые использовал больной, с медаппаратуры, а также лекарственные растворы.
В диагностике важны показания серологических исследований. Антитела к аутоштамму протея начинают выявляться в РА с 5— 6-го дня болезни в титрах 1:200 и 1:400 с максимумом к 9—15-му дню от начала заболевания (1:400— 1:1600). Применяют также РСК и РПГА.
Болезни мочевых путей с с протейной бактериурией сопровождаются появлением антипротейных антител в титрах от 1:160 до 1:640. При пиелонефритах и септических состояниях диагностическое значение придается титрам антипротейных антител 1:320 и выше.
Лечение Протейной инфекции у детей:
Терапия кишечных инфекций базируется на тех же принципах, что и лечение других кишечных инфекций бактериальной природы. Для лечения легких форм используется колипротейный бактериофаг. Для лечения тяжелых форм протейной инфекции у детей применяют антибактериальные препараты, например, защищенные пенипиллины, гентамицин, цефалоспорины III поколения.
Нормализацию микрофлоры кишечника в периоде реконвалесценции проводят с помощью полибактерина, бифидумбактерина, линекса, бификола, энтерола и пр.
Если произошло поражение мочевыводящих путей и почечной паренхимы, необходимо восстановить нормальный пассаж мочи. Антибактериальную терапию в данных случаях проводят при бактериурии и признаках пиелонефрита. Уроштаммы протея устойчивы к пенициллину, эритромицину, полимиксину и сохраняют высокую чувствительность к препаратам налидиксовой кислоты.
Чтобы усилить эффективность противопротейных препаратов, их сочетают с другими. К примеру, фурадонин сочетается с эритромицином, невиграмон с левомниетином, ампициллин с геитамицином.
Вялотекущие процессы лечатся комплексной терапией, с включением иммуномодуляторов, к примеру, нуклеината натрия, метилурацила, а также вакцины из бактерий рода Proteus или аутовакцины. При тяжелых формах болезни врачи иногда прописывают колипротейную плазму и антипротейную иммунную сыворотку.
Прогноз
Неблагоприятным исходам грозят случаи генерализированных заболеваний у новорожденных недоношенных детей. Острые кишечные инфекции, вызванные протеями, оканчиваются в большинстве случаев выздоровлением ребенка. Течение протейной инфекции бывает упорным, с рецидивами. В последние годы часто формируется вялотекущий пиелонефрит, трудно поддающийся лечению.
Профилактика Протейной инфекции у детей:
Специфических профилактических мер протеозов пока что нет. Для предупреждения протеозов важно соблюдать санитарно-гигиенические правила. Большие трудности представляет борьба с нозокомиальной протейной инфекцией, особенно в палатах для новорожденных и в урологических стационарах. Для снижения риска инфицирования протеем в указанных медицинских учреждениях необходимо наряду с применением дезинфекции и антисептических средств orpaничивать инвазивные манипуляции до минимума.
К каким докторам следует обращаться если у Вас Протейная инфекция у детей:
Синдром Протея
Синдром Протея – это редкая врожденная патология, проявляющаяся аномальным ростом отдельных частей тела. Обычно выявляется увеличение участка головы, руки или ноги. Частичная гипертрофия сочетается с повышенной вероятностью развития тромбозов и тромбоэмболий, образования опухолей различной структуры и локализации. Диагноз выставляется на основании результатов осмотра, данных рентгенографии, КТ, МРТ, ангиографии, допплерографии. Радикальное лечение не разработано. Применяются ортопедические приспособления, по показаниям осуществляются операции для улучшения функций конечности, облегчения дыхания и приема пищи, выполняется хирургическое удаление неоплазий.
МКБ-10
Общие сведения
Синдром Протея (парциальный гигантизм) – очень редкое врожденное заболевание. В литературе упоминается примерно 200 случаев данной патологии, при этом специалисты не исключают, что некоторые пациенты могли страдать другими болезнями со сходной симптоматикой. Первое описание синдрома было представлено в 1979 году, однако широкую известность он получил после публикации работы немецкого педиатра Видемана в 1983 году. Название также было предложено Видеманом по ассоциации с древнегреческим богом Протеем, способным к изменению внешнего облика. Заболевание оказывает выраженное негативное влияние на качество жизни больных, как из-за внешнего обезображивания, так и вследствие нарушений функций пораженных частей тела. Нередко становится причиной ранней смерти из-за высокой вероятности развития опухолей и склонности к тромбозам.
Причины
Причиной развития заболевания является соматический мозаицизм, предположительно обусловленный случайной мутацией доминантного гена. Некоторые специалисты подвергают сомнению случайный характер мутации, опираясь на информацию о выявлении нескольких случаев легких признаков синдрома у родителей больных. Существуют исследования, согласно которым патология обусловлена мутацией гена PTEN, расположенного в локусе 10q X хромосомы. Вместе с тем, исследователи указывают, что мутации данного гена обнаруживаются всего у 20% пациентов с синдромом Протея и определяются при некоторых других заболеваниях, характеризующихся повышенной вероятностью образования злокачественных неоплазий. Таким образом, генетическая основа болезни пока окончательно не установлена.
Патогенез
В результате мутации в отдельных частях тела образуется три вида клеток – нормальные, гипер- и атрофические. На измененном участке в процесс вовлекаются кожные покровы, костная, мышечная и жировая ткань, лимфатические и кровеносные сосуды, что вызывает деформацию, увеличение длины и объема конечности или части головы, изменения сосудов. Поскольку дефектный ген является супрессором опухолей, наличие мутации резко повышает вероятность появления новообразований.
Симптомы
При рождении признаки заболевания отсутствуют. Патологические проявления возникают в раннем детском возрасте. Клиническая картина полиморфная. Характерными симптомами являются аномальное увеличение одной или нескольких конечностей, макроцефалия, сосудистые аномалии (мальформации, варикозное расширение вен). У некоторых больных выявляются офтальмологические нарушения: экзофтальм, косоглазие, миопия. При патологическом росте нижней челюсти формируется прогения. Возможно разрастание кожи в области подошв. В числе возможных вариантов патологии в литературных источниках упоминается изолированное увеличение селезенки или пальцев рук, атрофия зрительного нерва и пигментная дегенерация сетчатки в сочетании с множественными менингиомами.
Увеличение нижних конечностей влечет за собой нарушение опоры и движений. Пациенты вынуждены пользоваться ортопедической обувью и специальными приспособлениями (тростью, костылями, инвалидной коляской). При увеличении верхних конечностей наблюдаются трудности в процессе самообслуживания. Из-за деформации частей головы возникают грубые косметические дефекты, могут отмечаться затруднения при дыхании и приеме пищи. Существует высокая вероятность развития новообразований различной локализации и гистологической структуры: гамартом, липом, лимфангиом, гемангиом, аденом слюнных желез, менингиом и других.
Осложнения
Типичным признаком болезни Протея является возникновение злокачественных опухолей, существенно сокращающих продолжительность жизни больных. Другими опасными для жизни последствиями заболевания считаются осложнения сосудистых патологий. Отмечается повышенный риск тромбоза глубоких вен. Описаны случаи развития тромбоэмболии легочной артерии. Из-за увеличения и разницы в длине нижних конечностей возрастает нагрузка на суставы и позвоночник, формируется искривление позвоночного столба. Обнаруживаются вторичные артрозы, остеохондроз. Более чем у половины пациентов выявляется умственная отсталость, обусловленная сдавлением нервных тканей увеличенными костями черепа. Возможны судороги, неврологические расстройства.
Диагностика
Из-за незначительной распространенности, сходства синдрома Протея с некоторыми другими врожденными заболеваниями постановка диагноза может представлять значительные затруднения. В процессе диагностического поиска принимают участие специалисты в области онкологии, травматологии и ортопедии, сосудистой хирургии и пр. В качестве основных критериев рассматривают гемигипертрофию, сосудистые аномалии и склонность к образованию опухолей. План обследования включает:
При нарушениях со стороны органа зрения назначается офтальмологическое обследование, при умственной отсталости применяются тесты для определения уровня интеллекта, когнитивных способностей. При судорожном синдроме, расстройствах деятельности центральной и периферической нервной системы показана консультация невролога. Заболевание дифференцируют с врожденным липоматозом и синдромами Клиппеля-Треноне-Вебера, Маффучи, Баннайана-Зоннана, при которых также выявляются опухоли, частичная гипертрофия и патология сосудов.
Лечение синдрома Протея
Патогенетическая терапия не разработана, лечение только симптоматическое. По показаниям осуществляют ортопедическую коррекцию с использованием специальной обуви, ортезов, корсетов при вторичных изменениях позвоночника. Назначают медикаментозную терапию для профилактики тромбозов. Из-за вовлечения различных органов и систем оперативные лечебные мероприятия проводятся разными специалистами, в том числе – ортопедами, онкологами, нейрохирургами, вертебрологами, сосудистыми хирургами, хирургами-косметологами, челюстно-лицевыми хирургами и т. д. Можно выделить следующие группы операций при синдроме Протея:
Прогноз и профилактика
Синдром Протея является инвалидизирующим заболеванием, негативно влияет на продолжительность жизни пациентов. По данным исследований, многие больные погибают в детстве или молодом возрасте. Причинами летального исхода становятся злокачественные неоплазии, ТЭЛА, тромбозы крупных сосудов. Профилактические мероприятия не разработаны из-за врожденного характера патологии и недостаточной изученности этиологии болезни. Пациентам, страдающим данным заболеванием, необходимо регулярно проходить обследование для оценки состояния свертывающей системы крови, раннего выявления новообразований.
Публикации в СМИ
Токсикоинфекции пищевые
Пищевые токсикоинфекции — острые инфекционные заболевания, вызываемые услквно-патогенными бактериями, выделяющими экзотоксины. При попадании микроорганизмов в пищевые продукты токсины накапливаются в них и могут вызывать отравление человека.
Этиология • Пищевые токсикоинфекции (ПТИ) вызывает большая группа бактерий; основные возбудители — Staphylococcus aureus, Proteus vulgaris, Bacillus cereus, Clostridium perfringens, Clostridium difficile, представители родов Кlebsiella, Enterobacter, Citrobacter, Serratia, Enterococcus и др. • Возбудители широко распространены в природе, обладают выраженной устойчивостью и способны размножаться в объектах внешней среды. Все они — постоянные представители нормальной микрофлоры кишечника человека и животных • Нередко у заболевших не удаётся выделить возбудитель, т.к. клинику ПТИ в основном определяет действие микробных токсических субстанций • Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие свои биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
• Механизм передачи — фекально-оральный; основной путь передачи — пищевой • Для возникновения ПТИ, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определённое время для его размножения в пищевых продуктах •• Чаще всего ПТИ связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (тортов, пирожных) •• Основные продукты, участвующие в передаче клостридий, — мясо (говядина, свинина, куры и др.) •• Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствует прорастанию спор и размножению вегетативных форм • В эстафетной передаче возбудителя участвуют различные объекты внешней среды: вода, почва, растения, предметы быта и ухода за больными • Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных • Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в тёплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
• Естественная восприимчивость людей — высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу • Помимо свойств возбудителя (достаточная доза, высокая вирулентность), для развития заболевания необходимы факторы, способствующие возникновению ПТИ, как со стороны микроорганизма, так и со стороны макроорганизма (сниженная сопротивляемость, наличие сопутствующих заболеваний и др.) •• Более восприимчивы люди из групп риска: новорождённые, ослабленные лица, пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Патогенез. Общее свойство всех возбудителей ПТИ — способность синтезировать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (липополисахаридных комплексов). Именно вследствие особенностей действия этих токсинов отмечают определённое своеобразие в клинических проявлениях ПТИ, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии ПТИ указывает и относительно короткий инкубационный период заболевания.
• В зависимости от типов токсинов, они могут вызывать гиперсекрецию жидкости в просвет кишечника, клинические проявления гастроэнтерита и системные проявления заболевания в виде синдрома интоксикации.
• Токсины бактерий реализуют своё действие через синтез эндогенных медиаторов (цАМФ, Пг, ИЛ, гистамина и др.), непосредственно регулирующих структурно-функциональные изменения органов и систем, выявляемые у больных с ПТИ.
• Сходство патогенетических механизмов ПТИ различной этиологии обусловливает общность основных принципов в подходах к лечебным мероприятиям при этих заболеваниях, а также при сальмонеллёзе и кампилобактериозе.
Клиническая картина • Инкубационный период обычно составляет несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, удлиняться до 24 ч и более • Несмотря на полиэтиологичность ПТИ, основные клинические проявления синдрома интоксикации и водно-электролитных расстройств при этих заболеваниях сходны между собой и мало отличимы от таковых при сальмонеллёзе • Для заболеваний характерно острое начало с тошноты, повторной рвоты, жидкого стула энтеритного характера от нескольких раз до 10 и более дефекаций в сутки • Боли в животе и температурная реакция могут быть незначительными, однако в части случаев выявляют сильные схваткообразные боли в животе, кратковременное (до суток) повышение температуры тела до 38–39 °С, озноб, общую слабость, недомогание, головную боль • Степень выраженности клинических проявлений дегидратации и деминерализации зависит от объёма жидкости, теряемой больным при рвоте и диарее • Течение заболевания короткое и в большинстве случаев составляет 1–3 дня.
Дифференциальная диагностика. ПТИ следует отличать от сальмонеллёза и других острых кишечных инфекций — вирусных гастроэнтеритов, шигеллёзов, кампилобактериоза, холеры и других, а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологий, ИМ.
Лабораторная диагностика • Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений • Однако возбудитель выделяют достаточно редко, а обнаружение конкретного микроорганизма у больного ещё не позволяет считать его причиной заболевания. Для этого необходимо доказать этиологическую роль возбудителя либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из заражённого продукта и из выделений больного.
Осложнения регистрируют крайне редко; возможны гиповолемический шок острая сердечно-сосудистая недостаточность, сепсис и др.
Лечение такое же, как при сальмонеллёзе • Показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированного угля и др.), витаминов • При необходимости проводят регидратационную терапию (см. Сальмонеллёз) • Этиотропное лечение при неосложнённом течении ПТИ не показано.
Сокращения. ПТИ — пищевая токсикоинфекция.
МКБ-10 • A05 Другие бактериальные пищевые отравления
Код вставки на сайт
Токсикоинфекции пищевые
Пищевые токсикоинфекции — острые инфекционные заболевания, вызываемые услквно-патогенными бактериями, выделяющими экзотоксины. При попадании микроорганизмов в пищевые продукты токсины накапливаются в них и могут вызывать отравление человека.
Этиология • Пищевые токсикоинфекции (ПТИ) вызывает большая группа бактерий; основные возбудители — Staphylococcus aureus, Proteus vulgaris, Bacillus cereus, Clostridium perfringens, Clostridium difficile, представители родов Кlebsiella, Enterobacter, Citrobacter, Serratia, Enterococcus и др. • Возбудители широко распространены в природе, обладают выраженной устойчивостью и способны размножаться в объектах внешней среды. Все они — постоянные представители нормальной микрофлоры кишечника человека и животных • Нередко у заболевших не удаётся выделить возбудитель, т.к. клинику ПТИ в основном определяет действие микробных токсических субстанций • Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие свои биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
• Механизм передачи — фекально-оральный; основной путь передачи — пищевой • Для возникновения ПТИ, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определённое время для его размножения в пищевых продуктах •• Чаще всего ПТИ связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (тортов, пирожных) •• Основные продукты, участвующие в передаче клостридий, — мясо (говядина, свинина, куры и др.) •• Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствует прорастанию спор и размножению вегетативных форм • В эстафетной передаче возбудителя участвуют различные объекты внешней среды: вода, почва, растения, предметы быта и ухода за больными • Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных • Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в тёплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
• Естественная восприимчивость людей — высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу • Помимо свойств возбудителя (достаточная доза, высокая вирулентность), для развития заболевания необходимы факторы, способствующие возникновению ПТИ, как со стороны микроорганизма, так и со стороны макроорганизма (сниженная сопротивляемость, наличие сопутствующих заболеваний и др.) •• Более восприимчивы люди из групп риска: новорождённые, ослабленные лица, пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Патогенез. Общее свойство всех возбудителей ПТИ — способность синтезировать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (липополисахаридных комплексов). Именно вследствие особенностей действия этих токсинов отмечают определённое своеобразие в клинических проявлениях ПТИ, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии ПТИ указывает и относительно короткий инкубационный период заболевания.
• В зависимости от типов токсинов, они могут вызывать гиперсекрецию жидкости в просвет кишечника, клинические проявления гастроэнтерита и системные проявления заболевания в виде синдрома интоксикации.
• Токсины бактерий реализуют своё действие через синтез эндогенных медиаторов (цАМФ, Пг, ИЛ, гистамина и др.), непосредственно регулирующих структурно-функциональные изменения органов и систем, выявляемые у больных с ПТИ.
• Сходство патогенетических механизмов ПТИ различной этиологии обусловливает общность основных принципов в подходах к лечебным мероприятиям при этих заболеваниях, а также при сальмонеллёзе и кампилобактериозе.
Клиническая картина • Инкубационный период обычно составляет несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, удлиняться до 24 ч и более • Несмотря на полиэтиологичность ПТИ, основные клинические проявления синдрома интоксикации и водно-электролитных расстройств при этих заболеваниях сходны между собой и мало отличимы от таковых при сальмонеллёзе • Для заболеваний характерно острое начало с тошноты, повторной рвоты, жидкого стула энтеритного характера от нескольких раз до 10 и более дефекаций в сутки • Боли в животе и температурная реакция могут быть незначительными, однако в части случаев выявляют сильные схваткообразные боли в животе, кратковременное (до суток) повышение температуры тела до 38–39 °С, озноб, общую слабость, недомогание, головную боль • Степень выраженности клинических проявлений дегидратации и деминерализации зависит от объёма жидкости, теряемой больным при рвоте и диарее • Течение заболевания короткое и в большинстве случаев составляет 1–3 дня.
Дифференциальная диагностика. ПТИ следует отличать от сальмонеллёза и других острых кишечных инфекций — вирусных гастроэнтеритов, шигеллёзов, кампилобактериоза, холеры и других, а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологий, ИМ.
Лабораторная диагностика • Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений • Однако возбудитель выделяют достаточно редко, а обнаружение конкретного микроорганизма у больного ещё не позволяет считать его причиной заболевания. Для этого необходимо доказать этиологическую роль возбудителя либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из заражённого продукта и из выделений больного.
Осложнения регистрируют крайне редко; возможны гиповолемический шок острая сердечно-сосудистая недостаточность, сепсис и др.
Лечение такое же, как при сальмонеллёзе • Показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированного угля и др.), витаминов • При необходимости проводят регидратационную терапию (см. Сальмонеллёз) • Этиотропное лечение при неосложнённом течении ПТИ не показано.
Сокращения. ПТИ — пищевая токсикоинфекция.
МКБ-10 • A05 Другие бактериальные пищевые отравления