что такое сильное основание
Кислоты и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Сильные и слабые кислоты и основания
Сильные кислоты
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
Слабые кислоты
Растворяются в воде только частично, например, HF:
Сильные основания полностью диссоциируют в воде:
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
Слабые основания
Список слабых оснований
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Слабое основание и слабая кислота
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Способы определения pH
Инструментальный метод
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
10 Самых сильных оснований когда-либо синтезированных
Основание, в химии, относится к любому веществу, которое высвобождает гидроксидные ионы (OH − ) при растворении в воде или водном растворе. Многие основания, однако, не легко переносят гидроксидные ионы, но они также производят высокие уровни OH − при обработке водой. Этот тип реакции можно наблюдать, когда аммиак обрабатывают водой с получением аммония и гидроксида.
Основания также имеют отличительные физические характеристики; например, они горьки на вкус (кислоты кислы) и дают скользкое ощущение при прикосновении. Основы необходимы и являются жизненно важным компонентом в конкретных отраслях промышленности. Они использованы для того чтобы сделать бумагу, мыло и синтетическую вискозу, порошок отбеливания, антацид. Хотя они обычно рассматриваются как химическая противоположность кислот, есть несколько известных кислот, которые могут вести себя так же, как основания при определенных обстоятельствах.
Cверхоснование
Термин «сверхоснование» не нов и использовался более полутора столетий. Поскольку сверхоснование подвержены бурной реакции, при контакте с водой или углекислым газом для проведения химических реакций требуется специальный растворитель. Сверхоснование могут быть классифицированы на три типа; органические, неорганические и металлоорганические. Ниже приведен список 10 сильнейших баз на Земле.
10. Гидроксид лития
Химическая формула: LiOH
Большое количество LiOH используется для производства литиевого мыла. Другое важное использование гидроксида лития делается в вентиляционных системах подводных лодок и космических аппаратов для устранения углекислого газа путем создания воды и карбоната лития.
Он также используется в качестве средства борьбы с коррозией в ядерных реакторах (реактор с водой под давлением) и в качестве электролита батареи.
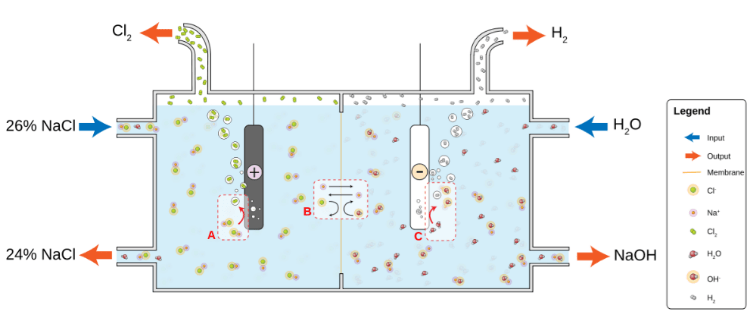
9. Гидроксид натрия
Рабочая модель процесса Хлоралкалия или электролиза Хлоралкалия
Химическая формула: NaOH
Гидроксид натрия широко используется для химической варки целлюлозы в бумажной промышленности. Его другие применения включают в себя производство мыла и моющих средств, обработку сырой пищи, производство цемента и водоочистные сооружения для нейтрализации значений pH воды. Он также время от времени используется в нефтяной промышленности для нейтрализации кислот и повышения уровня щелочности определенного раствора.
В древние времена NaOH получали обработкой гидроксида кальция карбонатом натрия. К 19 веку его заменил процесс Сольвея, который использовался для производства карбоната натрия, дешевой альтернативы NaOH. Сегодня большая часть промышленного гидроксида натрия создается с помощью процесса хлоралкалия.
8. Гидроксид калия
Химическая формула: KOH
Многие из вас могут распознать гидроксид калия как едкий калий, твердое белое вещество, известное своей высококоррозионной природой. Подобно гидроксиду натрия, KOH является бесцветным (коммерчески доступно в белом цвете) и прочным квинтэссенцией.
В то время как гидроксид калия и гидроксид натрия могут использоваться как взаимозаменяемые вещества для различных целей, в большинстве отраслей промышленности используется NaOH, так как он дешевле двух. В любом случае он используется для производства биодизеля, мыла и в качестве электролита в некоторых батареях.
Чистый гидроксид калия получают взаимодействием гидроксида натрия с деградированным или нечистым калием. Химическое соединение потенциально опасно и вызывает ожоги кожи при концентрации более 2%. Все, что от 0,5% до 2%, может вызвать сильное раздражение.
7. Бис(триметилсилил) амид лития
Химическая Формула: C 6 H 18 LiNSi 2
Бис (триметилсилил) амид лития, или сокращенно LiHMDS, представляет собой ненуклеофильную супероснову, которая имеет важные применения в лабораториях. Как и другие реагенты на основе лития, он может образовывать циклические соединения с тримером, анионом, созданным комбинацией трех ионов одного и того же вещества. LiHMDS обычно получают взаимодействием бис (триметилсилил) амина с бутиллитием.
HN (SiMe3) 2 + C4H9Li → LiN (SiMe3) 2 + C4H10
6. Гидрид натрия
Химическая формула: NaH
Гидрид натрия принадлежит к особой группе гидридов, известных как солевые/ионные гидриды (состоящие из ионов Na+ и H-), которые, в отличие от аммиака и воды, существуют в солеобразной форме. В основном он используется в качестве основы органического синтеза, хотя известно также малое количество незначительных случаев использования NaH. Гидрид натрия образуется при реакции водорода с жидким натрием.
В редких случаях соединение может принимать форму «обратного гидрида натрия», где натрий и ионы водорода обмениваются зарядами (Na- и H+). Na- является щелочью, что делает это соединение более энергетическим, чем стандартный гидрид натрия (из-за увеличенного чистого смещения между двумя электронами).
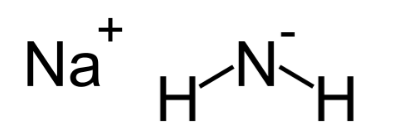
5. Амид Натрия
Химическая формула: NaNH 2
Азид натрия, иногда известный как Амид натрия, является одним из самых сильных известных оснований в мире. Это важное, коммерчески доступное химическое соединение, которое обычно используется в органическом синтезе. NaNH 2 проводит электричество (в сплавленном состоянии), так как его электрические свойства проводимости почти аналогичны свойствам гидроксида натрия.
В то время как чистый гидроксид натрия обычно белый, большая часть коммерчески доступных NaNH 2 имеет серый цвет из-за наличия примесей в виде металлического железа. Обычно Амид натрия получают путем взаимодействия аммиачного газа с натрием.
Амид натрия является предпочтительным в некоторых типах синтеза из-за его функций в качестве нуклеофила. Это потенциально опасное химическое вещество, с которым следует обращаться с особой осторожностью. Он может энергично реагировать с водой, особенно когда присутствует в твердой форме.
4. Диизопропиламид лития
Химическая формула: C 6 H 14 LiN
Следующим в списке является диизопропиламид лития, еще одна ненуклеофильная сверхоснова, которая известна своей сильно коррозионной природой и растворимостью. В нормальных условиях соединение синтезируется путем обработки охлажденного раствора диизопропиламина (тетрагидрофурана) Бутиллитием. Излишне говорить, что диизопропиламид лития является коррозионным, а пирофорные, но коммерческие растворы гораздо безопаснее.
3. Бутиллитий
Химическая формула: C 4 H 9 Li
Н-Бутиллитий коммерчески важное свероснова, главным образом используемое как катализатор для полимерности для того чтобы произвести синтетический каучук. Он также используется в фармацевтической промышленности. Хотя бутиллитий в основном бесцветный, он может претерпевать незначительные изменения цвета либо при контакте с алканами, либо при старении.
Помимо сверхосновы, Н-Бутиллитий является мощным восстановителем, а также нуклеофилом (химическое вещество, которое жертвует электронную пару, образуя связь). Бутиллитий обычно получают взаимодействием лития с 1-бромбутаном или 1-хлорбутаном.
Бутиллитий нестабилен и может активно реагировать с водой и углекислым газом, но его можно безопасно хранить под инертным газом.
2. Анион окиси лития
Анион монооксида лития когда-то был самой сильной основой в мире до того, как был свергнут с престола в 2008 году. Как и другие сверхосновы, монооксид лития готовят в апротонном растворителе и также известен своей чрезвычайно агрессивной природой.
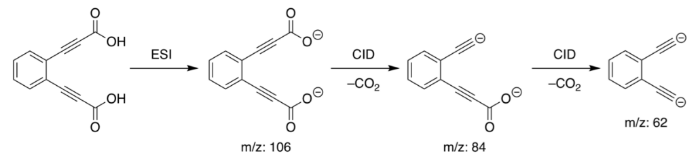
Синтез аниона моноксида лития является сложной процедурой, и ее сложно проводить контролируемым образом. Обычно небольшое количество оксалата лития (Li 2 C 2 O 4 ) используется в качестве предшественника, который проходит процесс ионизации электрораспылением. Полученное соединение оксалат-анион лития (LiC 2 O 4 ) выделяют и затем обрабатывают с индуцированной столкновением диссоциацией дважды.
В результате получаем анион оксида лития (LiO-) и молекулу диоксида углерода. Использование аниона оксида лития неизвестно.
1. Орто-diethynylbenzene дианион
Химическая формула: [C 6 H 4 (C2) 2 ] 2–
E pa: 1843 кДж / моль
Орто-diethynylbenzene дианион является, пожалуй, самым сильным сверхоснованием, известным нам. Он был первоначально синтезирован/открыт группой исследователей в Австралии с использованием масс-спектрометрии.
Кроме того, орто-diethynylbenzene имеет два изомера (с одинаковой молекулярной формулой, но различной химической структурой); Мета-диэтинилбензол дианион и пара-диэтинилбензол дианион, второе и третье сильнейшее основание, когда-либо синтезированное. Оба изомера, включая орто-diethynylbenzene, не имеют известного применения и существуют в газообразном состоянии.
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ