что такое сдвиг мозга brain shift
Нейроинтерфейсы: как наука ставит людей на ноги
Нейроинтерфейсы: как наука ставит людей на ноги
Роботизированный экзоскелет, управляемый нейроинтерфейсом.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: В СМИ часто можно услышать о проектах, которые помогают парализованным людям взаимодействовать с окружающим миром. Но в этой статье мы поговорим о не менее интересной, но более обойдённой вниманием теме — о нейроинтерфейсах, помогающих людям с параличом конечностей восстанавливать самостоятельную двигательную активность.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Более 5 миллионов человек в мире страдают от разной формы параличей, основные причины которых — инсульт (34%) и повреждение спинного мозга (24%).
Инсульт в настоящее время является одной из основных причин инвалидизации населения. В России ежегодно регистрируется более 450 000 инсультов, и инвалидами становятся 70–80% выживших после инсульта, причём примерно 20–30% из них нуждаются в постоянном постороннем уходе.
За последние 70 лет количество больных с травмой спинного мозга возросло в 200 раз, и в России подобные повреждения ежегодно получают более 8 000 человек. Чаще всего это приводит к неспособности больного самостоятельно передвигаться и обеспечивать свои основные потребности. В результате использования инвалидной коляски уменьшается физическая активность, что провоцирует развитие ряда заболеваний: болезни сердца, остеопороз, пролежни. Поэтому идет активный поиск альтернативных методов восстановления способности двигаться. Одной из самых новых разработок в этом направлении является нейроинтерфейс.
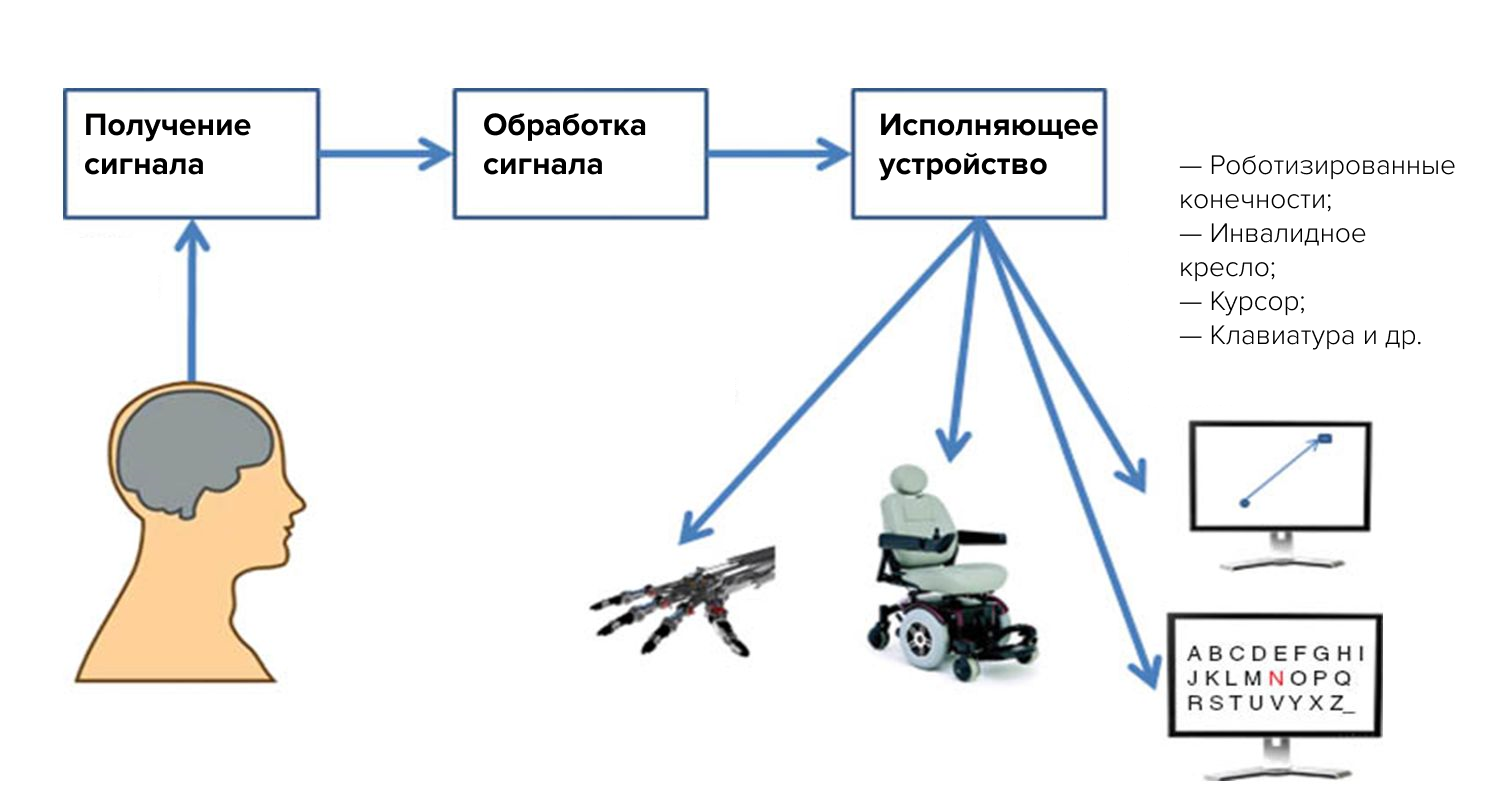
Нейроинтерфейс (он же интерфейс «мозг-компьютер», ИМК) — система, позволяющая передавать сигналы мозга напрямую на внешнее устройство (это может быть инвалидная коляска, экзоскелет, компьютер и др.), фактически управлять «силой мысли» (рис. 1).
В «Биомолекуле» можно более подробно прочитать про историю развития нейрокомпьютерных технологий, а также про современный проект Neuralink Илона Маска [1], [2].
Рисунок 1. Схема работы ИМК.
адаптировано по материалам сайта Tritriwulansari
Методы регистрации сигналов мозга
Первое звено в схеме работы ИМК — это получение сигнала от мозга. Для этого используют следующие методы:
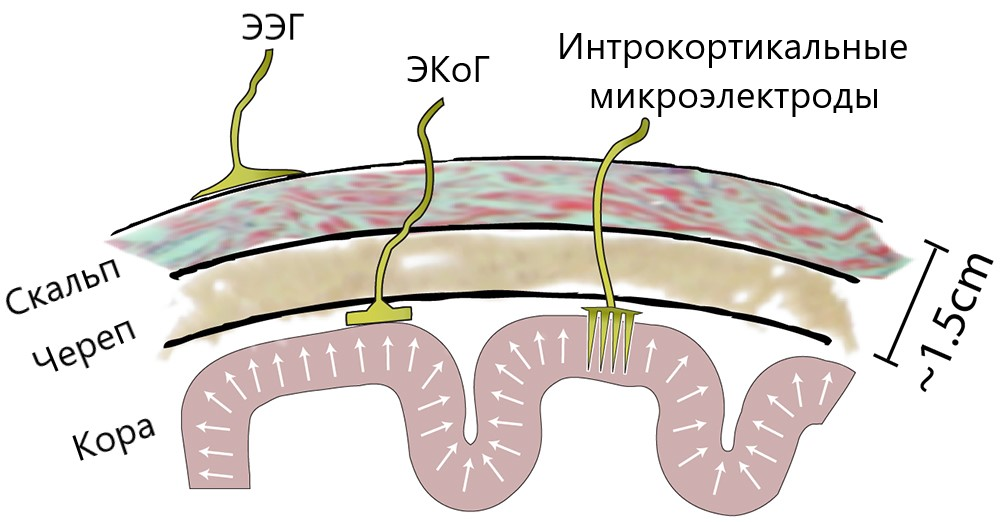
Сейчас в ИМК для получения информации об электрической активности мозга наиболее часто применяют ЭЭГ, так как она имеет высокое временное разрешение (электроды позволяют считывать немедленную активность отдельных участков мозга), относительно дешева, портативна и не представляет риска для пользователей. ИМК, основанные на ЭЭГ, состоят из набора сенсоров, улавливающих ЭЭГ-сигналы от различных областей мозга. Однако качество сигналов ЭЭГ ухудшается из-за того, что сигнал проходит через скальп, череп, а также множество других слоев, что создает шум.
Для уменьшения шума и улучшения качества записи прибегают к инвазивным способам — имплантированию внутрь черепа набора микроэлектродов [3]. Это подразумевает значительный риск для здоровья, из-за чего их редко задействуют в экспериментальной практике. В исследованиях ИМК существуют два инвазивных подхода: электрокортикография (ЭКоГ), при которой электроды располагаются на поверхности коры головного мозга, и интракортикальная запись нейронной активности — когда датчики имплантируют в кору (рис. 2). Такие решения в настоящее время применяют крайне редко, только в исключительных случаях: либо когда пациенту и так предстоит операция на мозге, либо когда это единственный шанс на возвращение возможности взаимодействовать с окружающим миром.
Рисунок 2. Схема расположения электродов для ЭЭГ, ЭКоГ и интракортикальных микроэлектродов.
Сенсомоторный ритм и моторная кора
Как мы уже говорили, цель ИМК — улавливание намерения пользователя посредством регистрации его мозговой активности. При регистрации мозговой активности с помощью ЭЭГ мы получаем графическое изображение сложного колебательного электрического процесса, в котором можно выделить ряд определённых ритмов, которые отличаются между собой по амплитуде и частоте: альфа, бета, дельта, мю и другие. Сейчас нас интересует мю-ритм, так как именно на его основе работают нейроинтерфейсы, используемые в нейрореабилитации движений.
Мю-ритм, или сенсомоторный ритм (СМР), имеет частоту 8–13 Гц и регистрируется над моторной областью коры головного мозга, расположенной в задней части прецентральной извилины (рис. 3). Подавление мю-ритма происходит тогда, когда человек совершает какое-либо движение или воображает выполнение движения — это называется десинхронизацией, связанной с событием (event-related desynchronization, ERD). Это происходит потому, что нейроны, которые до этого возбуждались синхронно, приобретают индивидуальные, не похожие друг на друга паттерны возбуждения. При этом человек может тренироваться в воображении движений, и со временем подавление мю-ритма при этом становится всё более выраженным, что используют при обучении управлению ИМК.
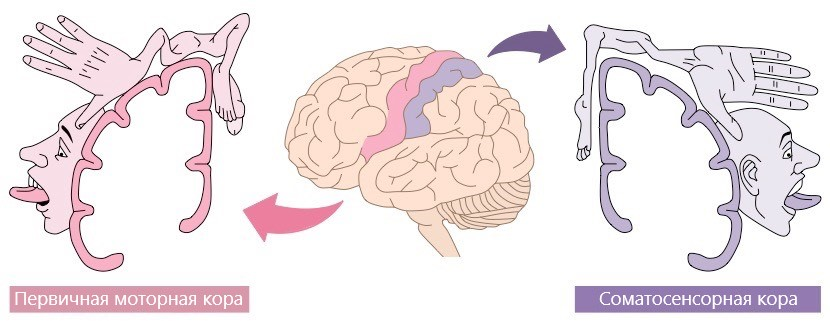
Для моторной коры характерна топическая организация. Это значит, что каждому участку коры соответствует определённый участок тела, который она контролирует. На рисунке 3 изображен гомункулус Пенфилда, части тела которого пропорциональны зонам мозга, в которых они представлены. Как видно из рисунка, представительства верхних и нижних конечностей находятся достаточно далеко друг от друга, благодаря чему возможно раздельное распознавание нейроинтерфейсом воображения движений рук и ног.
Рисунок 3. Соматосенсорный и моторный гомункулус.
адаптировано по материалам сайта BioNinja
Обратите внимание, что представительство нижних конечностей в моторной коре значительно меньше представительства верхних. Это легко объяснимо наличием мелкой моторики рук: мозгу нужно контролировать множество отдельных мышц пальцев. У ног же, наоборот, мало мышц, которыми нужно управлять, и они более крупные. К тому же видно, что представительство нижних конечностей попадает в межполушарную щель, что затрудняет распознавание сигналов ЭЭГ, генерируемых при воображении движений разных групп мышц ног. Поэтому использование ИМК для ног вызывает определённые сложности, и большинство существующих научных работ по нейрореабилитации с помощью ИМК посвящено именно верхним конечностям, так как с их воображением проще работать. В лаборатории физиологии движений Института физиологии им. И.П. Павлова РАН, где работает автор, проводят исследования, направленные на изучение процессов реабилитации нижних конечностей, а также на возможность применения при этом чрескожной электростимуляции спинного мозга (ЧЭССМ) и специальных практик, помогающих увеличить эффективность управления ИМК [4].
Как эффективно воображать движения
Известны следующие особенности воображения движений, которые повышают его эффективность:
Кроме того, нами было показано, что эффективность воображения движений зависит от личностных характеристик человека [15].
Для эксперимента было набрано 44 человека с ведущей правой рукой. Все они проходили тестирование по опроснику Кеттелла, который определяет 16 основных индивидуальных особенностей. Далее испытуемые управляли ИМК, основанном на воображении движений рук. Оказалось, что при воображении движений правой руки успешнее экспрессивные чувствительные экстраверты, а при воображении движений левой руки — практичные, сдержанные, скептичные и не очень общительные люди.
Мы предполагаем, что это можно объяснить разным уровнем содержания дофамина в правом и левом полушариях, а также разницей в способах кодирования информации о движениях [16]. Более подробно об этом можно прочитать в статье, опубликованной автором и коллегами в журнале «Доклады Академии наук» [15]. Знание личных психологических параметров пользователя ИМК может помочь в разработке индивидуальных тренингов и методов подготовки перед управлением нейроинтерфейсами.
Зачем же нужно воображение движений и работа с нейроинтерфейсами? Как это может помочь людям с нарушениями движений? Разберём эти вопросы на примере двух самых распространенных причин двигательных расстройств — инсульта и травмы спинного мозга.
Механизмы нейропластичности
При инсульте происходит острое нарушение кровоснабжения головного мозга (либо в результате закупоривания сосуда тромбом — ишемический инсульт, либо в результате кровоизлияния — геморрагический). Так как вместе с кровью к нейронам перестаёт поступать всё, что необходимо им для жизнедеятельности, участки мозга, где остановилось кровообращение, отмирают. И если это зоны, отвечающие за двигательную активность — например, моторная область коры, то у больного возникает гемипарез, снижение силы мышц одной стороны тела, или гемиплегия, полный паралич половины тела.
Восстановление двигательной функции осуществляется в основном за счет механизмов нейропластичности — способности мозга изменяться под действием опыта: устанавливать новые связи между нейронами, разрушать старые и ненужные, восстанавливать утраченные после повреждения. В данных процессах принимают участие не только нейроны, но и клетки нейроглии, а также сосудистая система [17]. Также изменяется активность синапсов и их количество [18]. Для активации данных механизмов в медицине применяется двигательная реабилитация. Однако у пациентов с параличом или высокой степенью пареза осуществление реальных движений невозможно, поэтому прибегают к тренировкам с ИМК, основанном на воображении движений. При представлении движений активируются те же зоны мозга, которые также участвуют в подготовке реального действия и в его совершении, вследствие чего такая нейрореабилитация становится реальной [19].
Благодаря таким реабилитационным тренировкам происходит перестройка нейронов вокруг повреждённой области: увеличивается объём серого вещества в двигательной зоне мозга, а соседние участки берут на себя утраченные функции [20]. Двигательные области неповреждённого полушария также участвуют в этом процессе.
Эффективность этих занятий может быть повышена за счёт использования биологической обратной связи — зрительной или тактильной — когда пациент видит на экране монитора, насколько хорошо он справляется с заданием (воображением движения конечности), или когда он чувствует вибрацию от специального прибора при успешном выполнении задачи.
Также существуют системы, дающие двигательную обратную связь: например, когда человек воображает движение правой ноги, приводя её в движение специальным механизмом. По такому принципу работает система «Биокин» (ООО «Косима»), разработанная под руководством Герасименко Ю.П. (Институт физиологии им. И.П. Павлова РАН) (рис. 4) [21]. Она включает в себя обратную связь, функциональную электростимуляцию (ФЭС) и чрескожную электростимуляцию спинного мозга (ЧЭССМ), что делает её высокоэффективным инструментом в области нейрореабилитации нижних конечностей [22].
Рисунок 4. Биокин. Комплекс для нейрореабилитации нижних конечностей, основанный на применении ИМК с обратной связью, ФЭС (функциональной электростимуляции) и ЧЭССМ (чрескожной электростимуляции спинного мозга).
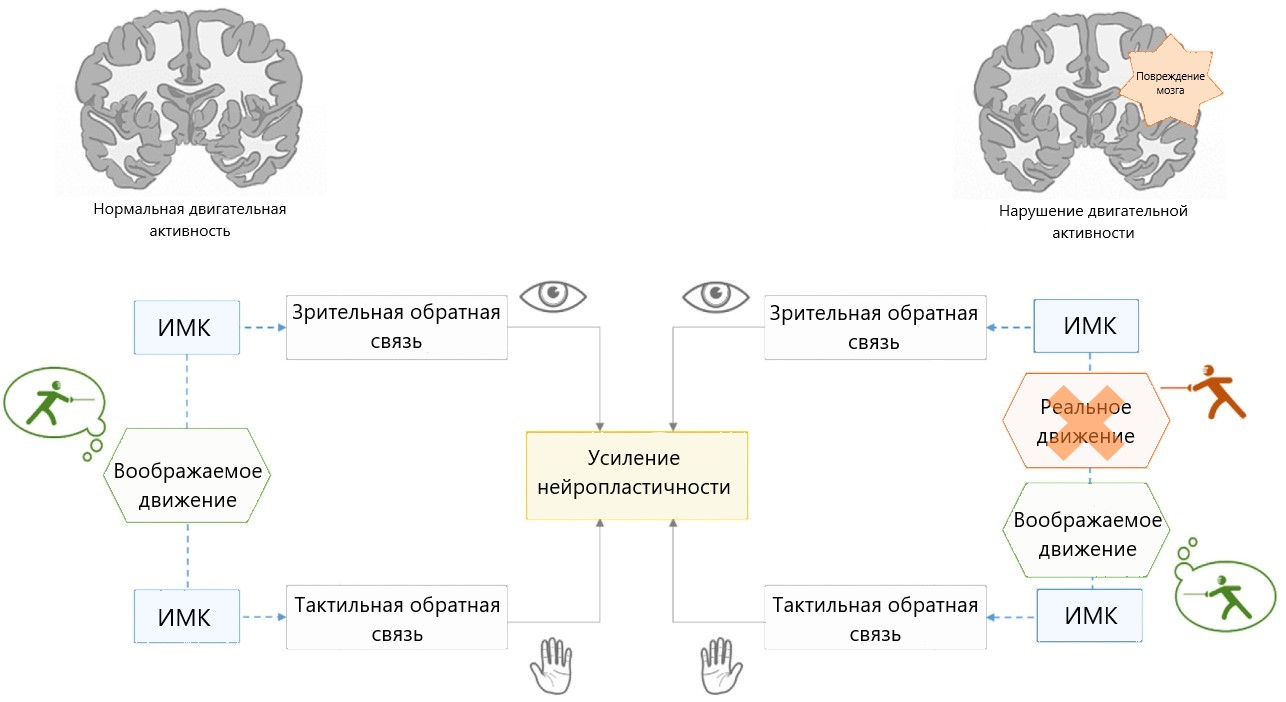
Такие системы позволяют замкнуть сенсомоторную петлю: от посылаемого мозгом эфферентного (исходящего) сигнала двигательной активности к афферентному (приходящему) сигналу о сенсорной обратной связи (рис. 5) [23].
Рисунок 5. Нейропластичность, вызываемая использованием ИМК, основанном на воображении движений. При повреждении моторных областей коры реальное движение становится невыполнимым, поэтому для активации процессов нейропластичности остаётся только возможность воображения движений. Использование ИМК со зрительной и тактильной обратной связью обеспечивает усиление этих процессов.
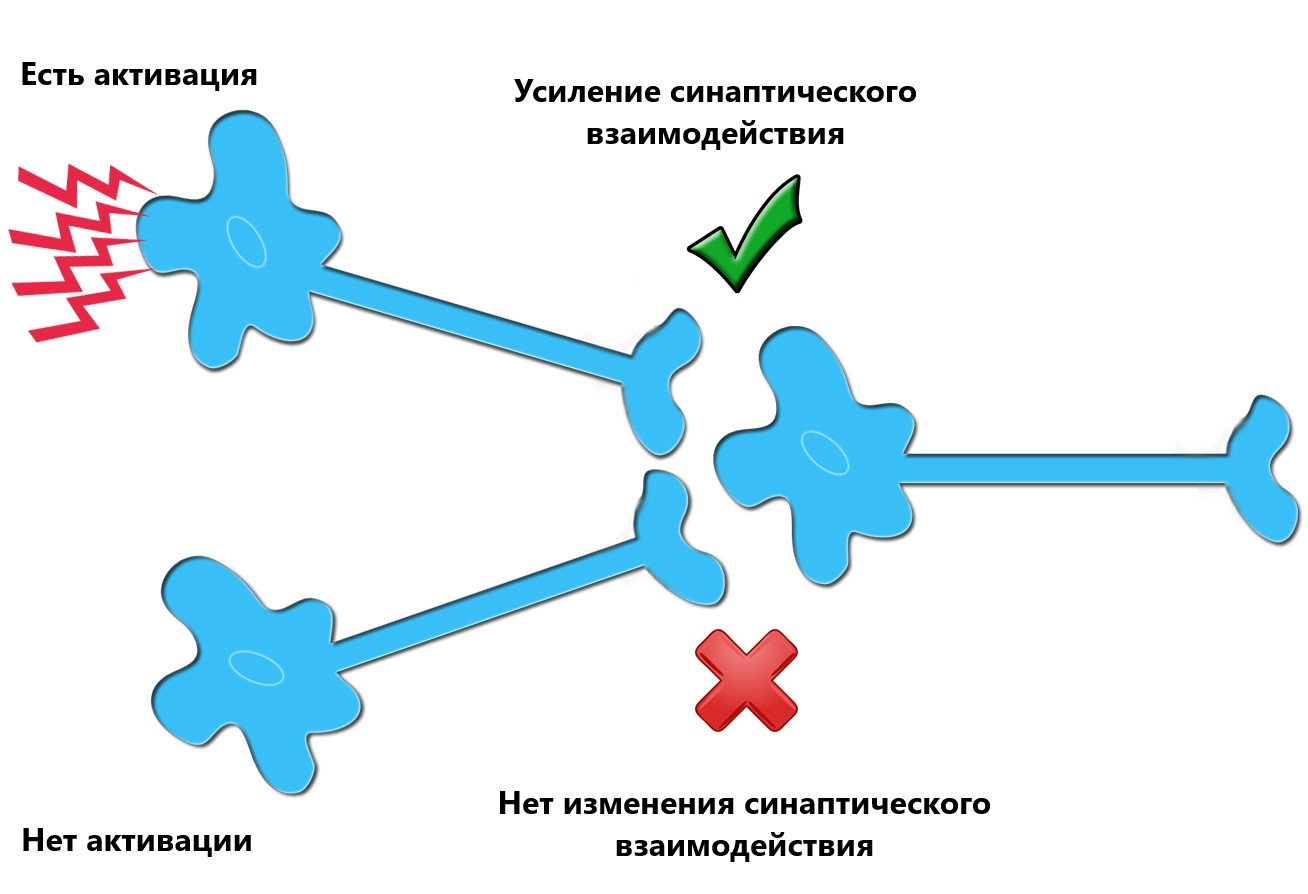
Данный механизм реабилитации может объяснить концепция пластичности Хебба: при одновременной активации двух связанных друг с другом нейронов усиливается их синаптическое взаимодействие, что приводит к более надёжному контакту между ними (рис. 6). Если предположить, что передача сигнала от моторной коры головного мозга к мышцам конечностей была нарушена из-за инсульта или травмы, то одновременная активация сенсорной и моторной коры может усиливать ранее неактивные контакты между нейронами за счет пластичности и таким образом вести к восстановлению двигательной функции конечностей [24].
Рисунок 6. Механизм пластичности Хебба. Усиление синаптического взаимодействия между двумя нейронами происходит из-за повторяющейся стимуляции постсинаптической клетки пресинаптической клеткой.
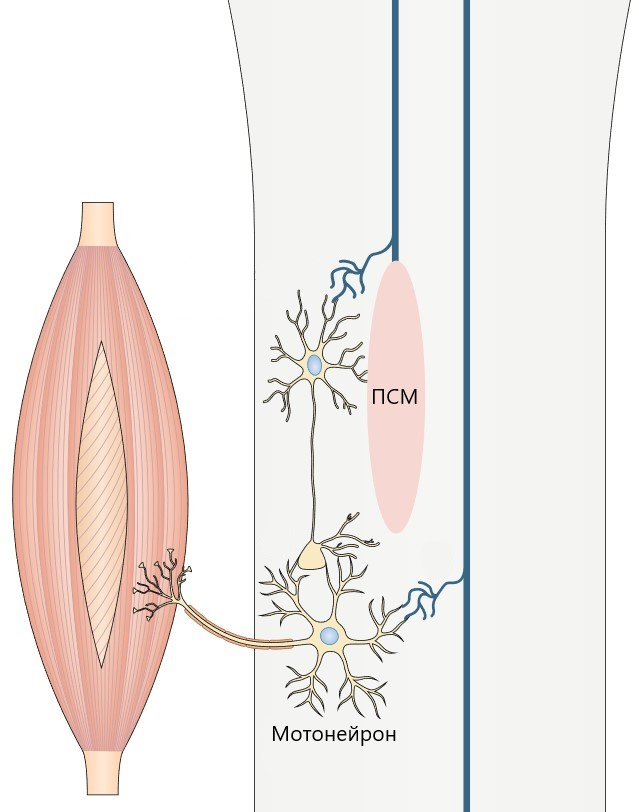
Рисунок 7. Образование новый нейронных связей в области повреждения спинного мозга (ПСМ).
При восстановлении двигательной функции после травмы спинного мозга задействованы те же механизмы нейропластичности. При таком повреждении часть нервных волокон, в том числе двигательных, оказывается прервана, что вызывает паралич конечностей, а часть сохраняет свою целостность. Благодаря этому при проведении нейрореабилитации существует возможность активации процессов нейропластичности: неповреждённые волокна образуют синаптические связи с двигательными нейронами (мотонейронами), которые, в свою очередь, передают сигнал мышцам (рис. 7) [25].
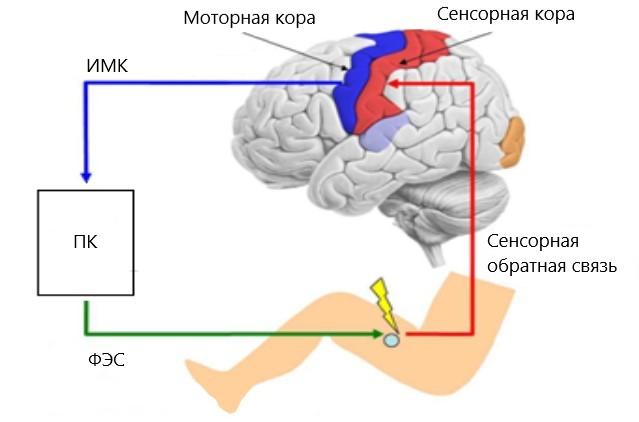
Для увеличения эффективности нейрореабилитации при помощи ИМК часто дополнительно используют функциональную электростимуляцию мышц (ФЭС). Она обеспечивает сокращение мышцы в тот момент, когда пользователь воображает движение с участием этой мышцы (рис. 8) [26]. Это приводит к усилению нейропластичности по механизму Хебба: происходит одновременная активация моторных областей головного мозга, передающих сигнал мотонейронам спинного мозга, и чувствительных нейронов, активируемых сокращающейся под влиянием ФЭС мышцей, что замыкает сенсомоторную петлю.
Рисунок 8. Система ИМК-ФЭС. При воображении движений сигнал из моторной коры обрабатывается компьютером (ПК) и передаётся к прибору функциональной электростимуляции (ФЭС), который вызывает сокращение соответствующей мышцы. Далее сигнал от мышцы передается в сенсорную кору, обеспечивая обратную связь.
Электростимуляция спинного мозга
В последние годы большую эффективность в нейрореабилитации после повреждения спинного мозга показала его электростимуляция (ЭССМ). Спинной мозг имеет два утолщения: в области шеи и поясницы, что соответствует месту выхода из них корешков двигательных нейронов верхних и нижних конечностей. В поясничном утолщении спинного мозга находятся специализированные нейронные сети, обеспечивающие автоматический процесс шагания (генераторы шагательных движений, ГШД). Иными словами, если наложить на твердую оболочку спинного мозга в месте поясничного утолщения электроды, подающие ток определенной амплитуды и частоты, можно вызвать непроизвольные шагательные движения даже у людей с параличом нижних конечностей [27]. Однако такой способ требует хирургического вмешательства, так что существует риск развития послеоперационных осложнений.
В настоящее время наиболее безопасной и безболезненной считается чрескожная электростимуляция спинного мозга (ЧЭССМ). На видео 1 (Edgerton Lab, University of California) можно видеть, как вызываются непроизвольные шагательные движения ног при облегченном положении больного, с подвешенными на рамах-качелях ногами [28].
Видео 1. Непроизвольная ходьба при чрескожной электростимуляции спинного мозга.
При использовании ЧЭССМ появляется вопрос правильного расположения стимулирующих электродов. Если при установке инвазивных электродов во время операции хорошо различимы сегменты и корешки спинного мозга, то при установке накожных электродов могут возникнуть затруднения с нахождением нужного участка. Данную задачу решают с помощью подачи одиночных импульсов на электрод и регистрации рефлекторных мышечных ответов — ведь каждому сегменту спинного мозга соответствуют строго определённые группы мышц.
Также существует проблема недостаточной амплитуды посылаемых импульсов — из-за дегенеративных процессов при повреждении спинного мозга требуется большая амплитуда стимуляции для получения нужного ответа. Однако это чревато получением ожогов. В нашей лаборатории было создано оптимальное устройство для неинвазивной электрической стимуляции спинного мозга [29].
Кроме того, была разработана система, детектирующая фазы шагательного цикла в онлайн-режиме и стимулирующая спинной мозг согласно этим фазам [30]. Во время ходьбы в разные моменты напрягаются разные мышцы, и под определёнными углами сгибаются суставы, что можно регистрировать специальными приборами — акселерометрами и гироскопами. Обе ноги движутся скоординировано, и на основании положения одной ноги можно предсказать положение другой. Принцип работы системы следующий: пациенту с гемипарезом на здоровую ногу накладываются датчики движения, которые передают сигнал к прибору для ЧЭССМ. Он, в свою очередь, стимулирует в определённые моменты времени группы мотонейронов спинного мозга, отвечающих за движение мышц-сгибателей и разгибателей ноги, что способствует нормализации ходьбы и восстановлению движения пораженной конечности.
Успехи современной нейрореабилитации
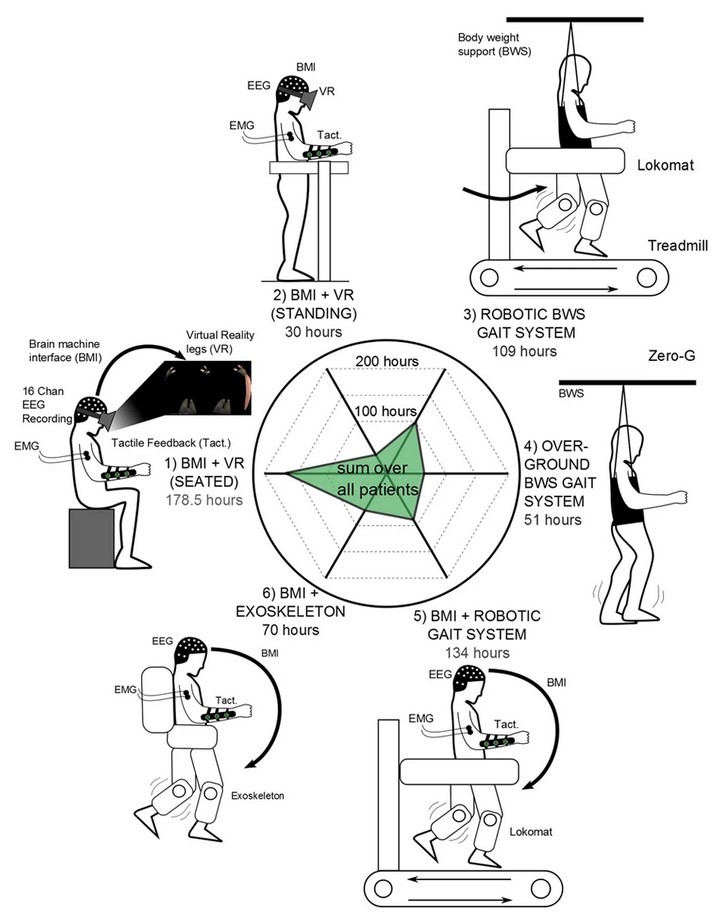
Самым масштабным исследованием в области нейрореабилитации с использованием ИМК, основанного на воображении движений, является работа Donati с соавторами, опубликованная в Nature в 2016 году [31]. В этом исследовании приняли участие восемь человек с параличом нижних конечностей, вызванным повреждением спинного мозга. Для них была разработана специальная система реабилитации, включающая в себя шесть этапов с увеличивающейся сложностью, и с каждым пациентом было проведено около 255 (!) сессий в течение года.
Первый этап включал в себя глубокое погружение в среду виртуальной реальности, во время которого испытуемый управлял перемещением своего аватара (компьютерного персонажа), воображая движение нижних конечностей в положении сидя. Затем пациент делал то же самое, только в положении стоя, с опорой на специальный стол. Во время третьего этапа проходили тренировки на беговой дорожке: испытуемый ходил с использованием прибора, поддерживающего вес тела (Lokomat). На четвёртом этапе осуществлялось движение ног уже в воздухе, а не по беговой дорожке. На пятом этапе пациент тренировался на беговой дорожке с помощью роботизированной системы, поддерживающей конечности и контролируемой ИМК. И на заключительной стадии испытуемый ходил в экзоскелете, управляемом ИМК: экзоскелет делал шаг, когда человек представлял себе движение соответствующей ноги. Во время всех тренингов испытуемые получали тактильную обратную связь — вибрацию, которая подавалась на предплечье, когда виртуальная или роботизированная нога с той же стороны касалась земли. Схему эксперимента вы можете увидеть на рисунке 9, а сам процесс реабилитации — на видео 2.
Рисунок 9. Схема эксперимента, включающая в себя шесть этапов: 1 — ИМК + виртуальная реальность (ВР) в положении сидя; 2 — ИМК + ВР в положении стоя; 3 — ходьба по беговой дорожке с поддержанием веса тела; 4 — движение ног в воздухе; 5 — ходьба по беговой дорожке с помощью роботизированной системы, контролируемой ИМК; 6 — ходьба в экзоскелете, управляемом ИМК. Обозначения: ЭЭГ — электроэнцефалография; ЭМГ — электромиография, регистрирующая активность мышц; Такт. — тактильная обратная связь.
Видео 2. Процесс проведения эксперимента.
Через 12 месяцев тренировок по этой системе у всех восьми пациентов повысились показатели по тактильным ощущениям, а также восстановился свободный контроль ключевых мышц нижних конечностей. В результате был виден заметный прогресс в их способности ходить. Многие пациенты смогли ходить при помощи вспомогательных приборов. Кроме этого, у всех пациентов было отмечено значительное повышение эмоциональной стабильности и оценки качества жизни, а также снизился уровень депрессивности и увеличилась самооценка. Улучшились состояние кожи и функция пищеварительной системы, что связано, по-видимому, с нормализацией активности симпатической и парасимпатической систем. Дело в том, что вдоль позвоночника расположены узлы вегетативной нервной системы, которая регулирует работу внутренних органов. Они повреждаются при травмировании спинного мозга, что вызывает нарушение деятельности пищеварительной системы, которая в свою очередь влияет на состояние кожи посредством выделения сигнальных молекул, в том числе и провоспалительных [32], [33].
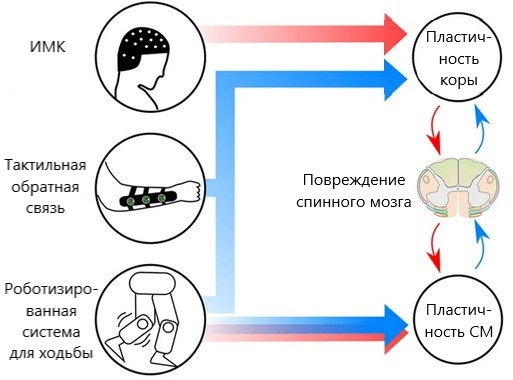
Неврологическое восстановление было связано с механизмами пластичности как на уровне спинного мозга, так и на уровне сенсомоторной коры. Кортикальная и спинномозговая пластичность изменяет нейронные связи в сохранившейся области спинного мозга при помощи моторных и сенсорных связей (рис. 10).
Рисунок 10. Пластичность спинного мозга (СМ) и коры головного мозга, осуществляющаяся с помощью моторных (красных) и сенсорных (синих) связей.
Заключение
Современная наука в области нейрореабилитации стремительно развивается и достигает удивительных результатов — в буквальном смысле ставит на ноги людей, ранее прикованных к кровати или инвалидной коляске. Появляются новые, более эффективные способы регистрации сигналов мозга; использование ИМК дополняется использованием обратной связи, ФЭС и ЧЭССМ; углубляются знания о механизмах нейропластичности; проводятся масштабные исследования в области разработки техник нейрореабилитации. Однако остается проблема доступности данных методов. Они очень дорогостоящие и доступны только в определённых клиниках; далеко не каждый может себе их позволить. В нашей лаборатории ведётся разработка нейрореабилитационных систем, которые просты в применении и по цене доступны для закупок в государственных бюджетных больницах.
Благодарности
Автор выражает благодарность своему научному руководителю Бобровой Елене Вадимовне, заведующему лабораторией Герасименко Юрию Петровичу и безвременно покинувшему нас в прошлом году Александру Алексеевичу Фролову (01.11.1943–10.06.2020) — одному из ведущих российских исследователей в области ИМК.
Мозг, общение нейронов и энергетическая эффективность
По всей видимости, в эволюции сформировались энергетически эффективные механизмы кодирования и передачи информации в мозге. Подпись: «Усердно пытаюсь минимизировать энергозатраты».
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
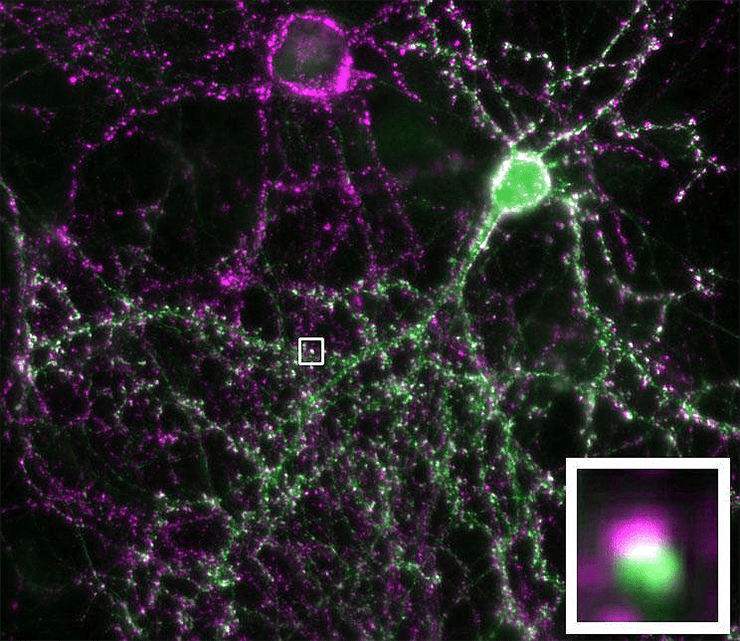
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
Интернейроны отличаются способностью генерировать значительно более высокочастотные сигналы, чем другие нейроны. Они также содержат больше митохондрий, главных органелл энергетического метаболизма, «фабрик» по производству АТФ. Последние к тому же содержат большое количество белков цитохром-с оксидазы и цитохрома-с, являющихся ключевыми для метаболизма. Так, интернейроны являются крайне важными и, в то же время, энергозатратными клетками [8], [9], [11], [16].
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Поиск оптимума
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
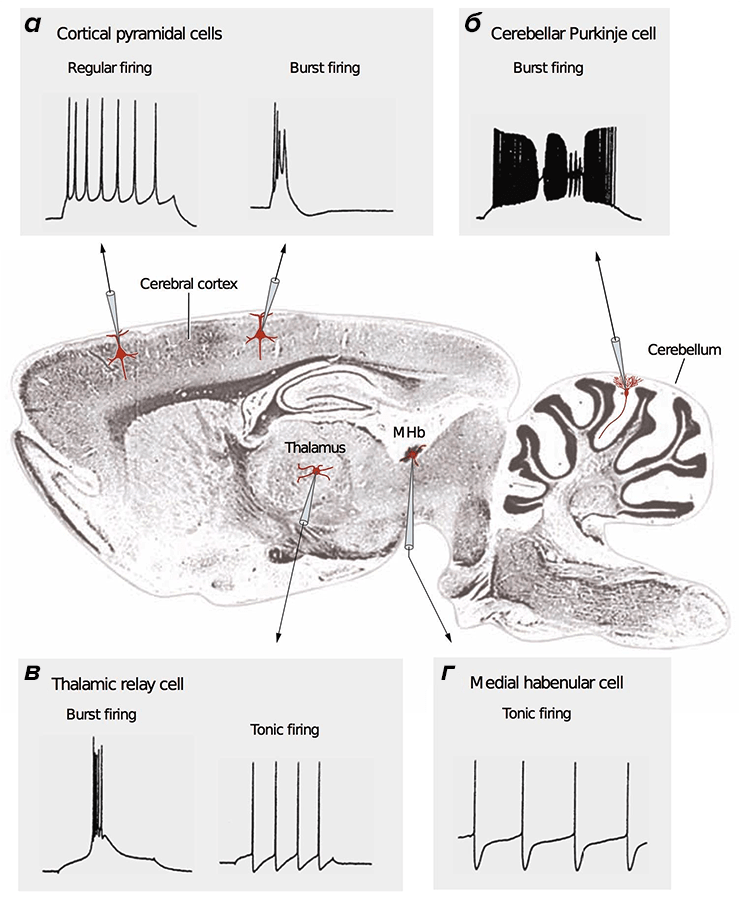
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Что такое потенциал действия?
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
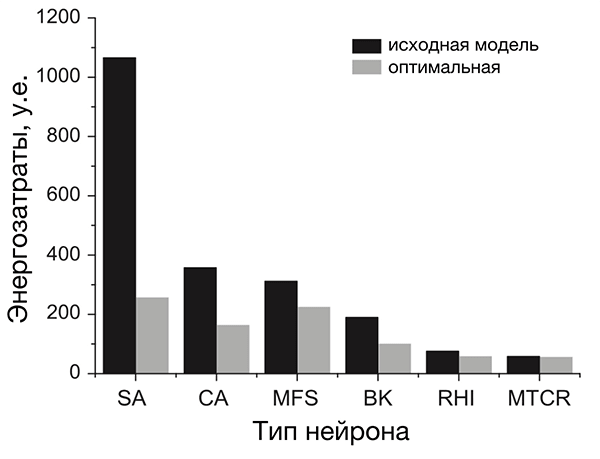
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
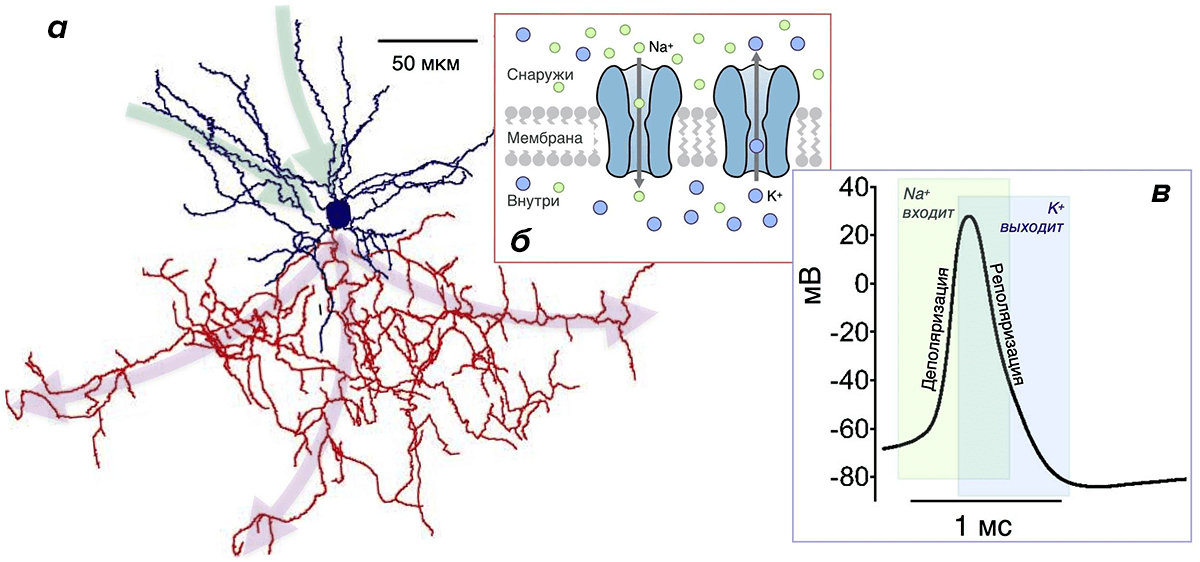
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает. «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.