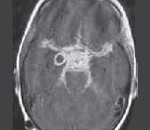
что такое пролапс хиазмальной цистерны
Оптико-хиазмальный арахноидит
Оптико-хиазмальный арахноидит – базальный менингоэнцефалит средней черепной ямки, при котором поражаются зрительные нервы и хиазма. Основные проявления патологии – боль в области глазницы, ухудшение зрения, общая слабость, повышенная зрительная утомляемость. Диагностика базируется на проведении офтальмоскопии, периметрии, визометрии, исследовании реакции зрачков на свет и краниографии. Консервативная терапия оптико-хиазмального арахноидита включает назначение антибиотиков, глюкокортикостероидов, антигистаминных средств, витаминов группы В и С. При низкой эффективности медикаментозного лечения осуществляется оперативное вмешательство.
Общие сведения
Оптико-хиазмальный арахноидит – наиболее распространённая форма воспаления паутинной оболочки, при которой патологический процесс локализируется в области основания головного мозга. Согласно статистическим данным, в 60-80% случаев причиной развития заболевания становится наличие хронических очагов инфекции в области придаточных синусов носа. В 10-15% установить этиологию болезни не удается, такие варианты рассматриваются как идиопатические. Ученые изучают роль аутоиммунных механизмов в возникновении арахноидита. Патология с одинаковой частотой встречается среди лиц мужского и женского пола. Базальный менингоэнцефалит распространён повсеместно.
Причины оптико-хиазмального арахноидита
Ведущее значение в развитии данной патологии отводится воспалению околоносовых пазух. Инфекционные агенты (вирусы, микроорганизмы) попадают в черепную коробку через естественные отверстия синусов. Реже появление симптомов оптико-хиазмального арахноидита связано с острым течением отита, мастоидита. Основные этиологические факторы болезни:
Патогенез
В основе механизма развития лежит воздействие инфекционного агента (чаще – вирусной природы) на мозговые оболочки. В первую очередь поражается паутинная оболочка, а следом за ней и мягкая. Изменения в структуре нервной ткани сильнее выражены в зоне хиазмы и прилежащих зрительных нервов. Из-за локального воспаления расширяются сосуды, увеличивается их проницаемость. Наблюдается повышенная экссудация и формирование клеточных инфильтратов в зоне оболочек мозга. Затем возникают циркуляторные расстройства, провоцирующие нарастание гипоксических проявлений и развитие аллергических реакций.
Со временем воспалительный процесс приводит к фибропластическим изменениям арахноидеи в области зрительного перекрёста и оптических нервов. Разрастание соединительной ткани обуславливает формирование обширных синехий между твёрдой и паутинной оболочками. Помимо фиброзных тяжей образуются кисты, полости которых заполнены серозным содержимым. Выделяют множественные мелкие или единичные крупные кистозные образования. Кисты могут окружать хиазму со всех сторон, приводить к сдавливанию зрительных нервов. Компрессия нервов является основной причиной их дегенеративно-дистрофических изменений, а в последующем – атрофии.
Классификация
Различают острое и хроническое течение заболевания. К хроническому варианту относят наследственную семейную атрофию зрительных нервов (амавроз Лебера). Прослеживается чёткая генетическая предрасположенность к развитию этой формы болезни. Согласно клинической классификации принято рассматривать 3 типа оптико-хиазмального арахноидита, в симптоматике которых доминируют следующие признаки:
Симптомы оптико-хиазмального арахноидита
Для патологии характерно острое начало. Пациенты предъявляют жалобы на двухстороннее ухудшение зрения, сильную головную боль, которая не купируется приемом анальгетиков. Возникает повышенная утомляемость при выполнении зрительных нагрузок (чтение книг, работа за компьютером, просмотр фильмов). Прогрессирование заболевания приводит к сильной боли в окологлазничной области, иррадиирующей в лоб, переносицу, надбровные зоны, виски. Болевой синдром может локализироваться непосредственно в орбите.
Больные отмечают, что острота зрения снижается очень быстро. При тяжелом течении зрительная дисфункция достигает максимума уже через несколько часов, но чаще этот процесс занимает 2-3 дня. Постепенно из зрительного поля выпадают отдельные участки. Зрачки могут быть разного размера. У пациентов страдает цветоощущение, особенно – восприятие красного и зеленого цвета. В этот временной промежуток могут возникать диспепсические расстройства (тошнота, рвота). В дальнейшем острый процесс сменяется хроническим. При сопутствующем поражении черепных нервов снижается обоняние. Из-за нарушения иннервации лицевого нерва визуализируется опущение латерального уголка глаза или рта.
При распространении зоны поражения на гипоталамическую область больные страдают частыми вегетососудистыми кризами, нарушается терморегуляция, наблюдаются судорожные подергивания мышц. Отмечается повышенная потливость, жажда, субфебрилитет, нарушения сна. В отличие от острого процесса, при хроническом течении патологии симптоматика нарастает постепенно. Некоторые пациенты отмечают, что после проведения диагностической цистернографии зрение восстанавливается на короткий промежуток времени.
Осложнения
Распространённое осложнение патологии – атрофия зрительного нерва. У больных существует высокая вероятность дислокации структур головного мозга. При увеличении кистозных образований наблюдается компрессия мозговой ткани и очаговая симптоматика. Распространение патологического процесса на другие оболочки мозга становится причиной менингита, менингоэнцефалита. При осложненном течении возможно формирование внутричерепных абсцессов. При вторичном поражении желудочков мозга возникает вентрикулит. Пациенты входят в группу риска развития острого нарушения мозгового кровообращения.
Диагностика
На ранних стадиях постановка диагноза затруднена. Поскольку наиболее частой причиной патологии является поражение околоносовых синусов, на этапе первичной диагностики проводится рентгенография. Для большей информативности выполняется МРТ пазух. При этом удаётся выявить небольшую пристеночную отечность слизистой оболочки клиновидного синуса и поражение задних ячеек решетчатого лабиринта. Инструментальные методы диагностики включают:
При односторонней форме патологии обследование пациента необходимо повторить через 1-2 недели из-за высокого риска отсроченного поражения второго глаза. Также для болезни характерно явление «мигрирующих дефектов», при котором отельные изменения поля зрения определяются в других участках.
Лечение оптико-хиазмального арахноидита
При остром течении болезни назначается медикаментозное лечение. Продолжительность консервативной терапии составляет 3-6 месяцев. После купирования острого процесса показана физиотерапия. При помощи электрофореза вводятся препараты кальция, витамин РР. Эффективно применение иглорефлексотерапии продолжительностью 10 сеансов. Для устранения симптоматики оптико-хиазмального арахноидита назначают:
При отсутствии эффекта от медикаментозной терапии показано проведение люмбальной пункции с введением кислорода в оптико-хиазмальную цистерну. Цель данной манипуляции – разрушить соединительнотканные сращения. Хирургическое лечение арахноидита сводится к рассечению спаек и удалению кист в области хиазмальной цистерны и у основания мозга. Оперативное вмешательство противопоказано при менингеальной симптоматике, плеоцитозе или признаках отека ДЗН. С целью профилактики рецидива заболевания в послеоперационном периоде назначается противовоспалительная терапия. Для контроля эффективности лечения выполняют спинномозговую пункцию. Лечение проводится совместно офтальмологом и неврологом. Требуется консультация нейрохирурга.
Прогноз и профилактика
Исход оптико-хиазмального арахноидита определяется степенью тяжести и характером течения заболевания. При лёгком течении болезни прогноз благоприятный, поскольку зрительные нарушения мало выражены. Прогрессирование патологии может привести к стойкой потере зрения. Специфические профилактические меры не разработаны. Неспецифическая профилактика направлена на своевременное лечение инфекций головного мозга и воспаления околоносовых синусов. При возникновении симптоматики в отдаленном периоде после ЧМТ пациент должен состоять на диспансерном учете у невропатолога.
«Пустое» турецкое седло: этиология, патогенез, нейроэндокринные и зрительные нарушения
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
«Empty» turkish saddle: etiology, pathogenesis, neuroendocrinous and visual infringements
L.N. Samsonova, A.V. Svirin
In article authors cite the literature devoted to the analysis of etiology, diagnostics, pathogenesis and visual infringements of suprasellar cistern invading into the cavity of a turkish saddle.
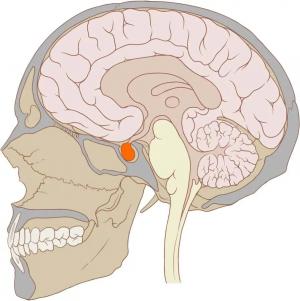
Под термином синдром «пустого» турецкого седла (ПТС) следует понимать пролабирование супраселлярной цистерны в полость турецкого седла, сопровождающееся клинической картиной головной боли, нейроэндокринных и зрительных расстройств [3,13,22].
Единство нейрогуморальной регуляции в организме человека обеспечивается гипоталамо–гипофизарой системой, в тесной анатомической связи с которой находятся зрительные нервы и хиазма. Развитие конфликта в хиазмально–гипоталамо–гипофизарной области приводит к нарушениям зрения [21,36].
Словосочетание «пустое» турецкое седло ввел в медицину W. Busch в 1951 году. Он был первым, кто связал частично «пустое» турецкое седло с недостаточностью диафрагмы, и им же была предложена классификация форм турецкого седла в зависимости от объема интраселлярных цистерн и типа строения диафрагмы [11,20,22,25].
По данным Busch, у 40–50% людей имеет место недоразвитие или отсутствие диафрагмы турецкого седла. Клинические симптомы, ассоциированные с «пустым» седлом, впервые описал в 1968 г. N Guiot [36]. Встречаются они значительно реже (по данным различных авторов, от 10 до 23% от группы нейроэндокринных больных) [3, 19].
Weiss и Raskin указали на необходимость разграничения первичного (идиопатического) ПТС и вторичного (после лучевого и хирургического лечения) [20,21,22].
Анатомия турецкого седла
Вход в турецкое седло прикрывает твердая мозговая оболочка, называемая диафрагмой седла (рис. 1). Диафрагма отделяет полость турецкого седла и гипофиз от субарахноидального пространства, исключая лишь отверстие, через которое проходит ножка (воронка) гипофиза. Прикрепление диафрагмы, ее толщина и характер отверстия подвержены значительным анатомическим вариациям [6,20,22, 23,37]. Диафрагма может быть недоразвитой, с резко увеличенным отверстием, через которое в полость седла в разной степени внедряется супраселлярная цистерна [3,7,12,20,38,41]. «Пустое» турецкое седло не следует понимать буквально: оно заполнено ликвором, гипофизарной тканью, иногда в него могут «провисать» хиазма и зрительные нервы [6,41].
В 80% случаев встречается переднее пролабирование супраселлярной цистерны [7,41] (рис. 2).
Этиология и патогенез ПТС
Паутинная оболочка пролабирует в полость турецкого седла через отверстие в диафрагме в том случае, если размер последнего превышает 5 мм [22,25,34,41]. Недостаточность диафрагмы является обязательным условием формирования ПТС.
В настоящее время известен широкий спектр патологических и физиологических факторов, способствующих развитию «пустого» турецкого седла:
– повышение внутричерепного давления вследствие легочно–сердечной недостаточности, артериальной гипертензии, черепно–мозговой травмы;
– локальное повышение давления в желудочках при опухолях головного мозга, тромбозе синусов;
– физиологические процессы (беременность, роды, климакс);
– первичная гипофункция периферических эндокринных желез, длительный прием оральных контрацептивов;
– арахноидальные кисты, развившиеся в результате оптико–хиазмального арахноидита;
– спонтанный некроз аденомы гипофиза, инфаркт гипофиза;
– инфекционные заболевания с тяжелым течением (менингит, геморрагическая лихорадка);
– аутоиммунные заболевания (аутоиммунный тиреоидит, болезнь Шегрена, лимфоцитарный аденогипофизит);
– наследственная неполноценность соединительной ткани (наличие ПТС у родителей и детей).
Таким образом, установлено, что для формирования «пустого» турецкого седла необходимо два условия: недостаточность диафрагмы и внутричерепная гипертензия, остальные факторы лишь способствуют его развитию [1,20,22,29,34].
Клиника синдрома ПТС
Клиническая картина отличается динамичностью, сменяемостью одного синдрома другим, спонтанными ремиссиями [2,3,22,].
Чаще болеют женщины (4/5) в возрасте от 35 до 55 лет. Около 75% больных страдают ожирением [13,22,29,36].
Самым частым симптомом является головная боль (80–90%), не имеющая четкой локализации и варьирующая от легкой до нестерпимой, почти постоянной [2,13,8,22,26]. Дисфункция гипоталамуса выражается вегетативными синдромами и вегетативными кризами с ознобом, резким подъемом артериального давления, кардиалгиями, одышкой, чувством страха, болями в животе, в конечностях, подъемом температуры, нередко синкопальными состояниями [2,8,22,32]. Наряду с вегетативными нарушениями больные с синдромом ПТС подвержены эмоционально–личностным и мотивационным расстройствам. Клиническая симптоматика и течение болезни усугубляются в связи с острой или хронической стрессовой ситуацией [3,5].
Эндокринные симптомы при ПТС обусловлены нарушением тропной функции гипофиза, проявляются в виде гипо– или гиперсекреции и варьируют по степени тяжести: от субклинических форм до тяжелых. [1,12,13, 20,22, 24,33]. Per Bjerre отмечает, что гипофизарные нарушения при синдроме ПТС аналогичны изменениям при аденоме гипофиза и часто имеет место сочетание ПТС с микроаденомами [22]. Гипотиреоз, гиперпролактинемия и половые нарушения (снижении потенции, либидо, олиго– и аменорея) наиболее характерны для больных этой группы [21,31,37]. Brismar обнаружил ПТС у больных с болезнью Иценко–Кушинга, Dominique сообщил о наличии ПТС у 10% больных акромегалией [7,13,22,37].
Причиной эндокринных расстройств при ПТС принято считать не компрессию секреторных клеток гипофиза, которые продолжают функционировать даже при значительной гипоплазии, а нарушение гипоталамического контроля над гипофизом в результате затруднения поступления нейрогормонов гипоталамуса [3,6,29,35,36,39].
Зрительные нарушения при синдроме ПТС
Изменения со стороны зрительной системы различны по характеру и степени выраженности [1,5,8,19,20,22,32]. Чаще всего больных беспокоят ретробульбарные боли, сопровождаемые слезотечением, хемозом, диплопией, фотопсиями, «затуманиванием» [32,38].
Снижение остроты зрения, изменения полей зрения, отек и гиперемия диска зрительного нерва (ДЗН), выявляемые при обследовании, подвержены колебаниям и зависят от ликвороциркуляции в арахноидальных пространствах и кровоснабжения хиазмально–зрительного пути [5,8,38].
По данным Obrador S., из 19 пациентов с синдромом ПТС у 7 зрительные расстройства выражались только субъективными симптомами (неясное зрение, диплопии, фотопсии), у 3 офтальмоскопически определялся двусторонний отек ДЗН, у 2 при периметрии выявлены гемианопсии без очевидной причины. 7 пациентов с ПТС не имели зрительных нарушений [38].
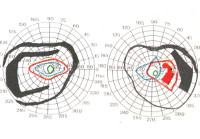
Для синдрома ПТС характерны дефекты полей зрения. Чаще встречаются битемпоральные гемианопсии, центральные и парацентральные скотомы, реже – квадрантные и биназальные гемианопсии [1,19,20,27,29,36].
Bosman and Bergstrand обнаружили дефекты полей зрения у 10 из 48 пациентов с ПТС, Jaja–Albarran у 6 из 41, Per Bjerre у 3 из 20, Mortara and Non–ell у 4 из 7 [22,24,33].
Сформированы две патогенетические концепции нарушения полей зрения при ПТС: тракционная и ишемическая. Согласно первой концепции, к дефектам в полях зрения может привести натяжение между хиазмой и передним краем диафрагмы (при смещении последней в полость турецкого седла) а также натяжение между хиазмой и ножкой гипофиза (при смещении ножки назад и в сторону). В качестве второй – ишемической–теории рассматриваются варианты сдавления глазничной артерии в субарахноидальном пространстве, окружающем зрительный нерв, и ухудшения кровоснабжения самой хиазмы и зрительного нерва при удалении их от каротидного бассейна [27,29,36].
Биназальные и квадрантные гемианопсии подобны изменениям полей зрения при первичной открытоугольной глаукоме. Дифференциальная диагностика в этих случаях трудна, но имеет важное значение, т.к. глаукома с низким давлением не является редкостью и требует особого внимания офтальмолога [1,20,40,43]. Имеются данные о нередком сочетании ПТС с глаукомой.
Beattie у 8 пациентов с глаукомой обнаружила синдром ПТС: 3 имели глаукому с низким давлением, 4– типичную открытоугольную глаукому и 1– неоваскулярную глаукому. Глаукоматозная экскавация ДЗН была выявлена стереоскопической дискоскопией и подтверждена стереофотографией. Больные в течение 5 лет получали местную гипотензивную терапию с положительным эффектом: глаукома имела стабильное течение без прогрессирования дефектов полей зрения [20].
Существует иная точка зрения на эту проблему. Berke, Neelon, Yamayashi также описывают случаи глаукомы с низким давлением в сочетании с ПТС и высказывают предположение о наличии у этих больных «псевдоглаукомы» [20,37,43]. Однако Rouhiainen, исследуя 15 пациентов с глаукомой низкого давления, имеющих синдром ПТС, пришел к выводу, что все же более правильным следует считать совпадение синдрома ПТС с глаукомой [40].
Вегетативные кризы, характерные для синдрома ПТС, усугубляют ситуацию и могут привести к нарушению кровообращения в центральной артерии сетчатки (ЦАС). Как правило, эти нарушения встречаются у молодых женщин, страдающих ожирением и эндокринными расстройствами [19,29].
Синдром ПТС выявляется у 10% больных с доброкачественной внутричерепной гипертензией (ДВГ), главными клиническими симптомами которой также являются головная боль и отек зрительного нерва [5,8,22,23]. Причина ДВГ остается неясной. Наиболее частым этиологическим фактором считают эндокринные нарушения: ожирение, гипо– и гипертиреоз, галакторея–аменорея, беременность, климакс. Per Bjerre сообщает о случаях внезапной потери зрения у пациентов с ДВГ, причиной которой является усиление отека зрительных нервов и сдавление их в оптическом канале [22,23]. Взаимосвязь ПТС и доброкачественной внутричерепной гипертензии, вероятно, бывает двоякой [22].
Офтальмологическое обследование у пациентов с синдромом ПТС имеет исключительную важность для диагностики заболевания и выбора тактики лечения. Угроза потери зрения является показанием для хирургического вмешательства [3 6].
Инструментальная диагностика ПТС
До последнего времени в диагностике «пустого» турецкого седла использовались лучевые методы исследования: краниография, пневмоцистернография и компьютерная томография, которые были недостаточно информативны и безопасны [22,24,33].
Безопасным и высокочувствительным методом визуализации хиазмально–селлярной области в настоящее время является магнитно–резонансная томография (МРТ) [6,38,41].
МРТ позволяет проводить исследования в любой плоскости тонкими срезами в 1–1,5 мм, обладает высоким тканевым контрастом, отсутствием артефактов от костных структур черепа.
Для ПТС характерна триада симптомов:
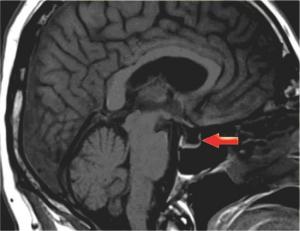
• первый симптом – наличие цереброспинальной жидкости в полости турецкого седла, о чем свидетельствуют зоны однородного низкоинтенсивного сигнала в режиме T1W и высокоинтенсивного сигнала в режиме T2W, гипофиз при этом деформирован, имеет форму серпа или полулуния толщиной до 2–4 мм, ткань его изоинтенсивна белому веществу мозга, воронка, как правило, расположена центрально;
• второй – асимметричное пролабирование супраселлярной цистерны в полость седла, смещении воронки кпереди, кзади или латерально;
• третий – истончение и удлинение воронки гипофиза.
Помимо основных изменений в параселлярной области МРТ позволяет выявить косвенные признаки внутричерепной гипертензии (расширение желудочков и ликворосодержащих пространств), сопутствующие этой патологии.
Имеются данные о почти 100% чувствительности МРТ в диагностике синдрома ПТС [7,10,38,41].
Лабораторная диагностика
Основана на определении тропных гормонов гипофиза, но нет определенности и стабильности в этих показателях, что также характерно для ПТС [1,13,20,33].
Таким образом, синдром ПТС представляет собой симптомокомплекс нейроэндокринных и зрительных расстройств, по клинической картине схожий с аденомой гипофиза. Этиологию и патогенез синдрома определяют врожденная недостаточность диафрагмы, повышенное внутричерепное давление и ряд сопутствующих факторов. Причиной нейроэндокринных расстройств принято считать не компрессию секреторных клеток гипофиза, а сдавление его ножки, что приводит к нарушению гипоталамического контроля над гипофизом.
Зрительные расстройства представлены субъективными жалобами, дефектами в полях зрения и ухудшением остроты зрения, обусловлены они как повышенным давлением в субарахноидальном пространстве, окружающем зрительный нерв, так и ишемией хиазмально–зрительной системы. Офтальмоскопические изменения при синдроме ПТС выражаются гиперемией и отеком зрительного нерва, но могут быть представлены атрофией ДЗН с типичной глаукоматозной экскавацией. Отмечено сочетание синдрома ПТС с глаукомой.
Клиническое течение синдрома рецидивирующее, обусловлено степенью эндокринных, неврологических и зрительных нарушений. Как правило, болезнь протекает благоприятно при ранней диагностике и адекватной симптоматической терапии. Тяжелые прогрессирующие зрительные нарушения являются показаниями для хирургического лечения.
Синдром «пустого турецкого седла» — что это за болезнь и чем опасна?
Термин «пустое турецкое седло» предложил патологоанатом В. Буш в 1951 году, из-за внешней формы клиновидной кости, которая напоминает реквизит для верховой езды. Это заболевание означает нарушение в области головного мозга, а конкретней, где располагается гипофиз, мешая ему функционировать. В последнее время диагноз стал очень распространенным, ввиду приобретения большой популярности магнитно-резонансной томографии. И многие люди, услышав диагноз, пребывают в полном недоумении: что это такое турецкое седло и чем оно опасно?
Что это такое?
При нормальном функционировании гипофиз заполняет все пространство седла. А если произошли какие-либо сбои, то оболочка головного мозга, опускаясь, начинает давить на содержимое полости. Например, если по каким-то причинам диафрагма недоразвита или истончена, или имеет слишком широкий диаметр отверстия для ножки, тогда спинномозговая жидкость и мягкая мозговая оболочка беспрепятственно попадают в полость турецкого седла, и осуществляют давление непосредственно на гипофиз. В результате он как бы распластан по дну седла, таким образом, формируется пустое турецкое седло.
Иногда в медицинской практике встречается, что диафрагма турецкого седла недоразвита, а синдрома турецкого седла нет. Поэтому ученые пришли к выводу, что для возникновения синдрома необходима внутричерепная гипертензия. В этом случае, ликвор заполняет не только все пространство седла, оказывая давление на гипофиз, но и на его ножку. Все это вызывает сбои регуляции гипоталамуса и вызывает проблемы с эндокринной системой.
Виды патологии
По статистическим данным синдром пустого турецкого седла диагностируется у каждого десятого. Чаще всего этим недугом страдают женщины после 35 лет с лишним весом. Это связано с более активным функционированием гипофиза в некоторых периодах их жизни (беременность, климакс).
Синдром пустого турецкого седла классифицируют по двум видам:
Предрасположенность к данному заболеванию может быть как наследственная, так и по ряду других причин.
Записаться на МРТ
Запишитесь на приём и получите качественное обследование головы в нашем центре
Причины пустого турецкого седла
Симптомы пустого турецкого седла
Синдром пустого турецкого седла проявляется сбоями в эндокринной и нервной системе, нарушениями в функционировании органов зрения.
Во время стрессовых ситуаций повсеместно проявляются неврологические симптомы:
Пустое турецкое седло головного мозга способно проявлять себя нарушениями в эндокринной системе, а именно:
Турецкое седло находится вблизи зрительных нервов. При наличии синдрома они сдавливаются, тем самым нарушается их кровообращение. Поэтому зрительные симптомы встречаются почти абсолютно во всех случаях заболевания. Симптомы в этой ситуации:
В большинстве случаев вышеперечисленные симптомы имеют много других заболеваний. Выявить турецкое седло в головном мозге можно только после консультации со специалистом и после обследования.
Получить бесплатную консультацию
Консультация по услуге ни к чему Вас не обязывает
Диагностика синдрома
Процедура постановки диагноза проходит в три этапа:
Очень часто пустое турецкое седло обнаруживают совершенно случайно, в целях выявления синуситов или форм черепно-мозговых повреждений.
К какому врачу идти?
Если наблюдаются продолжительные головные боли, набор лишнего веса, гипертония следует обратиться к неврологу.
Если заметили ухудшение зрения, нужна консультация офтальмолога, чтобы он исключил или подтвердил поражение зрительных нервов.
И обязательна консультация эндокринолога, и в дальнейшем исследование гормонального фона.
Получить бесплатную консультацию
Консультация по услуге ни к чему Вас не обязывает
Лечение
Для тех, кого тревожат боли и плохое самочувствие назначают лечение, которое снижает симптоматические последствия:
Хирургическое лечение требуется редко. И тогда не обойтись без нейрохирурга. Показания к оперативному вмешательству:
Лечение народными средствами крайне неэффективно. Зачастую необходимо просто устранить некоторые факторы риска: ожирение, прием гормональных контрацептивов. Самая лучшая профилактика заболевания — здоровый образ жизни.
Прогноз
Спрогнозировать течение болезни невозможно. Все зависит от течения СПТС, сопутствующих заболеваний и самого состояния железы. Постоянный контроль уровня гормонов, чтобы вовремя исключить осложнения. Заниматься укреплением здоровья, чтобы помочь организму бороться с болезнями.
Синдром пустого турецкого седла – патология с непредсказуемым течением. Она может на протяжении всей жизни никак себя не проявить, а может стать причиной множества серьезных эндокринных расстройств. Подбор терапии также может быть абсолютно разный: либо принцип невмешательства с обычным наблюдением, либо хирургическое вмешательство с непредвиденными последствиями.