что такое преднагрузка и постнагрузка на сердце
Что такое преднагрузка и постнагрузка на сердце
Сердечно-сосудистая недостаточность, обусловленная снижением постнагрузки, является разновидностью дистрибутивного шока. К нему также относят септический, нейрогенный и анафилактический шоки. Постнагрузка — это сила, противодействующая сокращению желудочков.
Подобно преднагрузке, понятие о постнагрузке появилось в ходе экспериментов с использованием мышечных волокон. Суть экспериментов заключается в том, что мышце дают определенную нагрузку (постнагрузку), в то время как ее длина остается постоянной. В результате данных исследований было установлено, что увеличение постнагрузки уменьшает скорость и силу сокращения.
Клинически показатель сосудистого импеданса наиболее точно отражает постнагрузку на желудочек. К сожалению, расчет сосудистого импеданса не относится к рутинным методам оценки постнагрузки. В практике используют показатель системного сосудистого сопротивления (ССС), который позволяет косвенно оценить постнагрузку. Системное сосудистое сопротивление рассчитывают при помощи гемодинамического аналога закона Ома:
ССС = (САД — ЦВД) / СВ, где
САД — среднее артериальное давление, ЦВД — центральное венозное давление, СВ — сердечный выброс.
Данное уравнение позволяет с приближением оценить сосудистый импеданс при условии непульсирующего потока. Таким образом, измерение постнагрузки или ССС с использованием данных, полученных при помощи катетера Свана-Ганца, позволяет получить расчетные значения.
Наконец, поскольку показатель сердечно-сосудистой системы обратно пропорционален сердечному выбросу, прежде чем воздействовать на высокий ССС необходимо увеличить сердечный выброс путем восполнения объема циркулирующей жидкости. Восполнение ОЦЖ увеличит преднагрузку, и соответственно сердечный выброс, при этом системное сосудистое сопротивление снизится.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое преднагрузка и постнагрузка на сердце
ПЭТ применяют для неинвазивного определения миокардиальной перфузии и миокардиального метаболизма. Используемые радиоактивные индикаторы маркированы позитронно-активными изотопами, имеющими химические и физические свойства, идентичные естественным свойствам таких элементов, как углерод, кислород, азот и фтор. Изображение получают посредством расположенных по окружности ПЭТ-датчиков (как в КТ-сканерах). Данные отображаются в виде томограмм по горизонтальной и вертикальной осям.
Количественно оценить миокардиальную перфузию можно, используя такие рибонуклеопротеины, как рубидий или аммоний. Миокардиальный метаболизм можно исследовать с помощью пальмитата для оценки обмена ЖК или фтор-2-дезоксиглюкозы для оценки жизнеспособности миокарда.
Оценка миокардиального кровотока важна для визуализации ИМ и его размера, а также для отображения стресс-индуцированной ишемии миокарда. Исследования миокардиальной перфузии используют в диагностических целях для подтверждения ИБС как причины СН. Пациентам с нарушениями кровотока могут быть выполнены коронарная ангиография и реваскуляризация миокарда для улучшения функции сердца.
Оценка жизнеспособности миокарда у пациентов с СН важна в терапевтических целях. Накопление глюкозы свидетельствует о возможности проведения коронарной реваскуляризации, тогда как отсутствие накопления глюкозы указывает на нежизнеспособную ткань без перспективы восстановления функции сердца. Для таких пациентов показана трансплантация сердца, а не миокардиальная реваскуляризация посредством чрескожного коронарного вмешательства (ЧKB) или КШ.
Преднагрузка и постнагрузка при сердечной недостаточности
Основная задача кровеносной системы — снабжение периферических органов достаточным количеством крови, насыщенной кислородом. Работа сердца зависит от свойств миокарда, влияний нейрогуморальных факторов, ОЦК, а также податливости и сопротивления периферических сосудов.
Важным показателем работы сердца является систолическая функция ЛЖ, которая, в свою очередь, зависит от пред- и постнагрузки, сократимости миокарда и ЧСС. Эти четыре показателя позволяют сердцу менять свою работу в соответствии с потребностями периферических органов, а также компенсировать потерю массы и/или функции миокарда, например, при СН. Работу сердца оценивают прежде всего по состоянию систолической функции ЛЖ. Начало систолы инициируется развитием деполяризации, затем следует мышечное сокращение, и заканчивается систола после прекращения этого сокращения.
Преднагрузка. Растяжение отдельных саркомеров регулирует работу сердца. Как считали физиологи XIX в., преднагрузка является свойством сердечной мышцы: «чем больший объем крови поступит в желудочки, тем больший объем будет из них выброшен». Косвенными показателями уровня растяжения саркомера в начале сокращения являются конечный диастолический объем желудочка, диаметр и давление.
Постнагрузка. Это сила, которую нужно преодолеть сокращающейся мышце. Значительно сложнее рассчитать постнагрузку в общей системе циркуляции крови, чем в изолированном сердце. Существует два подхода в определении постнагрузки. Первый подход рассматривает сосудистую нагрузку, которая определяется периферическим сосудистым сопротивлением или полным сопротивлением, оказывающим более сложное воздействие (см. далее), с включением пульсовой нагрузки. При втором подходе рассматривается напряжение стенки желудочка, а давление и размер полости рассчитывают по более сложной формуле — закону Laplace, в котором говорится, что напряжение стенки зависит от давления и радиуса, в то время как сила (или напряжение) единицы мышцы дается в трех измерениях — циркулярном, меридиональном и радиальном.
Что такое преднагрузка и постнагрузка на сердце
Оценивая сократительные свойства мышцы, очень важно определить степень напряжения мышцы перед началом сокращения (так называемую преднагрузку), а также нагрузку, которую мышце предстоит преодолеть, развивая сокращение (так называемую постнагрузку).
Для сердца преднагрузка определяется величиной конечно-диастолического давления, когда наполнение желудочков кровью завершилось.
Постнагрузка желудочка определяется величиной давления в артерии, берущей начало от данного желудочка. На рисунке это соответствует систолическому давлению во время фазы III диаграммы «объем-давление». (Иногда постнагрузка несколько вольно определяется как сосудистое сопротивление, а не давление в сосудах.)
Понятия преднагрузки и постнагрузки имеют большое практическое значение: нарушение функции сердечно-сосудистой системы может протекать с резкими изменениями как преднагрузки или постнагрузки, так и обоих этих факторов одновременно.
Потребление кислорода сердцем. Сердечная мышца, так же как и скелетная мышца, использует химическую энергию для сократительной деятельности. Энергия освобождается главным образом при окислении жирных кислот и в меньшей степени — при окислении других субстратов, таких как лактат и глюкоза. Таким образом, уровень потребления кислорода сердечной мышцей является основным показателем энергетического обеспечения деятельности сердца.
Эффективность сердечных сокращений. В процессе сокращения сердечной мышцы большая часть освободившейся химической энергии превращается в тепло, а меньшая часть энергии затрачивается на совершение работы. Отношение рабочих энерготрат к общему количеству выделенной энергии характеризует эффективность сердечных сокращений, или коэффициент полезного действия сердца. КПД сердца здоровых людей составляет примерно 20-25%. В случае сердечной недостаточности этот показатель может уменьшаться до 5-10%.
В условиях покоя сердце перекачивает от 4 до 6 л крови в минуту. При тяжелой физической нагрузке сердцу необходимо перекачивать в 4-7 раз больше крови, чем в покое. Такому усилению сердечной деятельности способствуют: (1) внутрисердечные механизмы, регулирующие насосную функцию в зависимости от объема притекающей к сердцу крови; (2) центральные нервные механизмы, контролирующие частоту и силу сердечных сокращений с участием автономной (вегетативной) нервной системы.
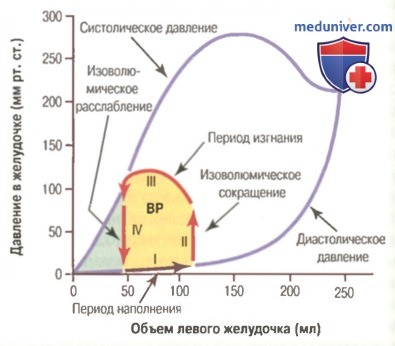
Красными стрелками показана рабочая диаграмма «объем-давление» (изменение внутрижелудочкового объема и давления в течение сердечного цикла).
ВР — внешняя работа.
Механизм Франка-Старлинга
Нам известно, что в разных ситуациях объем крови, который сердце перекачивает за минуту, почти полностью определяется венозным возвратом, т.е. объемом крови, поступающим в сердце из вен. Это можно объяснить следующим образом: кровоток каждого отдельного органа контролируется местными механизмами в зависимости от метаболических потребностей данного органа; кровь, оттекающая от отдельных органов, сливается в общую венозную систему и поступает к сердцу; сердце, в свою очередь, автоматически перекачивает всю поступившую к нему кровь в артериальное русло, снабжая периферические органы, и т.д.
Способность сердца адаптироваться к увеличению объема поступающей к нему крови называют внутрисердечным механизмом Франка—Старлинга, названным в честь выдающихся физиологов прошлого века. Суть механизма в следующем: чем больше степень растяжения миокарда объемом притекающей крови, тем больше сила сокращения сердечной мышцы и, следовательно, тем больше объем крови, который сердце перекачивает в аорту. Другими словами, в физиологических пределах сердце перекачивает всю кровь, которая возвращается к нему по венам.
Как объяснить механизм Франка-Старлинга? Когда избыточный объем крови поступает в желудочки, волокна сердечной мышцы растягиваются. Нити актина и миозина в миофибриллах занимают положение, близкое к оптимальному для развития большей силы сокращения. Таким образом, желудочки автоматически перекачивают избыточный объем крови в артерии.
Способность мышечных волокон, растянутых до оптимальной длины, сокращаться с большей эффективностью характерна для всех поперечнополосатых мышц, а не только для миокарда.
Усиление насосной функции сердца при увеличении венозного возврата происходит и по другой причине. Растяжение стенки правого предсердия приводит к увеличению частоты сердечных сокращений на 10-20%, что тоже вносит вклад в увеличение выброса крови из желудочков в артерии.
Видео физиология закона Франка-Старлинга
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое преднагрузка и постнагрузка на сердце
Согласно представлениям о физиологии сердечно-сосудистой системы, преднагрузка — это сила, растягивающая миокард перед его сокращением. Концепция преднагрузки появилась в результате лабораторных экспериментов, в которых мышечные волокна растягивают небольшими грузами (преднагрузка) до начала сокращения.
В данных экспериментах сокращение вызывается электрическим стимулом, а проводник определяет результирующую силу. Данные, полученные как in vitro, так и in vivo выявили, что увеличение длины саркомера до максимума в 0,2 мкм путем добавления грузов вызывает усиление сокращения. При превышении максимума сократимость мышцы снижается. Данное соотношение, известное как соотношение Франка-Старлинга, было описано на примере сердечной мышцы земноводных Отто Франком в 1884 г.
В 1914 г. Эрнест Старлинг на примере сердечной мышцы млекопитающих его подтвердил. Механизмы, касающиеся преднагрузки и силы сокращений остаются не понятыми. Изначально полагали, что растяжение сердечной мышцы облегчало взаимодействие актина и миозина, вызывая тем самым усиление сокращения. Недавние исследования указывают на то, что сила сокращения зависит также от чувствительности миоцита к градиентам ионизированного кальция, определяемой длиной саркомера.
Соотношение Франка-Старлинга лежит в основе модели, формирующей подходы для рассмотрения сердечно-сосудистой системы в норме и патологии. Гиповолемия или сниженная преднагрузка является следствием кровотечения или уменьшения внутрисосудистого пространства вследствие внутренних или внешних потерь жидкости. Венозный возврат, кроме того, зависит от сосудистого тонуса венозной системы. Как будет описано в фармакологическом разделе данной главы, изменения емкости венозного русла являются частыми нежелательными побочными эффектами препаратов, используемых в лечении пациента с травмой.
Вместе, внутрисосудистый объем и венозный возврат определяют конечно-диастолический объем левого желудочка, который в свою очередь влияет на силу сокращения желудочка. При помощи катетера Свана-Ганца можно измерить давление заклинивания легочной артерии (ДЗЛА), которое приближается по значению к конечно-диастолическому давлению левого желудочка (КДДЛЖ). Если податливость миокарда желудочков не нарушена, то КДДЛЖ тождественно КДОЛЖ (конечно-диастолическому объему левого желудочка).
К сожалению, на пациента в критическом состоянии с травмой воздействуют такие факторы, как ишемия миокарда, сердечная недостаточность, эндотоксемия, гипертрофия миокарда, циркулирующий фактор некроза опухоли (ФНО), снижающие податливость миокарда. В такой ситуации по ДЗЛА нельзя судить о КДОЛЖ. Нормальные или повышенные значения ДЗЛА не могут исключить неадекватную преднагрузку как причину низкого сердечного выброса.
Кроме изменений емкости сосудистого русла, на венозный возврат влияет повышение внутригрудного или внутрибрюшного давлений, что происходит при абдоминальном компартмент-синдроме и беременности. Наиболее показательным в данном отношении является напряженный пневмоторакс, когда после декомпрессии плевральной полости сразу наблюдают положительную динамику. У пациента, находящегося на механической вентиляции легких, использование вентиляции с положительным давлением, в том числе и с положительным давлением в конце выдоха (ПДКВ), может уменьшить венозный возврат.
У данной группы пациентов при сниженном внутрисосудистом объеме, отрицательные эффекты повышенного внутригрудного давления особенно выражены и проявляются снижением сердечного выброса. Важно то, что проведение вентиляции с положительным давлением у пациента с невосполненным дефицитом жидкости может привести к коллапсу. В противоположной ситуации на пациента с нормальным или высоким внутрисосудистым объемом вентиляция с положительным давлением может оказать благоприятный эффект. Повышенное внутригрудное давление ограничит постнагрузку. Метод синхронизации вентиляции с положительным давлением с сердечным циклом был описан как способ уменьшения постнагрузки и увеличения сердечного выброса.
Следует учитывать, что у пациентов с кардиогенным шоком может наблюдаться коллапс при отключении респираторной поддержки. Важно отметить то, что результат указанных физиологических изменений сложно предсказать в клинической практике. Таким образом, хорошие знания физиологии происходящих процессов являются ключом к быстрой постановке диагноза и лечению.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое преднагрузка и постнагрузка на сердце
О недостаточности того или иного органа мы обычно говорим, когда он не в состоянии в полном объеме выполнять свои функции. Функция сердца заключается в выбросе в аорту количества крови, адекватного потребностям организма. Таким образом, сердечная недостаточность (СН) может быть определена как нарушение структуры и функции сердечной мышцы, ведущее к неспособности переносить кислород в том количестве, которое необходимо для тканевого метаболизма [12].
Основной причиной является повреждение миокарда, ведущее к патологическому ремоделированию желудочка вследствие расширения камеры и нарушения сократимости. Эти изменения приводят к снижению сердечного выброса, уменьшению перфузии органов и активации компенсаторных нейрогормональных систем [39].
Главными проявлениями сердечной недостаточности являются одышка и утомляемость. Эти симптомы могут ухудшить функциональные возможности и качество жизни пациентов [8].
Если объем поражения достаточно велик, то в первый момент произойдет падение выброса крови из левого желудочка и снижение ее давления на стенки аорты и крупных сосудов. Это приведет к активации расположенных там барорецепторов. Ответом будет немедленная активация симпато-адреналовой системы (САС). Стимуляция находящихся в сердце β-рецепторов ведет к увеличению ЧСС и повышению сократимости миокарда. Стимуляция находящихся в стенке сосудов рецепторов катехоламинами вызывает реакцию централизации кровотока, а за счет спазма вен увеличивается возврат крови к сердцу во время диастолы [39].
Активация САС ведет к активации ренин-ангиотензин-альдостероновой системы (РААС) [3, 12].
Ренин является ферментом превращающим физиологически неактивный ангиотензиноген в ангиотензин-1. Последний под влиянием ангиотензинпревращающего фермента превращается в одно из наиболее биологически активных веществ – ангиотензин-2. Его образование существенно усиливает спазм сосудов, обусловленный реакцией централизации кровотока. Помимо вазоконстрикции ангиотензин-2 вызывает рост клеток, способствует апоптозу и,что важно в данном случае, увеличивает синтез альдостерона. Альдостерон способствует реабсорбции жидкости в дистальных отделах нефрона. Таким образом, возникающая в ответ на повреждение миокарда активация САС и РААС приводит к постепенному накоплению избытка жидкости в организме. Этот процесс требует времени и достигает клинически значимого эффекта только спустя несколько суток после острой сердечной катастрофы [12].
Несмотря на серьезные достижения в лечении хронической сердечной недостаточности, терапия острой сердечной недостаточности остается практически неизменной. В частности, лечение острой сердечной недостаточности во многом основывается не на доказательной медицине, а на эмпирических данных [15].
Острая сердечная недостаточность (ОСН) – синдром, характеризующийся застойными явлениями по малому и/или большому кругу кровообращения вследствие увеличения давления наполнения левого желудочка с или без уменьшения сердечного выброса. Риск смерти и повторной госпитализации больных ОСН после выписки из стационара остаётся высоким и составляет от 10 до 20%, и от 20 до 30% – в течение180 дней, соответственно [15].
Если отбросить все остальное, то все, что требует организм от сердца, это поддержать кровоток на должном уровне. Сердечный выброс (СВ) – это производное частоты сердечных сокращений (ЧСС) и ударного объема (УО) сердца (объема крови, выталкиваемого из желудочков в ходе каждого сокращения). Увеличение ЧСС является важным ранним компенсаторным механизмом, нормальным ответом сердца на снижение СВ. У здоровых молодых людей СВ возрастает при росте ЧСС до 170–180 уд./мин, а затем начинает снижаться (так как продолжительность диастолы становится слишком короткой для того, чтобы обеспечить достаточное наполнение желудочков). У пожилых пациентов с дисфункцией сердца падение СВ наблюдается при ЧСС менее 150 уд./мин. Имеется три основных фактора, определяющих УО желудочков: преднагрузка, постнагрузка и сократимость миокарда [10, 34].
Преднагрузка характеризует напряжение стенки желудочка в конце диастолы (при максимальном наполнении сердца перед сокращением). Это напряжение трудно измерить, а в качестве «суррогата» (или максимально приближенного показателя) обычно используется конечно-диастолическое давление (КДД). Эта величина определяется венозным возвратом и дает представление о давлении заполнения желудочков [7].
Сократимость — работа, производимая сердцем на данном уровне преднагрузки и постнагрузки. Определяется максимальной скоростью, с которой желудочек может генерировать изменение давления за единицу времени. Понятие «инотропизм» используется для объяснения усиления работы, выполняемой сердцем, независимо от ЧСС, преднагрузки и постнагрузки [7].
Постнагрузка — это напряжение, которое должно быть сгенерировано в стенке желудочка для того, чтобы выбросить кровь во время систолы в артериальную систему. Этот показатель находится под сильным влиянием сопротивления артерий — системного сосудистого сопротивления [7].
В интактном сердце длина мышечных волокон пропорциональна конечному диастолическому объему (КДО) желудочков. Поэтому увеличение наполнения желудочков во время диастолы (или рост преднагрузки) вызывает рост силы последующего сокращения и увеличение УО и СВ. Вот почему факторы, способствующие увеличению объема внутрисосудистой жидкости (а именно – задержка натрия и воды) являются одними из основных компенсаторных механизмов СН. В этом случае увеличение объема внутрисосудистой жидкости приводит к росту венозного возврата к обоим желудочкам, увеличению их КДО и, в конце концов, к повышению УО. Исходя из того, что увеличение преднагрузки способствует росту УО и СВ, можно было бы предположить, что лечение, направленное на повышение объема внутрисосудистой жидкости, было бы полезным в тех случаях, когда функция желудочков угнетена. Но основная проблема такого «лечения» заключается в том, какой именно объем внутрисосудистой жидкости необходим для оптимальной преднагрузки и как его определить у конкретного пациента [10].
В начальной стадии СН снижение сократимости желудочка компенсируется повышением преднагрузки (КДО и КДД), что приводит к нарастанию ударного объема; кроме того, увеличивается частота сердечных сокращений (ЧСС). По мере прогрессирования СН повышение КДД в желудочке все меньше сказывается на ударном объеме; вместе с тем растет давление в венах малого и большого круга кровообращения, вызывая симптомы застоя. Повышается напряжение в стенке желудочка и снижается коронарный кровоток в диастолу, вследствие ухудшается энергетический баланс миокарда [2].
Сопряжение возбуждения и сокращения в миокарде
Когда мембранный потенциал достигает уровня –65 мВ, открываются потенциалзависимые кальциевые каналы L-типа, обеспечивающие формирование входящего кальциевого тока, который ускоряет деполяризацию кардиомиоцитов. В результате активируются потенциалзависимые кальциевые ионные каналы мембраны T-трубочек и рианодиновые рецепторы саркоплазматического ретикулума. Резкое повышение концентрации ионов кальция в саркоплазме устраняет тропомиозиновую блокаду взаимодействия актина и миозина и запускает процесс сокращения кардиомиоцитов. Следовательно, сократимость сердечной мышцы непосредственно зависит от силы входящего кальциевого тока [3, 5]. Существует и другой механизм поступления больших количеств ионов кальция в цитоплазму рабочего кардиомиоцита при его возбуждении. Он обеспечивается сопряженным транспортом ионов кальция и натрия через мембрану, то есть натрий-кальциевым обменом. Во время диастолы натрий-кальциевая помпа активно удаляет из клетки ионы кальция в обмен на ионы натрия. При возбуждении кардиомиоцита направление натрий-кальциевого обмена меняется на противоположное: ионы кальция активно переносятся в клетку, тогда как ионы натрия, напротив, удаляются, и в результате концентрация ионов кальция в цитоплазме кардиомиоцита возрастает [5, 26].
Комплекс актина и тропонина
Несмотря на то, что ионы кальция, соединяясь с ТрС (тропонин С), дают сигнал к запуску цикла поперечных мостиков, есть доказательства, что начинается не только сигнальный процесс включения-выключения. Чтобы понять роль кальция, нужно описать молекулярную структуру комплекса актина и тропонина. Тонкие филаменты состоят из двух актиновых частей, сплетенных в спираль; обе части находятся на более тяжелой молекуле тропомиозина, которая играет роль стержня. С равными интервалами к этим закручивающимся структурам прикреплены три регуляторных белка, называемых тропониновым комплексом. ТрС состоит из короткого N-концевого домена и четырех кальций?связывающих EF-рук, объединенных попарно в глобулярный N-концевой и С-концевой домены [6, 20].
Распространение потенциала действия по мышечному волокну в начале систолы приводит к выходу ионов кальция из саркоплазматического ретикулума и повышению концентрации свободного кальция в цитоплазме. Присоединение кальция ко второй EF-руке ТрС приводит к изменению конформации всего N-концевого домена белка. При этом появление на поверхности N-концевого домена ТрС гидрофобной области, с которой связывается регуляторный домен ТрI (тропонин I). Он перемещается на новое место на тонком филаменте, ослабляя таким образом взаимодействие между ТрТ (тропонин Т) и тропомиозином. В результате тропомиозин перемещается по тонкому филаменту, и устраняется торможение, оказываемое тропомиозином на взаимодействие актина и миозина [6, 20].
АТФ как источник энергии для сокращения
Сокращение сердечной мышцы происходит благодаря скольжению тонких актиновых филаментов относительно толстых миозиновых. Данный процесс обеспечивается за счет циклического АТФ-зависимого взаимодействия миозина и актина. Миозин связывает и гидролизует АТФ до АДФ и неорганического фосфата, но при этом практически не способен избавляться от накопившихся в активном центре продуктов АТФазной реакции. Головка миозина, содержащая в своем составе АДФ и фосфат, способна слабо взаимодействовать с актином, что активирует процесс освобождения фосфата из активного центра миозина. Освобождение неорганического фосфата (а вслед за этим и АДФ) из активного центра миозина сопровождается изменением ориентации «шейки» головки миозина, протягиванием нити актина относительно головки миозина и развитием натяжения. Связывание новой молекулы АТФ приводит к диссоциации миозина от актина и после гидролиза АТФ происходит очередное циклическое присоединение головки миозина к актину и осуществляется новый «шаг» миозина по актину [3].
В цикле поперечных мостиков АТФ выполняет две разные роли:
1) гидролиз АТФ поставляет энергию для движения поперечного мостика;
2) связывание (но не гидролиз) АТФ с миозином сопровождается отделением миозина от актина и создает возможность повторения цикла поперечных мостиков [1].
Миозиновая АТФазная активность реагирует на воздействие кальция следующим образом: во время цикла сокращения сердца концентрация кальция повышается, что ведет к повышению миозиновой АТФазной активности в несколько раз, а также к повышению присоединения кальция к ТрС [3].
Подходы к лечению сердечной недостаточности
Подходы к лечению сердечной недостаточности менялись неоднократно. В 50-60 годах 20 века основной терапией считали инотропную стимуляцию сердца, в 70-х упор делался на борьбу с задержкой жидкости, в 80-е надежды связывали с уменьшением нагрузки на сердце за счет использования вазодилататоров, в 80-х годах синтезировала ингибитор фосфодиэстеразы III (ФДЭ III), за двойной эффект – инотропное и вазодилатирующее, названное инодилататорами. Начиная с 90-х основой лечения стало подавление избыточной активации нейрогуморальных систем [12].
Механизм действия инотропных препаратов
Препараты, обычно используемые для достижения положительного иноторопного эффекта, включают катехоламины, напр. добутамин, и ингибиторы ФДЭ III, напр. милринон. У этих веществ разные точки приложения, но они, в конечном счете, запускают каскад событий, приводящих к улучшению сократимости путем увеличения концентрации внутриклеточного кальция. Взаимодействие катехоламинов с β1-адренорецепторами на поверхности кардиомиоцитов активирует аденилатциклазу, катализирующую превращение АТФ в цАМФ. цАМФ активирует протеинкиназу А, которая, в свою очередь, фосфорилирует внутриклеточные субстраты, включая потенциалзависимые кальциевые каналы L-типа, фосфоламбан, ТрI. Фосфорилирование потенциалзависимых кальциевые каналов L-типа стимулирует поступление кальция в цитозоль. Это является триггером для открытия рианодиновых рецепторов саркоплазматического ретикулума и мышечного сокращения (положительное инотропное действие катехоламинов и ингибиторов ФДЭ III). В то же время фосфорилирование фосфоламбана активирует SERCA2, что приводит к обратному захвату кальция саркоплазматическим ретикулумом во время диастолы. Это обусловливает люзитропный эффект катехоламинов и ингибиторов ФДЭ III. Также фосфорилирование ТрI уменьшает сродство миофиламентов к кальцию и способствует релаксации. Сердечные гликозиды, напр. дигоксин, селективно и обратимо ингибируют сарколеммальную натрий-калиевую АТФазу кардиомиоцитов, повышая т.о. концентрацию натрия внутри клетки, что, в свою очередь, ингибирует выкачивание кальция из клетки натрий-кальциевой помпой. Омекатив мекарбил – новый препарат – активатор миозина. Активирует миозиновую АТФазу [26, 32, 33].
За исключением дигоксина, не оказывающего эффекта на общую смертность, имеющиеся препараты с положительным инотропным действием, включая агонисты β1-адренорецепторов, ингибиторы ФДЭ III, оказались вредны для долгосрочного лечения СН, т.к. они могут способствовать развитию злокачественных желудочковых тахиаритмий и увеличить риск внезапной сердечной смерти. Также короткосрочное применение ингибиторов ФДЭ III ассоциируется с частым возникновением таких осложнений, как фибрилляция предсердий, гипотензия, особенно если у пациента имеется ишемия миокарда ввиду ишемической кардиомиопатии. Причины столь разочаровывающих открытий кроются в том, что, несмотря на различные точки приложения, все эти препараты усиливают сократимость миокарда путем увеличения внутриклеточного уровня цАМФ в кардиомиоцитах или благодаря его усиленному синтезу (при приеме агонистов β1-адренорецепторов), или снижению скорости его деградации (при приеме ингибиторов ФДЭ III), что усиливает высвобождение кальция из саркоплазматического ретикулума в цитозоль. Увеличение внутриклеточного кальция, в свою очередь, ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [17].
Инотропные препараты существенно увеличивают энергетические затраты кардиомиоцитов. Увеличение внутриклеточного кальция ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [19].
Было проведено значительное количество исследований, направленных на поиск нового инотропного препарата, действие которого не имеет под собой увеличения кальция в клетке. В теории такой препарат должен был усиливать сократимость без увеличения потребности миокарда в кислороде и без риска возникновения аритмий. Т.к. связь между уровнем внутриклеточного кальция и взаимодействием миофиламентов может быть нарушена ввиду таких патофизиологических состояний, как ишемия, ацидоз, сепсис или гипотермия, разрабатываемый препарат должен был укреплять эту связь, но не изменять внутриклеточную концентрацию кальция. Все «сенситизаторы кальция», включая левосимендан, пимобендан, EMD 57033, ORG 30029, MCI-154 и другие, имеют способность усиливать сократимость миокарда путем увеличения чувствительности миофиламентов к кальцию с различной интенсивностью, с помощью различных механизмов и точек приложения и различной степенью одновременного ингибирования фосфодиэстеразы III. Среди этих препаратов левосимендан наиболее эффективен в лечении хронической и острой левожелудочковой недостаточности [20].
Регистрационное свидетельство препарату левосимендан впервые было предоставлено в 2000 году в Швеции. В настоящее время левосимендан обладает
регистрационным свидетельством в более чем 50 странах по всему миру, при
этом установлено, что на декабрь 2014 года более 800 000 пациентов получили
инфузию препарата в рамках рутинной клинической практики [14].
Левосимендан – сенситизатор кальция, инодилататор, разработанный для внутривенного применения у пациентов, госпитализированных с острой декомпенсированной сердечной недостаточностью (ОДСН). Фармакологические действия левосимендана включают:
а) повышение сократимости сердца благодаря сенситизации тропонина С к кальцию;
б) вазодилатацию вследствие открытия калиевых каналов саркоплазматической мембраны в гладкомышечных клетках сосудов;
в) кардиопротекцию благодаря открытию митохондриальных калиевых каналов в кардиомиоцитах [25, 26, 31].