что такое первый закон термодинамики в физике
Первый закон термодинамики и его применение в физике
Содержание:
Определение
Простая формулировка первого закона термодинамики может звучать примерно так: изменение внутренней энергии той или иной системы возможно исключительно при внешнем воздействии. То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая. То есть на примере пословицы про рыбку и труд, можно представить, что рыбка и есть наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытащит из пруда) без нашего внешнего воздействия и участия (труда).
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировки сути данного закона:
Формула
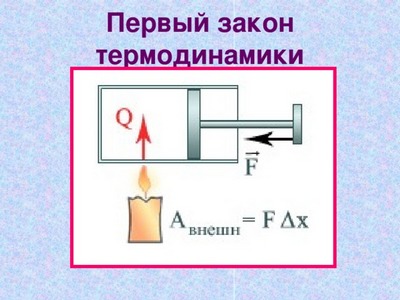
Формулу первого закона термодинамики можно записать таким образом:
Количество теплоты Q, передаваемое системе равно суме изменения ее внутренней энергии ΔU и работы A.
Процессы
Также первый закон термодинамики имеет свои нюансы в зависимости от проходящих термодинамических процессов, которые могут быть изохронными и изобарными, и ниже мы детально опишем о каждом из них.
Закон для для изохорного процесса
Изохорным процессом в термодинамике называют процесс, происходящий при постоянном объеме. То есть, если будь-то в газе или жидкости нагреть вещество в сосуде, произойдет изохорный процесс, так как объем вещества останется неизменным. Это условие имеет влияние и на первый закон термодинамики, проходящий при изохорном процессе.
В изохорном процессе объем V является константой, следовательно, газ работы не совершает A = 0
Из этого выходит следующая формула:
Эта статья доступна на английском – First Law of Thermodynamics.
Первый закон термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В этом случае справедливой будет формула внутренней энергии газа:
Первый закон термодинамики для изобарного процесса дает:
Первый закон термодинамики для изотермического процесса выражается соотношением
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
Адиабатический процесс относится к изопроцессам.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Физика. 10 класс
Конспект урока
Урок 24. Первый закон термодинамики
Перечень вопросов, рассматриваемых на уроке:
1) закон сохранения энергии для термодинамических процессов;
2) связь изменения внутренней энергии газа с работой внешних сил и количеством теплоты, переданного термодинамической системе;
3) применение первого закона термодинамики к различным газовым процессам;
4) уравнение теплового баланса;
5) необратимость тепловых процессов.
Работа системы против внешних сил – это работа, которую совершает газ, преодолевая внешнее давление.
Адиабатный процесс – это процесс, протекающий в системе без теплообмена.
Необратимый процесс – Необратимым называется такой процесс, который самопроизвольно протекает только в одном направлении; в обратном направлении он протекает так, что система не проходит через те же состояния и не возвращается в исходное состояние.
Первый закон термодинамики – закон сохранения энергии для термодинамических систем.
Количество теплоты, сообщённое системе, равно сумме работы газа против внешних сил и изменения внутренней энергии системы.
Второй закон термодинамики определяет направление термодинамических процессов. Одна из формулировок второго закона: невозможен такой процесс, единственным результатом которого является переход тепла от менее нагретого тела к более нагретому телу.
Основная и дополнительная литература по теме урока:
Мякишев Г. Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 216-224.
Основное содержание урока
Закон сохранения энергии, записанный применительно к термодинамической системе, выглядит следующим образом:
где Q – количество теплоты, переданное системе;
Тогда первый закон термодинамики лучше написать в виде ∆U = Q + А.
Применение первого закона термодинамики к изопроцессам.
Используя уравнение Менделеева-Клапейрона, получим
Подстановка в уравнение первого закона термодинамики количества теплоты дает
Процесс, протекающий без теплообмена, т.е. Q = 0.
Уравнение теплового баланса.
Если в замкнутой системе тела обмениваются энергией и работа этими телами не совершается, то суммарное изменение внутренней энергии системы равно нулю; тогда соответственно равна нулю и сумма количеств теплоты, полученных или отданных телами системы,
Первый закон термодинамики не определяет направление тепловых процессов. Необратимыми называются такие явления, которые самопроизвольно протекают только в одном направлении; в обратном направлении они протекают только при внешнем воздействии.
Формулировка второго закона термодинамики: невозможно перевести тепло от менее нагретого тела к более нагретому телу при отсутствии других одновременных изменений в обеих системах или в окружающих их телах (или невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого, к телу более нагретому).
Статистический характер второго закона термодинамики.
Вероятность обратимых процессов, наоборот, тем больше, чем меньше число частиц в системе. Поэтому справедливость второго закона термодинамики определяется достаточно большим объёмом и достаточно большим числом частиц системы. Так, например, ничтожно мала (реально равна 0) вероятность того, что спокойно висящий маятник начнет раскачиваться в результате одновременного, направленного в одну сторону удара всех молекул воздуха, до какого-то момента, двигавшихся хаотично по всем сторонам.
Направление термодинамических процессов определяется вторым законом термодинамики. Первый и второй законы термодинамики позволяют сделать заключение о невозможности создания вечного двигателя I и II рода.
Разбор тренировочных заданий
1. Гелий, находящийся в сосуде под подвижным поршнем, изотермически сжимают. Начальное давление газа p0, а его объём V0. Масса газа в сосуде остаётся неизменной. Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от объёма V газа. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца.
1.
Б) Внутренняя энергия U(V)
2.
3.
4.
Решение: В изотермическом процессе p0V0 = pV; откуда 
Из уравнения Менделеева-Клапейрона:
Правильный ответ: А – 3, Б – 4.
2. Чему равна внутренняя энергия 2 молей идеального одноатомного газа при температуре 127 0 С? R = 8,31Дж/(моль·К).
Решение: Переведём температуру в СИ:
Т = 127 + 273 = 400 К.
Формула для вычисления внутренней энергии одноатомного идеального газа:
Известно, что число молей 
U = (3/2) · (2 моля) · 8,31 (Дж/моль·К) · 400 К = 9972 Дж.
Что такое первый закон термодинамики в физике
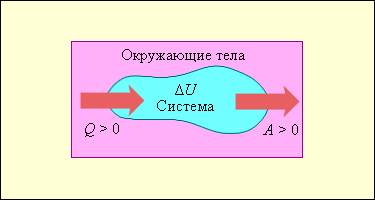
На рис. 3.9.1 условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением Δ U внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе ( V = const) газ работы не совершает, A = 0. Следовательно,
|
Здесь U ( T 1) и U ( T 2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом ( Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам ( Q изобарном процессе ( p = const) работа, совершаемая газом, выражается соотношением
Первый закон термодинамики для изобарного процесса дает:
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q A T 2 T 1; внутренняя энергия убывает, Δ U изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид
т. е. газ совершает работу за счет убыли его внутренней энергии.
Работа газа в адиабатическом процессе просто выражается через температуры T 1 и T 2 начального и конечного состояний:
Адиабатический процесс (так же, как и другие изопроцессы) является процессом квазистатическим. Все промежуточные состояния газа в этом процессе близки к состояниям термодинамического равновесия (см. §3.3). Любая точка на адиабате описывает равновесное состояние.