что такое первичный остеопороз
Хрупкость бытия: что такое остеопороз и как его лечить?
Остеопороз — патология, которая не щадит никого. Статистика неутешительная, и с переходом в зрелый возраст увеличиваются риски возникновения этой проблемы. Что же это за болезнь — остеопороз, с чего начинается диагностика, симптомы и лечение, профилактика и советы — в нашем подробном обзоре.
Начнем с начала: что такое остеопороз, какие виды бывают?
Остеопороз — это нарушение обменных процессов в костной ткани, пороз или поражение костей. Системный остеопороз — серьезное заболевание скелета с потерей массы и плотности костной ткани, что приводит к снижению прочности костей и их ломкости.
При заболевании ткань истончается, и в итоге любая банальная травма (например, при падении зимой в гололед) может закончиться серьезным переломом. Проблема остеопороза настолько распространенная, что уже вышла на государственный уровень в России, однако, как отмечают многие исследователи, население недостаточно информировано об этом*.
Согласно статистике, остеопороз становится причиной патологических переломов у каждой третьей женщины и каждого пятого мужчины старше 50 лет**
Первичный остеопороз костей
Остеопороз может развиться как самостоятельное заболевание, в таком случае его называют первичным. Заболевание развивается на основании потери костной массы и может протекать абсолютно бессимптомно. Костная ткань является динамичной системой — она разрушается и образуется в течение всей жизни человека, но у людей старше 40 начинается активная потеря строительного материала костей***. Уже с этого возраста важно задуматься, что происходит с костной системой, и контролировать уровень гормонов и микроэлементов в организме.
К формам первичного остеопороза обычно относят:
Вторичный остеопороз
Возникновение остеопороза может быть вызвано другими заболеваниями. Например, вторичный остеопороз может развиться на фоне следующих патологий:
Начнем с начала: причины развития остеопороза
Помимо развития остеопороза на фоне первичных патологий болезни способствуют и другие факторы риска:
Ваша скорая помощь: кальций и витамин D в лечении остеопороза
Кальций играет главную роль в построении костной ткани, но иногда он не усваивается из-за отсутствия витамина D. Оптимальное соотношение необходимых элементов представлено в усиленной формуле Кальций-Д3 Никомед Форте — это комбинированный препарат, регулирующий обмен кальция и фосфора в организме.
Кальций-Д3 Никомед Форте применяется в составе комбинированной терапии остеопороза. Препарат снижает разрушение костной ткани и увеличивает ее плотность, восполняя недостаток кальция и витамина D3 в организме.
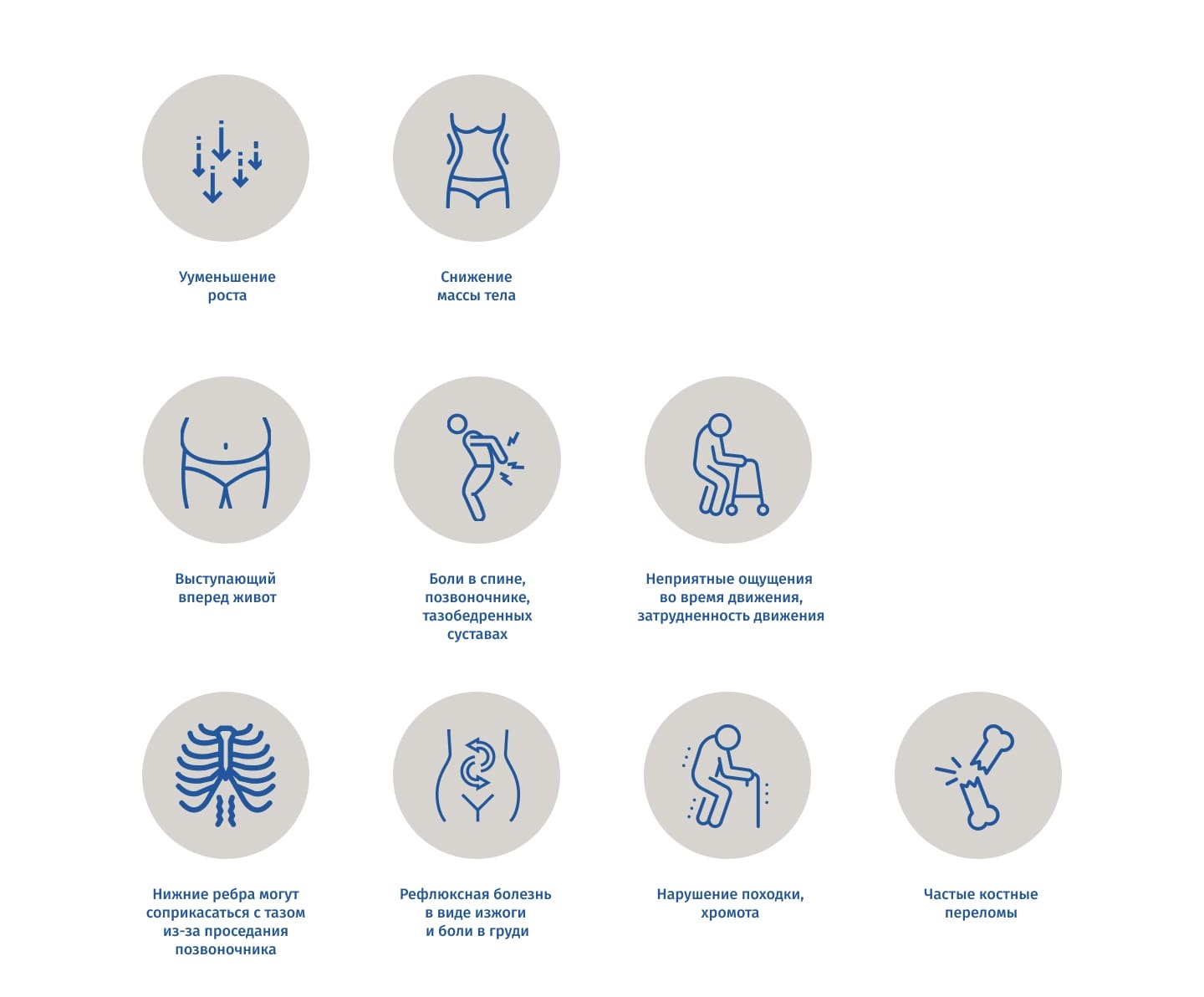
Первые звоночки: симптомы остеопороза костей
Клинически остеопороз протекает, как правило, бессимптомно. Болевой синдром формируется только вследствие переломов. На разных стадиях могут наблюдаться снижение веса и многое другое. В основном остеопороз имеет следующие симптомы:
То, как проявляется остеопороз, никак не связано с возрастом и полом человека. Остеопороз имеет одинаковые симптомы и лечение у женщин, взрослых мужчин, пожилых людей и детей
Переломный момент, или Диагностика: как обнаружить заболевание?
Часто выясняется, что у человека остеопороз, после перелома. Как еще выявить это заболевание? В первую очередь необходима тщательная врачебная диагностика и регулярный мониторинг собственного здоровья. Для этого необходимо обратиться к терапевту, а затем к эндокринологу и ревматологу.
При клиническом обследовании врач уточнит все характерные признаки заболевания, соберет ваши симптомы и назначит анализы. Диагноз «остеопороз» может поставить только врач в условиях клиники. Среди обязательных исследований:
Лечение остеопороза: как восстановить здоровье костной ткани?
Как лечить остеопороз и есть ли смысл? Важно остановить развитие заболевания, чтобы избежать серьезных последствий. Наиболее эффективен комплексный подход, и, конечно же, важно выявить болезнь на ранней стадии.
Основные направления лечения остеопороза сводятся к следующему:
Если клинические проявления остеопороза сопровождаются переломами, например, бедренной кости, пациенту назначают хирургическую операцию для восстановления работы суставов. Методы лечения всегда подбираются, исходя из конкретной ситуации больного.
Профилактика остеопороза
Основные направления профилактики остеопороза сводятся к нормализации образа жизни, богатому и сбалансированному рациону для получения всех необходимых для организма нутриентов. Важно следить за уровнем мышечной и жировой массы, при низком весе увеличивается риск развития остеопороза. Отдельно стоит выделить необходимость гимнастики для формирования и поддержания мышечного корсета. Очень важно развивать координацию и учиться равновесию для предотвращения падений.
* Ершов В.Е., Родионова С.С., Кривова А.В., Захаров В.П. Демографические тенденции в борьбе с остеопорозом и его последствиями. Русский медицинский журнал. № 4, 2019, С. 11–14.
** Согласно данным ВОЗ (Всемирной организации здравоохранения).
*** Маличенко С.Б., Королевская Л.И. Первичный остеопороз. Русский медицинский журнал. № 7, 2004, С. 483.
**** Шостак Н.А. Остеопороз: современные аспекты диагностики и лечения. Лечащий врач. #07/04, 2004.
Остеопороз
Скидки для друзей из социальных сетей!
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Согласно статистике ВОЗ, остеопороз занимает четвертое место по смертности, пропустив вперед себя сердечно-сосудистые заболевания, онкологию и сахарный диабет. В нашей стране остеопороз выявляется у каждой третьей женщины старше 50 лет и у каждого пятого мужчины.
Диагностика и лечение остеопороза
Итак, что же такое остеопороз? В переводе с греческого языка это означает «пористая кость» — истончение костной ткани за счет потери солей кальция, что приводит к ее повышенной хрупкости и, как следствие, частым переломам и костным деформациям. Уже начиная с 35 лет, кости постепенно истончаются и становятся менее прочными. Это свойственно каждому человеку, но у некоторых людей процесс выражен более интенсивно и ведет к более раннему остеопорозу.
Причины развития остеопороза
Многие полагают, что употребление повышенного количества кальция позволяет избежать остеопороза костей. Это не совсем так. Во-первых, избыточное потребление кальция чревато образованием камней в почках и нарушением кальциевого обмена. Во-вторых, остеопороз может развиваться при достаточном поступлении кальция в организм в результате его плохого усвоения, например, при дефиците витамина Д.
Основными причинами остеопороза являются:
Также неблагоприятными факторами являются курение и употребление алкоголя, недостаток движения (гиподинамия) и др.
Виды остеопороза
В зависимости от причин, выделяются первичный остеопороз и вторичный остеопороз.
Виды первичного остеопороза:
Вторичный остеопороз появляется вследствие различных причин, таких как эндокринные нарушения, воспалительные заболевания суставов, болезни крови и др.
Остеопороз может ограничиваться одной костью (локальный остеопороз, очаговый остеопороз), охватывать несколько находящихся рядом костей (остеопороз регионарный) или всю костную систему (системный остеопороз или диффузный остеопороз). Также выделяют пятнистый остеопороз.
Все про остеопороз
Остеопороз – это заболевание, связанное с потерей кальция костной тканью. Патологический процесс обычно начинается у людей в возрасте старше 40 лет. У некоторых он проходит незаметно, а у других приводит к серьезным проблемам в виде переломов и других неблагоприятных последствий.
Содержание статьи
Это заболевание очень коварно, потому что не имеет выраженных и характерных симптомов до тех пор, пока у человека не начинаются переломы от даже не очень значительного воздействия. При этом средства, избавляющего от такого недуга, на сегодняшний день нет. Главная задача – остановить его прогрессирование и не допустить осложнений. Чем раньше начнется лечение остеопороза, тем больше шанс избежать губительных последствий.
Причины возникновения и факторы развития остеопороза
Причины развития остеопороза многообразны, их принято классифицировать по группам факторов риска.
Основные факторы риска остеопороза и переломов костей
| Модифицируемые факторы риска | Немодифицируемые факторы риска | |||
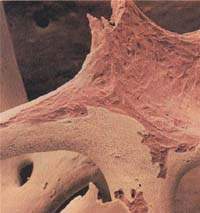 |
| Рисунок 1. Микроархитектоника остеопоротической кости |
Среди заболеваний органов движения наиболее важное значение имеет остеопороз (поражение бедра, позвоночника) ввиду его высокой распространенности, инвалидизации, значительной смертности от осложнений.
Остеопороз (ОП) — метаболическое заболевание скелета, частота встречаемости которого повышается с возрастом и характеризуется прогрессирующим снижением массы кости в единице объема и нарушением микроархитектоники костной ткани, приводящими к увеличению хрупкости костей и высокому риску их переломов. Как видно из определения, в основе заболевания лежит потеря костной массы, которая происходит постепенно, скрытно и часто диагностируется уже после переломов, что и дало основание называть ОП «безмолвной эпидемией».
ОП рассматривается как болезнь, когда потеря массы кости превышает ее возрастную атрофию. Снижение массы кости делает скелет более уязвимым для переломов, которые возникают даже при незначительной травме.
По прогнозам, к 2010 году число госпитализаций по поводу только переломов шейки бедра на фоне ОП составит 1,3 млн. в год. Причем 25% пациентов с переломами шейки бедра будут умирать и примерно столько же в результате лечения смогут восстановить физическую активность до уровня, предшествовавшего перелому. В 50% случаев пациенты с переломами станут инвалидами, требующими значительных материальных затрат и постороннего ухода.
Переломы тел позвонков являются одним из классических признаков постменопаузального ОП, а их проявления в виде болей в спине, нарушения функции и деформаций позвоночника определяют степень нетрудоспособности. По данным многоцентрового европейского исследования по ОП позвоночника, в котором принимала участие и Россия (Институт ревматологии РАМН), в большинстве стран Европы в середине 90-х годов частота переломов тел позвонков у лиц в возрасте 50-79 лет составила 12%, в России — в среднем 11,8%. Колебания варьировали от 6,2% в Чехии до 20,7% в Швеции. При этом снижение плотности костной ткани зарегистрировано у 85,7% женщин в возрастной группе 50-54 лет и у 100% мужчин в возрасте старше 75 лет.
Наиболее распространенными формами ОП являются постменопаузальный и сенильный, составляющие до 85% всех вариантов остеопороза.
Для 50-летней женщины риск перелома позвоночника составляет 15,6%, шейки бедра — 17,5%, костей запястья — 16,0%, любого из трех участков скелета — 39,7%.
Остеопорозом страдают также больные, принимающие кортикостероиды, цитостатики, противосудорожные препараты, подвергшиеся лучевой терапии, больные гиперпаратиреозом, тиреотоксикозом, болезнью Кушинга, гипогонадизмом, после резекции желудка или синдрома мальабсорбции, с рено-паренхиматозными заболеваниями, сахарным диабетом, билиарным циррозом печени, коллагенозами, миеломной болезнью, а также лица, страдающие алкоголизмом.
В настоящее время убедительно доказано, что увеличение риска переломов достоверно связано с уменьшением минеральной плотности кости (МПК). Снижение МПК на одно стандартное отклонение от нормы (10-14%) по сравнению с соответствующим показателем у женщин до менопаузы приводит к двукратному увеличению риска переломов. Риск развития перелома усугубляется нарушением интенсивности ремоделирования.
Костная ткань — динамичная полиморфная система, в которой в течение всей жизни человека происходят два взаимосвязанных процесса разрушения старой кости (резорбция) и образование новой (формирование), составляющие цикл ремоделирования костной ткани. Обе составляющие ремоделирования тесно связаны между собой, подвержены сложной гормональной и гуморальной регуляции, а их состояние в совокупности определяется таким понятием, как «костный оборот». Нарушения в местах ремоделирования кости возникают вследствие изменения баланса между процессом формирования и процессом резорбции в сторону преобладания последнего, что приводит к потерям костной массы. Интенсивность и выраженность костных потерь зависят от скорости «костного оборота», поскольку потери костной массы вследствие разобщения процессов формирования и резорбции кости происходят как при низкой, так и при высокой скорости «костного оборота».
Образование, минерализация и резорбция костной ткани осуществляются в отдельных единицах костной структуры — базисной многоклеточной единице (BMU — basic multicellular unit), представленной остеобластами и остеокластами. В свете теории интермедиаторной организации скелета развитие ОП представляется как временное рассогласование действия отдельных BMU, приводящих к усилению интенсивности ремоделирования и дефициту костной ткани. Причиной уменьшения массы кости может стать также удлинение цикла отдельных BMU или уменьшение числа функционирующих BMU. В этих случаях интенсивность ремоделирования снижается, и воспроизводство происходит по типу «ленивой» кости.
Факторы риска первичного остеопороза нередко наследственно обусловлены, но также существуют факторы риска, связанные с особенностями семейного и личного анамнеза (см. табл. 1).
Скорость потери костного вещества зависит от факторов, регулирующих процессы костного ремоделирования и кальций-фосфорного гомеостаза.
Уровень кальция в крови является физиологической константой, подерживающейся за счет баланса между процессами всасывания кальция в кишечнике, фильтрации и реабсорбции в почках, депонирования и «вымывания» из костей. Эти процессы регулируются паратгормоном, витамином D, кальцитонином и эстрогенами.
При ОП выделяют две главные характеристики костного обмена, каждая из которых приводит к снижению массы кости. Это ОП с высоким костным обменом, при котором высокая резорбция кости не компенсируется нормальным или повышенным костеобразованием и ОП с низким костным обменом, когда скорость резорбции кости близка к норме или снижена, а темп костеобразования замедлен. И та и другая формы могут проявляться как различные стадии остеопоротического процесса у одного больного. У лиц с изначально низкой пиковой массой ОП может развиться и при нормальной интенсивности ремоделирования.
В патогенезе постменопаузального ОП пусковым фактором является эстрогенная недостаточность, вызывающая ускорение потери костной массы. О возможном влиянии эстрогенов на развитие ОП впервые высказался F. Albright, описав данное заболевание. Среди существующих точек зрения на причины и патогенез постменопаузального ОП наиболее обоснованной представляется роль возрастных изменений в организме женщины, связанных со снижением и последующим прекращением функции яичников, прежде всего выработки эстрогенов.
Половые стероиды поддерживают баланс между остеобластами и остеокластами в процессах ремоделирования, в основном за счет снижения резорбции костной ткани и вторичного понижения ее образования. Дефицит эстрогенов ведет к нарушению указанного баланса с повышением активации новых ремоделирующих костную ткань единиц. В период менопаузы активируется полный цикл ремоделирования кости, однако процессы резорбции несколько преобладают над процессами формирования костной ткани.
Влияние эстрогенов на костную ткань может быть прямым и опосредованным. По современным представлениям остеобласты и остеокласты содержат высокоспецифичные рецепторы к эстрогенам, в частности к эстрадиолу, и являются клетками-мишенями для этих гормонов. Данные, полученные in vivo, показывают, что первичный эффект эстрогенов состоит в понижении активности остеокластов. Влияние эстрогенов на остеобласты отражает их тонкое взаимодействие с одним или более дополнительными факторами, участвующими в ремоделировании костной ткани.
Таблица 1. Факторы риска ОП
Однако до настоящего времени воздействие эстрогенов на костную ткань остается предметом дискуссий. В ряде работ отмечено отсутствие различий в концентрации этих гормонов в крови больных остеопорозом и у здоровых лиц такого же возраста. Не выявлено зависимости интенсивности резорбции от уровня эстрогенов в плазме крови и их экскреции с мочой. Тем не менее имеются работы, подтверждающие положительное влияние заместительной гормонотерапии на клиническое течение остеопороза, что проявляется замедлением потери костной массы и снижением частоты переломов.
Предполагают также, что недостаток эстрогенов способствует снижению секреции кальцитонина и повышению чувствительности кости к резорбтивному действию паратиреоидного гормона. Кроме того, в генезе постменопаузального ОП существенную роль играют снижение абсорбции кальция в кишечнике и вторично обусловленный дефицит витамина D, а также указанные выше многочисленные генетические факторы риска.
Одной из ведущих причин сенильного ОП являются нарушения функции желудочно-кишечного тракта, обусловленные изменением характера питания. Ухудшение переносимости молочных продуктов вследствие снижения секреции лактазы приводит к уменьшению их потребления. Помимо этого, пожилые люди едят меньше мясных продуктов, вследствие чего сокращается поступление кальция с пищей. Уменьшение двигательной активности в результате расстройства координации, ухудшения нервно-мышечной проводимости, снижение физической работоспособности (из-за нарастания явлений недостаточности кровообращения) заставляют пожилых людей большую часть времени проводить в помещении. Недостаток инсоляции приводит к снижению синтеза витамина D3 в коже. Уменьшение физических нагрузок также непосредственно (вне зависимости от инсоляции) способствует снижению уровня витамина D в плазме крови, что может являться дополнительным фактором риска развития ИБС, наряду со снижением содержания в плазме крови липопротеидов высокой плотности. В то же время у пожилых людей вследствие снижения синтетической функции почек (дефицит 1l-гидроксилазы) не происходит увеличения образования активной формы витамина D. В результате появляются условия для развития гипокальциемии, которая наблюдается примерно у 70% больных пожилого возраста.
Таким образом, создается ситуация, при которой поддержание нормального уровня кальция в плазме крови возможно только за счет его усиленной мобилизации из костной ткани, что обеспечивается повышенным уровнем паратгормона. При этом зарождается тенденция к развитию ОП, артериальной гипертензии, недостаточности кровообращения, атеросклероза и нарушению функционирования ионных транспортных систем мембран клеток, что, в частности, проявляется нарушением нервно-мышечной передачи, а следовательно, и координации движений.
Риск переломов при сенильном ОП зависит как от степени потери костной ткани, так и от причин, приводящих к травмам. В частности, одной из главных причин является тяжелая постуральная гипотензия. Неполная реабилитация после инсульта, прием транквилизаторов, снотворных средств и миорелаксантов также приводит к падению пожилых людей.
Современные методы диагностики позволяют решать следующие задачи: установить наличие остеопороза и его осложнений, выявить причины развития остеопении, оценить уровень метаболизма в костной ткани путем исследования биохимических или морфологических маркеров костной резорбции и костеобразования, а также показателей кальциевого обмена, выяснить причины остеопении и провести дифференциальную диагностику с другими формами метаболических остеопатий.
Клинические проявления. Почти в 50% случаев ОП протекает бессимптомно или малосимптомно и выявляется уже при наличии переломов костей. Для постменопаузального ОП характерны преимущественные потери трабекулярной костной ткани и соответственно переломы тел позвонков, ребер, переломы лучевой кости в «типичном месте». Поражение костей с преобладанием кортикальной костной ткани свойственно сенильному ОП, при этом чаще встречаются переломы трубчатых костей и шейки бедра, но нередки (особенно в старших возрастных группах) переломы тел позвонков.
| Общество и больные несут большие экономические потери вследствие затрат на лечение и профилактику ОП. Так, в США затраты на лечение составляют 7-10 млрд. долл. в год, из них 8 млрд. — на лечение больных с переломами; в Великобритании — 614 млн. фунтов стерлингов в год, из них 160 млн. на лечение больных с переломами шейки бедра |
Основной жалобой у больных ОП является боль в крестце и поясничной области, усиливающаяся при нагрузке и ходьбе, чувствительная к малейшему сотрясению. Пациенты нередко указывают на чувство тяжести между лопатками, утомляемость, необходимость многократного отдыха в течение дня в положении лежа. Реже встречаются жалобы на боли в суставах, нарушение походки, хромоту. Болевой синдром, оцениваемый по пятибалльной системе, может быть разной степени выраженности не только у разных больных (от 1 до 5 баллов), но и у одного и того же больного в разные промежутки времени. Другой особенностью болевого синдрома при ОП является то, что длительный прием таких препаратов, как вольтарен или напроксен, не купируют его. Нередко боли в спине и костях приковывают пациента к постели, и они нуждаются в постороннем уходе.
При осмотре необходимо обращать внимание на изменение осанки пациента, деформации грудной клетки, снижение роста, образование кожных складок на боковой поверхности грудной клетки.
Топическая диагностика. Общепринятым методом диагностики остеопении является визуальная оценка рентгенограмм скелета. Однако этот метод обладает низкой чувствительностью и дает возможность выявлять остеопоротические изменения в костях скелета при снижении костной массы на 20-30%, т. е. при далеко зашедшем процессе. Наиболее общим рентгенологическим симптомом постменопаузальной формы ОП является снижение плотности рентгенологической тени отделов скелета, исчезновение поперечной и усиление вертикальной исчерченности тел позвонков, усиление склероза замыкательных пластинок и появление вдавленных переломов в центральных отделах этих пластинок. Некоторые авторы склонны считать вдавленные переломы покровных пластинок ранним проявлением ОП. Характерным рентгенологическим симптомом постменопаузальной формы ОП является клиновидная деформация тел позвонков. У наблюдаемых нами больных переломы тел позвонков регистрировались (в убывающем порядке) в нижнегрудном, поясничном и грудном отделах. Реже у больных этой группы наблюдались переломы тел позвонков по типу «рыбьих».
 |
| Рисунок 2. Сохранность органов движения человека является не только медицинской, но и социальной задачей |
В настоящее время самым надежным методом диагностики является метод количественной оценки костной массы — костная денситометрия, позволяющая диагностировать костные потери на ранних стадиях с точностью до 2-6% в разных участках скелета.
Наибольшее распространение получили рентгеновская (гамма) и ультразвуковая денситометрия и количественная компьютерная томография (ККТ). Рентгеновские денситометры подразделяются на одноэнергетические (Single Photon Absorptionmetry, SPA, или с рентгеновским источником излучения — Single X-ray Absorptionmetrry, SXA) и двухэнергетические (Dual Photon Absorptionmetry, DPA, или c рентгеновским источником излучения — Dual Energy X-ray Absorptionmetry, DEXA), среди которых, в свою очередь, различают периферические (p DXA) и аксиальные (s DXA).
Костная денситометрия позволяет точно измерить костную массу и плотность костной ткани, которые, как правило, выражают в показателях Z и Т. Показатель Z представляет разницу между плотностью костной ткани у конкретного пациента и теоретической плотностью костей у здоровых людей того же возраста. Показатель Т, который является более информативным, — разница между плотностью костной ткани у конкретного пациента и средней величиной этого показателя у здоровых людей в возрасте 40 лет.
Таблица 2. Сравнительная активность бисфосфонатов в отношении ингибиции костной резорбции in vitro
Дозы препарата не зависят от вида остеопороза. При парентеральном применении миакальцика дозы варьируют от 50 до 100 ЕД/сут. ежедневно или 3-4 раза в неделю. Существуют методики непрерывного и прерывистого лечения. При курсовом лечении миакальцик назначают на 2-3 месяца с двухмесячными перерывами. Длительность лечения составляет до 3-5 лет. При интраназальном введении дозу увеличивают в два раза, инстиляции рекомендуют делать на ночь. Длительность и курсы лечения такие же, как и при парентеральном применении. Одновременно с введением кальцитонина необходимо обеспечить достаточное содержание солей кальция в диете и дополнительно назначить соли кальция.
Достоинством бисфосфонатов являются: избирательное действие на костную ткань, наиболее выраженное среди всех антирезорбционных препаратов, способных повышать МПК в позвоночнике, и почти полное отсутствие побочных действий.
Бисфосфонаты являются синтетическими аналогами неорганического пирофосфата (Р-О-Р), обладающего, по крайней мере in vitro, свойствами эндогенного регулятора костного обмена.
Бисфосфонаты обладают многими общими свойствами. Они практически не подвергаются метаболизму, адсорбируются и выводятся из организма в неизмененном виде. При пероральном приеме в желудочно-кишечном тракте всасывается очень небольшая часть препаратов (3,5% этидроната и 0,75% алендроната). Тем не менее 20-50% абсорбированного вещества очень быстро (в течение 12-24 ч) депонируется в костной ткани и присутствует в костях в неактивном состоянии в течение многих лет. Однако наиболее важным фармакологическим свойством бисфосфонатов является их способность подавлять опосредованную остеокластами «патологическую» резорбцию костной ткани, не оказывая существенного влияния на нормальное ремоделирование кости. При этом физико-химическая активность и антирезорбтивный потенциал существенно варьируют у разных препаратов и не коррелируют друг с другом.
В настоящее время в терапевтической практике для лечения остеопороза применяют активные метаболиты витамина D 1l-25(OH)2D3 (кальцитриол, рокатрол) и 1l(OH)D3-альфакальцидол (оксидевит, альфакальцидол, 1-альфа-лео, ван-альфа, альфа-D3-тева). Препараты вызывают многоплановые эффекты в костной ткани, быстро действуют, легко дозируются, достаточно быстро выводятся из организма и не требуют гидроксилирования в почках для осуществления метаболического действия. Кальцитриол оказывает быстрое действие, но обладает небольшой широтой терапевтического диапазона — возникает высокий риск развития гиперкальциемии и гиперкальцеурии, а также большая резорбтивная активность. Для осуществления терапевтического действия альфакальцидол нуждается лишь в гидроксилицировании в печени, после чего приобретает свойства 1l-25(OH)2D3, но скорость превращения в последний регулируется физиологическими потребностями организма, что в определенной степени предотвращает риск развития гиперкальциемии.
Применение альфакальцидола при остеопорозе в дозе 0,5-1,0 мкг в день (2-4 капсулы альфа-D3-тева) позволяет прекратить дальнейшую потерю костной массы, увеличить минеральную плотность кости и предотвратить возникновение новых переломов. Он может использоваться и как средство монотерапии, и в комбинации с большинством средств для лечения остеопороза. При этом потребность в препаратах кальция снижается в два раза.
Проанализировав данные девяти широкомасштабных исследований по лечению и профилактике пост- менопаузального остеопороза, T. Nakamura (1996) пришел к выводу, что достоверный положительный эффект на костную массу можно получить при использовании доз кальцитриола не менее 0,6 мкг, а альфакальцидола 0,75 мкг в сутки с увеличением экскреции кальция в приемлемых пределах. Также было отмечено снижение частоты переломов в леченых группах, при этом ежедневное потребление кальция может не превышать 800 мг.
При терапии активными метаболитами витамина D необходимо контролировать состояние пациентов, а также уровень кальция в крови. Если он выше 2,75 м моль/л, или 11,0 мг%, необходимо отменить препарат на 7-10 дней и назначить повторный курс с уменьшенной дозой, контролируя самочувствие больного и уровень кальция в крови.
Фториды остаются до сих пор единственными прошедшими испытания в клинических условиях препаратами, способными стимулировать активность остеобластов и существенно усиливать костеобразование. Несмотря на тридцатилетнюю историю изучения фторидов, до сих пор не существует однозначного отношения к вопросу их практического применения при ОП. В длительных контролируемых исследованиях, посвященных оценке влияния фторидов на частоту переломов тел позвонков, было показано, что этот показатель либо не снижается, либо снижается в весьма небольшой степени, непропорционально степени повышения МПК. Это противоречие в значительной мере подорвало репутацию фторидов. Возникло подозрение, что их стимулирующее воздействие сопровождается неблагоприятными нарушениями качества вновь синтезируемой кости.
Со временем выяснилось, что для характера воздействия фтора на костную ткань критическое значение имеет величина применяемой дозы. Теперь ясно, что «круг терапевтических доз» фтора весьма узок и составляет от 15 до 20 мг в сутки. Дозы меньше 10 мг в день не оказывают клинически значимого стимулирующего влияния на костную ткань, а дозы фтора, превышающие 30 мг, закономерно ведут к нарушению костеобразования. Это выражается в развитии остеомаляции — нарушении минерализации вновь образующейся костной ткани и накоплении органической основы, не содержащей соединений кальция, и сопровождается ухудшением прочностных свойств костей. Многочисленные клинические исследования, в которых фтор применялся при постменопаузальном ОП в дозе 20 мг, отметили снижение частоты новых переломов тел позвонков на 70% в шейке бедренной кости, лучевой кости. Специальные исследования позволили установить, что фториды в изучаемой дозе усиливают прочностные свойства костей, улучшая микроархитектонику костей. В 1995 году фторид натрия был рекомендован в США к применению при постменопаузальном ОП.
Сейчас не вызывает сомнения, что по степени прироста МПК в позвоночнике с фторидами не может сравниться никакой другой препарат. Причем по мере продолжения лечения МПК продолжается постоянно увеличиваться.
На биодоступность фторидов оказывает влияние множество факторов, и это определяет индивидуальные различия в результатах лечения. Снижение кислотности желудочного сока может приводить к существенному (до 50%) снижению всасывания фтора. Биодоступность фтора снижается в присутствии кальция или антацидов; если соли кальция принимаются одномоментно, абсорбция фтора может снизиться на 20-50%.
Остеохин (иприфлавон) — производное флавоноидов, большого класса натуральных продуктов, синтезирующихся в папоротниках и цветущих растениях. По мнению исследователей, препарат может оказывать одновременно влияние на оба процесса ремоделирования.
Остеохин дает выраженный анальгезирующий эффект, который может сравниться только с обезболивающим эффектом миокальцика. У наблюдаемых нами больных практически во всех случаях снижение болевого синдрома в той или иной степени было отмечено уже спустя 3 месяца после начала лечения. Через 6 месяцев стойкий обезболивающий эффект был в 15% случаев, к 12 месяцам — в 40%. Выявленное на фоне лечения остеохином повышение активности щелочной фосфатазы подтверждало положительное влияние препарата на интенсивность процесса образования костной ткани. Сопутствующая лечению остеохином гипокальциемия свидетельствует, по нашему мнению, о повышении потребности в кальции для минерализации вновь образованного остеоида.
В настоящее время установлено, что самостоятельного значения в лечении остеопороза соли кальция не имеют. Тем не менее практически ни одна терапевтическая программа не планируется без назначения солей кальция. Это обусловлено, с одной стороны, гипокальциемическим действием большинства антирезорбтивных препаратов (кальцитонинов, бисфосфонатов, ипривлавона), с другой — возможными нарушениями минерализации костной ткани при использовании фторидов, бисфосфонатов первого поколения (этидронат). При назначении вышеуказанных препаратов дополнительно применяют не менее 50 мг кальция.