что такое период полураспада лекарства
Период полувыведения (полужизни)
Период полувыведения [ править | править код ]
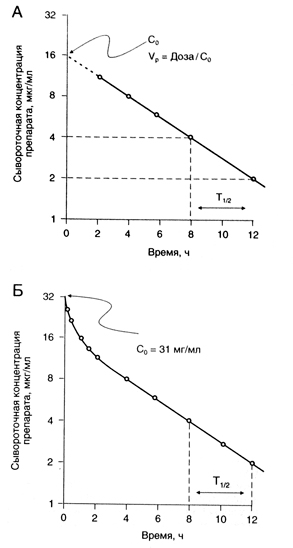
Период полувыведения (Т1/2) — это время, за которое сывороточная концентрация вещества (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели (рис. 1.4, А) определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, так как динамика их сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б). В таких случаях рассчитывают несколько значений Т1/2.
Раньше Т1/2 рассчитывали по участку фармакокинетической кривой, отражающему стадию равновесия (стадию элиминации). С появлением более чувствительных методов измерения концентрации веществ в крови оказалось, что конечный Т1/2 гораздо больше начального. Например, для гентамицина конечный Т1/2 равен 53 ч, тогда как в Приложении II приведен T1/2 2—3 ч. Чрезвычайно длительный конечный Т1/2 индометацина (120 ч) обусловлен, вероятно, активным кишечно-печеночным кругооборотом препарата (в Приложении II приведен Т 1/2 2,4 ч). Клиническая значимость Т1/2 для того или иного периода зависит от того, какая доля вещества выводится из организма и каков объем распределения в этот период, а также от того, какой из показателей — сывороточная концентрация препарата или его общее содержание в организме — лучше коррелирует с фармакологическими эффектами. В Приложении II приведены величины Т1/2, имеющие наибольшее практическое значение.
В прошлом изменение фармакокинетики лекарственных средств при разных патологических состояниях оценивали только на основании Т1/2. В настоящее время общепризнано, что Т1/2 зависит от клиренса и объема рас- пределения вещества. В стационарном состоянии зависимость между Т1/2, клиренсом и объемом распределения приблизительно описывается следующим уравнением:
T1/2 = 0.693 x Vc / Cl(1.12)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 должен увеличиваться. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т1/2 диазепама увеличивается, но не за счет уменьшения клиренса, а вследствие увеличения объема распределения (Klotzetal., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы и тканей, так что предсказать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно. При остром вирусном гепатите Т1/2 толбутамида уменьшается, а не увеличивается, как это можно было бы ожидать, из-за снижения степени связывания препарата с белками плазмы и тканей. Объем распределения толбутамида не меняется, а клиренс увеличивается вследствие увеличения сывороточной концентрации свободного препарата (Williams et al., 1977).
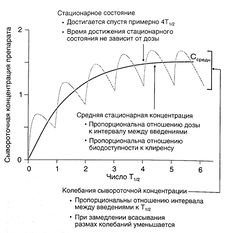
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Сывороточная концентрация, составляющая примерно 94% средней стационарной, достигается за время, равное 4Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полного удаления вещества из организма, и рассчитать интервал между введениями (см. ниже).
Стационарное состояние [ править | править код ]
Согласно уравнению 1.1, если вещество вводится путем инфузии с постоянной скоростью, в стационарном состоянии скорость поступления вещества (скорость инфузии) равна скорости его элиминации (произведение клиренса на сывороточную концентрацию препарата — уравнение 1.3). Уравнение 1.1 можно применять и при дробном введении (например, 250 мг каждые 8 ч): в этом случае также устанавливается стационарная сывороточная концентрация препарата, но в промежутках между введениями она колеблется от минимальной до максимальной (рис. 1.5).
Описание к рис. 1.5. Динамика сывороточной концентрации лекарственного средства при дробном введении. Серая кривая описывает накопление препарата при введении с интервалами, равными Т1/2, при условии, что скорость всасывания в 10 раз больше скорости элиминации. При увеличении скорости всасывания максимальная концентрация в стационарном состоянии стремится к 2, а минимальная — к 1. Черная кривая отражает динамику сывороточной концентрации препарата, который вводят в эквивалентной дозе путем инфузии. Обе кривые соответствуют однокамерной фармакокинетической модели. Средняя концентрация в стационарном состоянии вычисляется по уравнению:
Cсредн=F x Доза / (Cl x T)
Это уравнение можно получить путем замены в уравнении 1.1 скорости поступления вещества на выражение F х Доза / Т. Ссредн соответствует концентрации препарата в стационарном состоянии при введении путем инфузии.
Период выведения и время полураспада лекарств
После всасывания в кровь лекарственные средства (ЛС) неравномерно распределяются в органах и тканях организма. Существенно влияют на распространение веществ биобарьеры. К ним относятся стенка капилляров, цитоплазматический, гематоэнцефалический (ГЭБ) и плацентарный барьеры.
Биологические барьеры организма
Большинство препаратов легко преодолевает стенку капилляров. Одни средства проникают через поры путем фильтрации, другие проникают через капиллярную стенку путем диффузии. Некоторые гидрофильные соединения преодолевают капиллярную стенку с помощью транспортных систем.
Выведение лекарств из организма
ЛС и их метаболиты выводятся из организма разнообразными путями: с мочой, калом, желчью, секретом потовых, сальных и бронхиальных желез, молоком матери, воздухом, выдыхаемым воздухом.
Базовую роль в экскреции лекарств играют почки. На выведение лекарств влияют фильтрация, канальцевая реабсорбция и секреция. Фильтрации в клубочках нефрона испытывают вода, глюкоза, аминокислоты, белки с молекулярной массой до 60000 и некоторые другие соединения. Не фильтруются фракции препаратов, связанные с белками плазмы. Скорость фильтрации зависит от интенсивности кровообращения в почках.
В случаях, когда почечный кровоток нарушен (шок, гломерулонефрит и др.), фильтрация существенно уменьшается.
Выделение лекарств с мочой
Активная секреция лекарственных средств происходит в проксимальных отделах нефрона. Секреция из крови через канальцевый эпителий в первичную мочу происходит с затратой энергии с участием специальных транспортных систем. Секретироваться могут как свободные, так и связанные с белками лекарственные средства. Реабсорбция лекарств происходит в дистальных отделах канальцев. Поскольку пассивная реабсорбция происходит через липидные мембраны канальцевого эпителия, то становится очевидным, что лучше реабсорбируются недиссоциированные липофильные молекулы слабых кислот и щелочей, а также нейтральные соединения. Степень реабсорбции зависит от рН мочи. Так, при кислых рН мочи слабые кислоты (барбитураты, бензодиазепины, сульфаниламиды) мало диссоциированные и легко реабсорбируются в кровь.
Выделение лекарств с калом
С калом выводятся из организма препараты, которые плохо всасываются в желудочно-кишечном тракте. Такие препараты используют преимущественно для воздействия на микрофлору кишечника или как слабительные средства.
Некоторые препараты (тетрациклин, пенициллины и др.) выделяются с желчью в тонкий кишечник, откуда они могут выводиться с калом или повторно всасываться, а затем снова выделяться в кишечник (так называемая циркуляция по энтеропеченочную кругу).
Другие способы выведения лекарств из организма
Период полувыведения
Необходимо отметить, что с увеличением дозы препарата выведение его из организма снижается и соответственно возрастает период полувыведения.
Кроме того, для количественной характеристики скорости вывода вещества из организма используют термин «клиренс» (очищение). Он отражает скорость очистки плазмы крови от вещества (например, 10 мл / мин). Различают общий, почечный и печеночный клиренс.
Большинство лекарственных средств несут в организм метаболические изменения. Этот процесс называется биотрансформацией. Суть метаболических превращений заключается в том, чтобы чужеродное, опасное для организма средство превратилось в соединение, которое может быть легко выведено с мочой, желчью или потом. Такие полярные метаболиты плохо растворяются в липидах и имеют низкую способность взаимодействовать с белками плазмы крови и тканей. Метаболиты, как правило, плохо проникают через биологические мембраны и не испытывают реабсорбции в почках и кишечнике.
Метаболизм лекарств в организме
Метаболизм лекарственных средств происходит преимущественно в микросомальном аппарате печени. Некоторые метаболические преобразования определенных лекарств могут происходить в кишечнике, легких, коже и плазме крови. Лишь некоторые препараты выводятся из организма в неизмененном виде.
Известны два базовых вида метаболизма ЛС:
Восстановление является более редким путем метаболизма лекарств. Реакции восстановления катализируют такие ферментные системы, как нитро- и азоредуктазы и др.
Процессы обезвреживания лекарств существенно замедляются у больных с патологией печени (цирроз, острые и хронические гепатиты и др.). Это приводит к росту продолжительности действия препаратов, развития явлений передозировки.
Некоторые препараты могут подавлять микросомальные ферменты печени (левомицетин, бутадион и др.) или немикросомальные ферменты (антихолинэстеразные средства, ингибиторы МАО и др.). В таких случаях действие лекарств, метаболизм которых происходит при участии соответствующих ферментов, увеличивается. В то же время существуют соединения (фенобарбитал и др.), которые повышают (индуцируют) скорость синтеза микросомальных ферментов.
Кортикостероиды при ковиде
Влияние COVID-19 на иммунную систему
У пациентов с тяжелой формой COVID-19 может развиться системная воспалительная реакция, которая способна привести к повреждению легких и дисфункции множества органов. Противовоспалительные эффекты кортикостероидов могут предотвратить или смягчить эти пагубные эффекты.
Отличие COVID-19 от других коронавирусных инфекций
Патогенез SARS-CoV-2 в корне отличается от патогенеза его предшественников SARS-CoV-1 и MERS, плохие исходы которых коррелируют с виремией и высокой вирусной нагрузкой в легких в момент смерти. В отличие от коронавируса MERS, SARS-CoV-2 редко обнаруживается в крови во время симптоматической фазы covid-19, даже у людей с тяжелым заболеванием. Кроме того, гипоксемия может развиваться, когда вирусная нагрузка в верхних дыхательных путях быстро падает или становится неопределяемой. Пациенты, госпитализированные с covid-19, обычно сообщают о появлении симптомов через 3-5 дней после заражения (усталость, озноб), прогрессирующих до лихорадки и сухого кашля через 48 часов. Переход в тяжелое состояние с гипоксемией происходит через пять-семь дней после начала симптоматического заболевания, примерно через 8-14 дней после первоначального заражения. В исследовании RECOVERY дексаметазон был полезен участникам, лечившимся в течение семи или более дней после начала симптоматической фазы с началом гипоксемии. Таким образом, данные RECOVERY поддерживают использование дексаметазона только у пациентов с гипоксемией, а не у пациентов с более легкой формой заболевания. Данные не подтверждают использование дексаметазона или других кортикостероидов в амбулаторных условиях.
Дексаметозон при ковиде
Кортикостероиды, такие как гидрокортизон и дексаметазон, обладают противовоспалительным, антифибротическим и сосудосуживающим действием, которые специалисты по интенсивной терапии десятилетиями пытались использовать для улучшения состояния пациентов с острым респираторным дистресс-синдромом и септическим шоком. В то время как ранние данные наблюдений из Китая предполагали потенциальное повышение смертности кортикостероидов при COVID-19, в предыдущих исследованиях кортикостероидов при других вирусных пневмониях, особенно тяжелом остром респираторном синдроме (SARS) и ближневосточном респираторном синдроме (MERS), обнаружили связь с отсроченным клиренсом вируса и усиленные опасения, что кортикостероиды могут ухудшить реакцию хозяина на SARS-CoV-2
Рандомизированная оценка терапии COVID-19 (RECOVERY), многоцентровое рандомизированное открытое исследование с участием госпитализированных пациентов с COVID-19, показало, что смертность от COVID-19 была ниже среди пациентов, которые были рандомизированы для приема дексаметазона, чем среди тем, кто получил стандартную помощь. В рекомендациях Центров США по профилактике и контролю заболеваний (CDC) рекомендуется отказаться от терапии кортикостероидами при коронавирусных инфекциях, поскольку стероиды «продлевают репликацию вируса » у пациентов с MER, хотя разница во времени до выведения вируса не была статистически значимой в первичных данных.
Хорошо или плохо?
Метаанализ результатов испытаний при стресс респираторным синдромом показал, что по сравнению с плацебо терапия кортикостероидами снижает риск общей смертности. Никаких преимуществ от дексаметазона не наблюдалось у пациентов, которым не требовался дополнительный кислород при включении.
Кортикостероиды отличные от дексаметозона
Побочные эффекты дексаметозона
Взаимодействие дексаметозона с другими препаратами
Дексаметазон является умеренным индуктором цитохрома P450 (CYP) 3A4. Таким образом, он может снизить концентрацию и потенциальную эффективность сопутствующих лекарств, которые являются субстратами CYP3A4. Клиницисты должны пересмотреть схему приема лекарств пациента, чтобы оценить возможные взаимодействия. Совместное применение ремдезивира и дексаметазона официально не изучалось, но клинически значимое фармакокинетическое взаимодействие не прогнозируется.
Период полувыведения, продолжительность действия и частота приема варьируют в зависимости от кортикостероидов.
Кортикостероид длительного действия : дексаметазон; период полувыведения: от 36 до 72 часов, применять один раз в день. Кортикостероиды средней продолжительности действия : преднизон и метилпреднизолон; период полувыведения: от 12 до 36 часов, применять один раз в день или в два приема ежедневно. Кортикостероид короткого действия : гидрокортизон; период полувыведения: от 8 до 12 часов, вводить в два-четыре приема ежедневно.
Дексаметозон при беременности
Короткий курс приема бетаметазона и дексаметазона, которые, как известно, проникают через плаценту, обычно используется для уменьшения неонатальных осложнений недоношенности у женщин с угрозой преждевременных родов.
Дексаметозон у детей
Дексаметазон может быть полезен для педиатрических пациентов с респираторным заболеванием COVID-19, которым требуется искусственная вентиляция легких. Использование дексаметазона у пациентов, которым требуются другие формы дополнительной кислородной поддержки, следует рассматривать в индивидуальном порядке и, как правило, не рекомендуется для педиатрических пациентов, которым требуется только низкий уровень кислородной поддержки (например, только назальная канюля).
Исходная тяжесть ковида и эффективность дексаметозона
Расширенный курс кортикостероидов
В настоящее время расширенный курс кортикостероидов сверх 10 дней рассматривается только в отдельных случаях тяжелой формы COVID-19.3 Одним из аргументов в пользу длительного лечения является профилактика фиброза после заболевания у пациентов с COVID-19, для которых могут быть установлены факторы риска фиброза легких. Однако при COVID-19 такой продолжительный курс кортикостероидов может непреднамеренно привести к плохим результатам лечения. Следует учитывать возможное влияние стероидов в прокоагулянтной среде пациентов с COVID-19, когда даже антикоагулянтная терапия недостаточно защищает от тромботических осложнений, обнаруживаемых у умерших пациентов. Состояние гиперкоагуляции с глубоким повреждением эндотелия после инфицирования коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2) играет важную роль в развитии тромбоза. В исследованиях аутопсии пациентов с COVID-19 были замечены диффузные альвеолярные нарушения с тромбами крупных сосудов и микротромбами. Дексаметазон (6 мг в день) демонстрирует тенденцию увеличивать концентрацию фактора свертывания и фибриногена. Кроме того, длительная кортикостероидная терапия может способствовать так называемому синдрому длительного COVID, который проявляется усталостью и психологическими симптомами, в которых могут иметь место побочные реакции на лекарства, связанные со стероидами, такие как миопатия, нервно-мышечная слабость и психиатрические симптомы. Начало терапии метилпреднизолоном более чем через 2 недели после начала острогореспираторного дистресс синдрома может увеличить риск смерти. Протромботическое влияние стероидов в сочетании с их побочными реакциями на лекарства могло способствовать увеличению смертности.
Кортикостероиды, таким образом, кажутся палкой о двух концах в борьбе с COVID-19, и их следует использовать разумно, учитывая соотношение риска и пользы, в качестве краткосрочного (например, до 10 дней) терапевтического средства в избранной группе. пациентов с COVID-19, у которых зарегистрировано улучшение выживаемости. Нет доказательств, подтверждающих долгосрочное использование стероидов у пациентов с COVID-19 для предотвращения потенциальных неблагоприятных последствий, таких как фиброз легких. Напротив, такой продолжительный курс стероидов мог быть вредным.
Высокие дозы глюкокортикоидов усугубляют гипергликемию у людей с диабетом, могут выявить недиагностированный диабет, а у лиц с риском диабета могут спровоцировать гипергликемию и впервые возникший диабет (обычно называемый «стероид-индуцированный диабет»). Кроме того, глюкокортикоиды являются наиболее частой причиной развития у людей с диабетом потенциально опасного для жизни гипергликемического гиперосмолярного состояния
Номидес капсулы 75 мг 10 шт ➤ инструкция по применению
Описание
Номидес является эффективным средством профилактики и лечения гриппа у взрослых и детей в возрасте старше 1 года. При начале лечения не позднее 40 ч после появления первых симптомов гриппа, Номидес значительно сокращает период клинических проявлений гриппозной инфекции, уменьшает их тяжесть и снижает частоту развития осложнений гриппа, требующих применения антибиотиков (бронхита, пневмонии, синусита, среднего отита), укорачивает время выделения вируса из организма.
После перорального приема осельтамивира фосфат легко всасывается в желудочно-кишечном тракте и в высокой степени превращается в активный метаболит под действием печеночных эстераз. Концентрации активного метаболита в плазме определяются в пределах 30 минут и достигают почти максимального уровня через 2-3 часа после приема. Не менее 75% принятой внутрь дозы попадает в системный кровоток в виде активного метаболита. Плазменные концентрации пропорциональны дозе и не зависят от приема пищи
Действующие вещества
Форма выпуска
Состав
Фармакологический эффект
Фармакокинетика
Показания
• Лечение гриппа у взрослых и детей в возрасте старше 1 года.
• Профилактика гриппа у взрослых и подростков в возрасте старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в больших коллективах, у ослабленных пациентов).
• Профилактика гриппа у детей старше 1 года.
Противопоказания
• Повышенная чувствительность к осельтамивира фосфату или любому компоненту препарата,
• Терминальная стадия почечной недостаточности (клиренс креатинина ≤10 мл/мин), тяжелая печеночная недостаточность,
• Детский возраст до 1 года
Применение при беременности и кормлении грудью
Способ применения и дозы
Препарат осельтамивир принимается внутрь, независимо от приема пищи или во время еды.
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания. Взрослые и подростки в возрасте ≥ 12 лет
Рекомендуемая суточная доза составляет 150 мг. Препарат назначают в дозе 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки внутрь в течение 5 дней.
Дети с массой тела более 40 кг или в возрасте ≥ 8 лет
Дети, которые умеют проглатывать капсулы, также могут получать лечение, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки в течение 5 дней.
Дети в возрасте ≥ 1 года Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
Масса тела Рекомендованная доза в течение 5 дней
≤15 кг: 30 мг два раза в сутки
>15-23 кг: 45 мг два раза в сутки
>23-40 кг: 60 мг два раза в сутки
Прием препарата необходимо начинать не позднее 2 суток после контакта с больными.
Взрослые и подростки в возрасте ≥ 12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки внутрь в течение не менее 10 дней после контакта с больным. Во время сезонной эпидемии гриппа – по 75 мг 1 раз в сутки в течение 6 недель. Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети с массой тела более 40 кг или в возрасте ≥ 8 лет
Дети, которые могут проглатывать капсулы, также могут получать профилактическую терапию, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 10 дней.
Дети в возрасте ≥ 1 года Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
Масса тела Рекомендованная доза в течение 10 дней
≤15 кг: 30 мг 1 раз в сутки
>15-23 кг: 45 мг 1 раз в сутки
>23-40 кг: 60 мг 1 раз в сутки
Дозирование в особых случаях
Пациенты с нарушением функции почек:
Больным с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У больных с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг два раза в сутки в течение 5 дней.
У больных с клиренсом креатинина от 10 до 30 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки в течение 5 дней. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина ≤10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Больным с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У больных с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки. У больных с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу осельтамивира до 30 мг через день. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого последующего нечетного сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней. Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина менее 10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с нарушением функции печени
Коррекции дозы при лечении и профилактике гриппа у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась.
Больные пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Больные с ослабленным иммунитетом (после трансплантации).
Для сезонной профилактики гриппа у больных с ослабленным иммунитетом в возрасте ≥1 года – в течение 12 недель, коррекции дозы не требуется.
Экстемпоральное приготовление суспензии Номидес® из капсул
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул или при наличии признаков «старения» капсул, необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (шоколадный сироп с нормальным содержанием сахара или без содержания сахара, мед, светло-коричневый сахар или столовый сахар, растворенный в воде, сладкий десерт, сгущенное молоко с сахаром, яблочное пюре или йогурт) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления.
Если пациентам требуется доза 75 мг, то необходимо следовать следующим инструкциям:
1. Держа одну капсулу 75 мг Номидес® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания (чтобы скрыть горький вкус) и хорошо перемешать.
3. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Если пациентам требуются дозы 30-60 мг, то для правильного дозирования необходимо следовать следующим инструкциям:
1. Держа одну капсулу 75 мг Номидес® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить в порошок 5 мл воды с помощью шприца с метками, показывающими количество набранной жидкости. Тщательно перемешать в течение 2 минут.
3. Набрать в шприц необходимое количество смеси из емкости согласно следующей таблицы.
Масса тела /Рекомендованная доза /Количество смеси Номидес® на 1 прием
≤15 кг / 30 мг / 2 мл
>15-23 кг / 45 мг / 3 мл
>23-40 кг / 60 мг / 4 мл
4. Во вторую емкость добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
5. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Данную процедуру следует повторять перед каждым приемом препарата.