что такое пельгеровская аномалия
Что такое пельгеровская аномалия
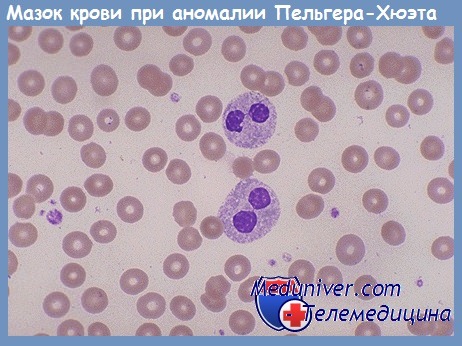
Нуклеарная аномалия Пельгера-Хюэта (Pelger-Huet) характеризуется уплотнением нуклеарного хроматина всех кровяных клеток и ингибицией сегментирования ядра в клетках, которые нормально представляют сегментированное или инцизированное ядро (гранулоциты, моноциты, мегакариоциты). Самой характерной клеткой является ней-трофил.
Передача аномалии Пельгера-Хюэта доминантная; проявление может быть гетерозиготным или гомозиготным. У гетерозиготов приостановление нуклеарного сегментирования неполная: большинство нейтрофилов, вместо того, чтобы представлять трехдольчатые ядра, бисегментировано, имея характерный даже патогномоничный аспект:
1) форма «очков» или «штанги»;
2) форма «переметной сумы» (подобно нормальному ядру эозинофилов);
3) «смешанная» форма (одна долька круглая, другая удлиненная).
У гомозиготов, приостановление сегментирования является тотальной, а нейтрофильные гранулоциты имеют совершенно круглое или слегка инцизированное ядро.
Случаи гетерозиготной аномалии Пельгера делятся на полные (типичные) и неполные (атипичные); при последних, кроме характерных клеток «Pelger», появляются и нейтрофильные клетки с нуклеарными сегментами, в определенной пропорции («разбавленная» разновидность, Kokubo).
Ebbing описал разновидность без типичных клеток «Pelger» но с лейкоцитарной формулой постоянно отклоненной «влево» бе» какой-либо видимой причины, а у здоровых единокровных родственников встречаются такие же модификации.
Кроме этих, так называемых «разбавленных», разновидностей, существуют случаи аномалии Пельгера со стремлением к «уплотнению», при которых, кроме типичных зрелых нейтрофилов, появляется определенное количество элементов с округлым инцизированным ядром и которые представляют несколько нитей хроматина, исходящих из борозды (вид граната)(разновидность «Stodtmeister»).
«Частичные» носители аномалии представляют, наряду с нормальной лейкоцитарной формулой, определенное, постоянное у того же субъекта, число типичных клеток «Pelger». Все эти носители являются гетерозиготами. С генетической точки зрения, этот вариант еще неуяснен.
Гомозиготное проявление аномалии Пельгера-Хюета было описано до сих пор в 5 случаях, из которых 4 считаются «типичными», а один, «атипичным», названный Undritz вариант Ciplea-Ciorapciu. В «типичных» случаях, более 90% периферических нейтрофилов имеют ядро круглое, «миэлоцитарного» или «эритробластического» вида. «Атипичный» случай, который описали Giplea и Giorapciu, представлял около 52% клеток с инцизированным ядром и 46% миэлоцитарного вида.
Эти морфологические аспекты ведут к досадным путаницам для больных и врачей. Гетерозиготная форма считается «лейкемоидной картиной» или даже «хронической миэлоидной лейкемией»; гомозиготная форма обычно рассматривается как хроническая гранулоцитарная лейкемия (случай Clipea) или как «эритробластоз» (случай Gingold).
Эту аномалию описал впервые Pelger в 1928 г., который полагал, что он открыл гематологический признак отягощения туберкулеза. В 1931 г. голландский педиатр Huet описал конституционный, семейный характер аномалии, a Schilling присвоил ей имя Pelger-Huet.
В 1938 г. Undritz обнаружил эту аномалию у кроликов, что позволило уточнить генетику аномалии и получение, путем скрещиваний, гомозиготных экземпляров. Предположение о том, что и у человека должны существовать случаи такой аномалии, подтвердилось в 1951 г., когда был обнаружен первый случай у человека.
В Венгрии, аномалия была представлена впервые Dudea и сотр. в 1956 г., а в 1957 г. Iliescu представил другой случай. В том же году Ciptea и Ciorapciu представили случай гомозиготной аномалии, третий в мировой литературе, который Undritz рассмотрел заново в 1974 г. и включил окончательно в группу случаев гомозиготной аномалии Пельгера-Гюета, как разновидность Чипля-Чорапчиу, единственно известный до сих пор случай такого рода.
Начиная с 1959 г., Gingold и сотр., систематически исследовали ряд семей с аномалией Пельгера-Гюета, которые подозревались до тех пор в ХМЛ, хронических инфекциях, а также и случаи псевдогомозиготной «псевдо-Пельгер» аномалии, присланные с диагнозом «эритробластоза», содействуя таким образом ознакомлению с этим заболеванием в нашей стране (Gingold).
Аномалия является асимптоматичной с клинической точки зрения. Для специалистов по этой аномалии невозможно никакое заблуждение и диагноз аномалии Пельгера-Гюета ставится без затруднений. Лишь незнание аномалии может создавать вышеуказанные заблуждения.
Однако в гематологической лаборатории встречаются довольно часто случаи, в которых констатируется наличие типичных гетерозиготных или гомозиготных клеток Пельгера, но которые являются не генотипичными, наследственными, а приобретенными, сопровождая самые разнообразные болезненные состояния. Они исчезают вместе с излечением или ремиссией болезни и не имеют семейного характера.
Механизм наследственной передачи аномалии Пельгера-Гюета еще не выяснен.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Пельгеровская аномалия лейкоцитов
Пельгеровская аномалия нейтрофилов – это доброкачественная наследственная патология, которая характеризуется морфологическим изменением лейкоцитов. Получила название в честь Карла Пельгера – голландского врача, впервые открывшего в 1928 году нетипичные нейтрофилы. Затем в 1932 году Хьюэтом была доказана наследственная природа заболевания. Поэтому в некоторых источниках болезнь называется аномалия Пельгера-Хьюэта. Встречается с частотой 1:1000-1500, одинаково часто у мужчин и женщин. Раньше встречалась редко, а в последнее время все чаще, что связано с более широкими обследованиями крови.
Причины
Причины данного заболевания не установлены. Известно, что аномалия передается по аутосомно-доминантному типу, проявляется и у гетерозигот, и у гомозигот в равной степени. В основе патогенеза лежит нарушение сегментации зрелых нейтрофилов. Генетическая поломка заключается в нарушении структуры регуляторного гена, отвечающего за форму ядра.
Клинические проявления
Клинически заболевание никак не выражается, так как функции лейкоцитов не нарушены. Лейкоциты также способны фагоцитировать чужеродные клетки, содержат набор ферментов, идентичный нормальным лейкоцитам. СОЭ не повышено, свертываемость крови нормальная. Часто данная патология обнаруживается случайно при исследовании крови. За счет того, что наблюдается нейтрофильный сдвиг влево в лейкоцитарной формуле, ошибочно можно предположить инфекцию. Реакции на кровопотерю, инфекцию и т.д. у людей с этой аномалией не отличаются от реакций здоровых людей.
По данным некоторых источников, могут быть изменения в костной системе: гиперкифоз, низкий рост, деформации скелета.
Картина крови
В мазках крови при микроскопировании наблюдаются аномальные нейтрофилы. Чтобы понимать, как они будут выглядеть при этом заболевании, необходимо разобраться, что представляют собой нормальные нейтрофилы.
По степени зрелости различают несколько форм нейтрофилов:
Ядро сегментоядерных нейтрофилов разделено перемычками на несколько сегментов. У остальных ядро бобовидное и несегментированное. У палочкоядерных ядро в виде подковы. В крови здоровых людей больше всего содержится сегментоядерных клеток с 3-4 сегментами (70%), с 2 сегментами меньше (30%), а палочкоядерных – около 7%. При аномалии Пельгера резко увеличивается число палочкоядерных клеток.
Все нейтрофилы, кроме сегментоядерных, относятся к юным. При увеличении в крови их количества на общем анализе крови будет виден лейкоцитарный сдвиг влево. Это говорит о повышенной активности костного мозга.
Причины нейтрофильного лейкоцитоза следующие:
Суть пельгеровской аномалии заключается в том, что зрелые нейтрофилы имеют форму ядра юных (миелоцитов и метамиелоцитов), а плотность хроматина и зернистость соответствуют зрелой клетке. Ядро может быть:
Грубоглыбчатость хроматина, комковатость ядра и короткие перемычки отличают их от миелоцитов. Форма сегментов одинаковая. Зернистость может быть как крупной и многочисленной, так и скудной и мелкой. Созревание цитоплазмы в норме. У женщин с этой аномалией отсутствуют тельца полового хроматина (тельце Барра).
Кроме нейтрофилов, изменения ядер затрагивают и базофилы, эозинофилы, лимфоциты и моноциты, но в нейтрофилах признаки более выражены.
Гипосегментированные нейтрофилы имеются и в периферической крови, и в костном мозге.
Диагностика
Диагностика основана на исследовании мазков крови в гематологических анализаторах. Оценивается зрелость ядра, состояние хроматина (у аномальных он плотный), соотношение нейтрофилов в крови. Чтобы уточнить диагноз, нужно провести анализ крови родителей, у которых будет похожая формула крови. Следует дифференцировать с хроническим миелолейкозом, при котором возрастает число юных нейтрофилов, а лейкоцитарные формулы обоих заболеваний схожи. При этом у больного пельгеровской аномалией в крови будет наличие характерных зрелых двусегментированных нейтрофилов, а количество лейкоцитов и остальных форменных элементов нормальное.
Кроме пельгеровской аномалии, являющейся врожденной, имеется приобретенная форма гипосегментации нейтрофилов. Встречается при остром и хроническом миелолейкозе, микседеме, малярии, гриппе, туберкулезе, эритромиелозе, инфекциях, системной красной волчанке, болезни Ходжкина. Часто возникает после проведенной химиотерапии и приема некоторых лекартсвенных средств (например, НПВС, сульфаниламидов). Отличается от аномалии тем, что является временным состоянием.
Лечение
Пельгеровская аномалия не требует лечения, так как функции крови сохранены в полном объеме. Ее носители считаются здоровыми людьми.
Важное значение имеет обследование детей на предмет выявления этой аномалии крови, так как соотношение клеточного состава не подвергается значительным изменениям в течение жизни. Обнаружение аномалии помогает избежать неправильной диагностики многих заболеваний, дающих аналогичную картину крови.
Дифференцированный подсчет лейкоцитов (лейкоцитарная формула) с анализом аномалий морфологии лейкоцитов
Материал для исследования: Кровь с антикоагулянтом (ЭДТА)
Метод исследования: Микроскопический
Подготовка: Кровь из вены необходимо сдавать утром натощак, после 8-12 часового голодания до проведения физиопроцедур, УЗИ, эндоскопического и рентгеновского исследования. Накануне и в день сдачи крови следует исключить интенсивную физическую нагрузку, прием алкоголя, курение. Допускается пить воду.
Описание: Микроскопическое исследование сухих фиксированных и окрашенных мазков крови с дифференцировкой различных форм лейкоцитов и оценкой их морфологических особенностей.
В окрашенном мазке производится подсчет лейкоцитарной формулы, выявляются особенности лейкоцитов – патологическая зернистость и гипогрануляция нейтрофилов, пельгеровская аномалия, клетки лизиса, атипичные мононуклеары, лейкозные бласты и др. Кроме того, в мазке могут быть выявлены специфические морфологические особенности эритроцитов и тромбоцитов, что облегчает постановку диагноза гематологического заболевания.
Показания для проведения исследования:
скрининговые обследования в рамках профилактического, диспансерного наблюдения
базовые обследования для госпитализации
диагностика воспалительных, инфекционных заболеваний
диагностика болезней системы крови
мониторинг проводимой терапии и течения различных заболеваний
Референсные значения в соответствии с полом и возрастной группой указаны в бланке анализа.
Повышение уровня нейтрофилов:
острые бактериальные инфекции
воспаление или некроз ткани (ожоги, инфаркты органов, травмы)
эндогенные интоксикации (уремия, ацидоз, подагра)
миелопролиферативные заболевания (эритремия, хронический миелолейкоз)
острые постгеморрагические анемии
физиологический перераспределительный лейкоцитоз (шок, стресс, боль, беременность, горячие и холодные ванны, физическая нагрузка)
Снижение уровня нейтрофилов:
гипоплазия кроветворения (действие цитостатиков, ионизирующей радиации, острые лейкозы, мегалобластные анемии, наследственная доброкачественная нейтропения);
повышенное разрушение, связанное с иммунными причинами (гиперчувствительность к лекарственным препаратам, СКВ, ревматоидный артрит)
повышенное разрушение при спленомегалии (лимфома, портальная гипертензия)
Повышение уровня эозинофилов:
опухоли (гемобластозы и другие злокачественные новообразования)
аллергические заболевания (лекарственная аллергия, бронхиальная астма, аллергические дерматиты)
болезни соединительной ткани (узелковый переартериит, ревматоидный артрит)
Снижение уровня эозинофилов:
тяжелые гнойные инфекции;
Повышение уровня базофилов:
миелопролиферативные заболевания (хронический миелолейкоз, миелофиброз, эритремия)
Повышение уровня моноцитов:
грануломатозы (туберкулез, бруцеллез, саркоидоз, язвенный колит, энтерит)
болезни крови (острые монобластный и миеломонобластный лейкозы, лимфогранулематоз, гистиоцитозы)
коллагенозы (СКВ, ревматоидный артрит)
опухоли (рак, саркома, миеломная болезнь)
Снижение уровня моноцитов:
Повышение уровня лимфоцитов:
вирусные, протозойные, хронические бактериальные инфекции
Снижение уровня лимфоцитов:
заболевания, связанные с повышением уровня кортикостероидов в плазме
острая лучевая болезнь
Наличие плазматических клеток:
Плазматические клетки в норме отсутствуют. Они появляются при ряде вирусных инфекций (корь, краснуха, ветряная оспа, инфекционный мононуклеоз, инфекционный гепатит), длительной персистенции антигена (сывороточная болезнь, хронический сепсис, туберкулез, коллагенозы, аутоиммунные болезни).
Наличие атипичных мононуклеаров:
Атипичные мононуклеары являются бласттрансформированными лимфоцитами, появляющимися в крови при напряжении клеточного иммунитета. В норме их количество не превышает 6% от общего числа лейкоцитов. Уровень атипичных мононуклеаров повышается при вирусных заболеваниях (инфекционный мононуклеоз, корь, краснуха, ветряная оспа, грипп, ЦМВ), аллергических реакциях, вакцинации, аутоиммунных заболеваниях, а также при наличии новообразований.
Что такое пельгеровская аномалия
Гранулоциты крови включают в себя нейтрофильные лейкоциты, а также эозинофилы и базофилы. Как известно, доминирующей популяцией гранулоцитов в периферической крови являются нейтрофильные лейкоциты, диапазон содержания которых в периферической крови постоянно изменяется и составляет в настоящее время в среднем от 47 до 75 % в лейкоцитарной формуле.
Менее представительной популяцией клеток гранулоцитарного ряда в периферической крови являются эозинофилы, относительное содержание которых в лейкоцитарной формуле колеблется от 1 до 5 %.
И крайне скромно представлено содержание в крови базофилов, максимальный уровень которых составляет не более 1–2 %.
Касаясь морфологических особенностей нейтрофилов и их биологической значимости следует отметить, что эти клеткиотносят к категории полиморфноядерных лейкоцитов, созревание которых в костном мозге сопряжено со значительными изменениями структуры, метаболизма и свойств. Динамика морфологических изменений заключается в постепенном уменьшении ядра с увеличением цитоплазматически-ядерного отношения, исчезновением ядрышек, сегментацией ядер нейтрофилов. Зрелые сегментоядерные нейтрофилы задерживаются в синусах костного мозга в течение 3–4 дней. Количество депонированных в синусах костного мозга нейтрофилов превышает число циркулирующих клеток в 10–20 раз. Изменение процентных взаимоотношений между циркулирующими и депонированными нейтрофилами лежит в основе всех перераспределительных лейкоцитозов и лейкопений. Одна из отличительных характеристик этих реакций является их кратковременность, наличие четкого этиологического фактора, отсутствие изменений функциональной активности гранулоцитов. Время их нахождения в кровеносном русле очень мало (в среднем 6–8 часов), так как эти клетки быстро мигрируют в ткани. Покинувшие сосудистое русло нейтрофилы в кровоток не возвращаются и разрушаются в тканях. Часть нейтрофилов удаляется из организма через желудочно-кишечный тракт.
Зрелые сегментоядерные нейтрфилы представляют собой клетки округлой формы, диаметром 7–12 мкм. Ядро клеток состоит из 3–4 сегментов, соединенных тонкими нитями хроматина. При окраске по Романовскому ядро окрашивается в сине-фиолетовый цвет, а цитоплазма – в розовый.
У нейтрофилов мало митохондрий, рибосом, комплекс Гольджи невелик, эндоплазматический ретикулум редуцирован. Главный источник энергии – гликоген, основная форма метаболизма – гликолиз. В процессе фагоцитоза и метаболического респираторного взрыва при участии гексозомонофосфатного шунта потребляется до 30 % метаболизированной глюкозы. Кратковременность существования нейтрофилов (до 4-х суток) обусловлена генетически детерменированным апоптозом.
У практически здоровых людей иногда выявляются и врожденные изменения структуры ядра нейтрофилов, среди них отмечают наличие так назывемой пельгеровской аномалии лейкоцитов, характеризующейся преобладанием нейтрофилов с двухлопастным ядром, а также наличием клеток с недостаточно четко разграниченными сегментами ядра, напоминающим палочкоядерные нейтрофилы. Пельгеровская аномалия – часто встречающийся гематологический признак; наблюдается у одного из 1000 человек. Аномалия наследуется по доминантному типу. Значительно реже встречается врожденная гиперсегментация ядер нейтрофилов, при которой в ядрах имеется более 5 сегментов. Описан врожденный макроцитоз нейтрофилов, когда средний размер клетки составляет около 17 мкм. При всех этих изменениях функциональная активность нейтрофилов существенно не изменяется, и аномалии обнаруживаются случайно.
В цитоплазме нейтрофилов содержится большое количество мелких гранул двух типов. Первичные гранулы составляют 30 % всех гранул, содержат набор ферментов, главным обазом гидролитических, и являются типичными лизосомами. Лизосомы характеризуются высоким содержанием миелопероксидазы, катионных белков, мукополисахаридов. В лизосомах локализована примерно 1/3 лизоцима, обеспечивающего деполимеризацию мукополисахаридов бактериальных клеток, способствующего последующему гидролитическому расщеплению бактерий при участии лизосомальных ферментов. В случае развития фагоцитоза нейтрофилы активно выделяют содержимое лизосом в окружающую среду, где проявляются эффекты лизосомальных гидролаз. Вторичные гранулы образуют типичную специфическую зернистость нейтрофилов и содержат гликоген, липиды, ряд ферментов, а также лизоцим.
Характерной особенностью метаболизма нейтрофилов является их способность получать энергию за счет анаэробного гликолиза, что обеспечивает их функции даже в крайне неблагоприятных условиях (в тканях, бедных кислородом, воспалительных, отечных, плохо кровоснабженных). Основным субстратом для гликолиза в нейтрофильных лейкоцитах является глюкоза, в меньшей степени – галактоза и фруктоза, а также гликоген. Расщепление глюкозы в нейтрофилах может осуществляться по пентозофосфатному пути. Роль дыхания в жизнедеятельности нейтрофилов невелика. В нейтрофилах имеется достаточный набор ферментов гликолиза, пентозо-фосфатного окисления глюкозы, причем энергия гликолиза используется для реализации фагоцитарной и двигательной активности, а пентозофосфатный путь окисления глюкозы играет роль в обеспечении реакций синтеза жирных кислот. Последние, как и углеводы, используются нейтрофилами в качестве источников энергии.
Нейтрофильные лейкоциты, наряду с друими лейкоцитарными элементами, являются центральным звеном неспецифической резистентности организма. От их деятельности зависит интенсивность фагоцитоза и продукция гумолальных неспецифических факторов защиты – комплемента, лизоцима, интерферона, обеспечивающих бактерицидную активность сыворотки крови, а также миелопероксидазы, лактоферрина, катионных белков.
Способность к фагоцитозу нейтрофильных лейкоцитов обусловлена рядом особенностей, в частности высокой двигательной активностью. Нейтрофилы первыми прибывают в место повреждения тканей за счет целенаправленного движения клеток к объектам фагоцитоза (хемотаксис).
Амебовидная подвижность обусловлена образованием «двигательных» псевдоподий, а также, по данным электронно-микроскопических исследований, наличием в нейтрофильных лейкоцитах актомиозиновых структур.
Направленное движение индуцируется рядом хемотаксических факторов или соединений. Значительная их часть выделяется бактериями. Эти факторы могут иметь различную молекулярную массу от 2000 до 60000 D. Хемотаксические факторы с низкой молекулярной массой оказывают непосредственное хемотаксическое действие на нейтрофилы. Факторы с большой молекулярной массой опосредуют хемотаксический эффект через сывороточные белки (кофакторы). Хемотаксической активностью обладают и некоторые продукты разрушения клеток, а также кинины, каллекреины, пептиды, образующиеся при расщеплении третьего (С3) и пятого (С5) компонентов комлемента. Хемотаксические факторы вызывают уменьшение отрицательного заряда поверхности нейтрофила, что облегчает их адгезию и агглютинацию.
Активированный нейтрофил имеет около 120 000 рецепторов для Fc-фрагмента IgG, формирующих кластеры на клеточной поверхности и около 40 000 рецепторов для фракции комплемента (С3в). Некоторые частицы могут прикрепляться к поверхности фагоцита без участия этих рецепторов.
Реакции фагоцитоза неразрывно связны с деятельностью кислородзависимы антимикробных систем, сопровождаются увеличением поглощения кислорода и выработкой перекиси водорода, супероксид-анион-радикала, гидроксильных радикалов. Активность данной системы киллинга бактерий сопряжена с ферментом миелопероксидазой.
Существуют также кислороднезависимые антимикробные системы, проявляющие бактерицидное действие в фагосомах при отсутствии кислорода. К компонентам этой системы относятся: закисление среды, лизоцим, лактоферрин, катионные белки и некоторые другие соединения.
Касаясь характеристики лизоцима, необходимо отметить, что это низкомолекулярный катионный белок, расщепляющий В-гликозидные связи мукополисахаридов, обладает сильным антимикробным действием в отношении многих бактерий, а особенно грамположительных. В нейтрофильных лейкоцитах лизоцим не синтезируется, а только депонируется.
Наряду с фагоцитозом защитная функция нейтрофилов обеспечивается выделением в окружающую среду лизосомальных энзимов с гидролитическими свойствами, катионных белков, молочной кислоты, которое оказывают бактериостатическое и бактериолитическое действие, участвуют в разрушении поврежденных при воспалении тканей и клеток организма.
Участие нейтрофильных лейкоцитов в механизмах неспецифической резистентности обеспечивается и фактором противовирусной защиты – интерфероном.
Помимо противовирусного эффекта интерферон оказывает антипролиферативное и противоопухолевое действие, подавляет бласттрансформацию лимфоцитов и выработку антител, а также активизирует макрофаги, усиливает цитотоксичесое действие сенсибилизированных лимфоцитов. Одновременно его можно рассматривать и в качестве медиатора иммунного ответа.
В нейтрофильных лейкоцитах обнаружены соединения, являющиеся производными арахидоновой кислоты, получившие название лейкотриены. Лейкотриены оказывают выраженное влияние на течение иммунных процессов, являются важнейшими медиаторами воспаления, стимулируют продукцию анионов супероксида, освобождение лизосомальных ферментов, повышают сосудистую проницаемость.
В последние годы обсуждается участие нейтрофилов в регенераторных проессах и, соответственно, наличие у них репаративной функции. Не менее важным является участие нейтрофильных лейкоцитов в гемостатических реакциях организма. Известно, что нейтрофилы обладают способностью активировать контактную фазу процесса свертывания крови, так как содержат кининазы и ферменты, стимулирующие кининогенез. Нейтрофильные лейкоциты легко вступают во взаимодействие с кининогеном и XII фактором, что способствует освобождению из гранул эластазы. В то же время нейтрофильная эластазоподобная протеаза значительно тормозит процесс свертывания крови, а катепсин С при длительной инкубации инактивирует XII фактор.
Нейтрофилы являются одним из источников синтеза транскобаламина – белка, связывающего витамин В12.
Нейтрофилопоэз. В условиях нормы содержание нейтрофильных лейкоцитов в периферической крови составляет от 2300 до 4500 в 1 мкл3. В первые сутки после рождения ребенка отмечается лейкоцитоз (15 000–30 000 в 1 мкл3), содержание нейтрофилов составляет около 65 %. К концу первого года жизни количество нейтрофилов в крови достигает миниума, после чего вновь возрастает и достигает значений взрослого человека к периоду полового созревания (13–15 годам).
Период созревания нейтрофилов в костном мозге составляет 8–14 суток, в то время как первоначальная фаза созревания нейтрофилов от миелобласта до метамиелоцита продолжается 6 суток. Дальнейшие этапы постмитотического созревания могут продолжаться до 14 суток, когда нейтрофилы приобретают способность к адгезии, фагоцитозу, а на их мембране появляются рецепторы к хемотоксинам. Ежедневно из костного мозга в кровоток поступает 1010 нейтрофилов. В крови содержится около 6×1010 нейтрофилов, в равной мере рапределенных между циркулирующим и маргинальным пулом. Содержание нейтрофилов в 1 мкл в норме составляет 3500 клеток, уменьшение их количества ниже 500 в 1 мкл приводит к развитию иммунодефициту и инфекции. Полупериод циркуляции нейтрофилов в крови 6 часов, после чего они мигрируют в ткани и в кровь не возвращатся.
Касаясь участия нейтрофилов в метаболизме тканей и межклеточном взаимодействии, необходимо отметить, что нейтрофилы располагают большим количеством кислых гидролаз, способных разрушить коллаген, эластин, фибриноген, фибрин, способны продуцировать IL-1, IL-3, IL-8, TNFα, колониестимулирующие факторы.
Нейтрофилы способны взаимодействовать с клетками разного типа: эозинофилами, фибробластами, базофилами, тучными клетками, секретируют сигнальные молекулы.
В функциональном отношении нейтрофилы представляют собой гетерогенную популяцию: различают нативные (покоящиеся) нейтрофилы, праймированные, подготовленные к последующей активации и активированные. Праймированные лейкоциты интенсивно продуцируют свободные радикалы и цитокины (TNFα, IL-8), обладают выраженным повреждающим действием на различные органы и ткани за счет активации фосфолипазы А2.
Морфологические и фукциональные особенности эозинофилов
У здоровых лиц количество циркулирующих в периферической крови эозинофилов составляет 0–5 % и не превышает 1 % от общего количества эозинофилов, содержащегося в костном мозге и периферических тканях. Кровь для них, как и для других видов лейкоцитов, является лишь транспортной системой. Основные функциональные свойства эозинофилов реализуются вне кровотока в периферических тканях.
Для эозинофильных лейкоцитов характерно наличие суточных колебаний, что связано с уровнем секреции глюкокортикоидов корой надпочечников. Установлено, что максимальное их количество в крови отмечается в утренние часы, а минимальное количество – в вечернее время.
Стимуляторами продукции эозинофилов в костном мозге являются IL-3 и IL-5, эозинофилы проходят те же стадии развития, что и нейтрофилы.
Эозинофилы созревают в костном мозге в течение 24 часов, а затем в течение 3–4 суток зрелые эозинофилы остаются в костном мозге. По мере созревания клеток уменьшается ядро, исчезают ядрышки, увеличиваются количество и размеры эозинофильных гранул, повышается активность многих гидролитических ферментов.
Выходящие в кровоток эозинофилы циркулируют там не более 5 часов и постепенно переходят в ткани. Максимальное их количество обнаруживается в подслизистом слое желудочно-кишечного тракта. Повторно в кровоток они не возвращаются, разрушаются в тканях и выделяются через желудочно-кишечный тракт.
Эозинофилы имеют округлую форму, диаметр в пределах 12 мкм, ядро двулопастное, цитоплазма почти полностью заполнена специфическими гранулами, которые окрашиваются в ярко-красный или оранжевый цвет при окраске по Романовскому. Гранулы содержат в большом количестве пероксидазы, β-глюкоронидазу, а также полисахариды, аминокислоты, кислую фосфатазу и могут рассматриваться как лизосомы.
Эозинофильные гранулы содержат особую группу бактерицидных веществ, в частности эозинофильный катионный протеин, белковые кристаллы Шарко-Лейдена. Последние имеют вытянутую шестиугольную форму и обладают активностью лизофосфолипазы, подавляющей повреждающее действие некоторых лизофосфолипидов на ткани.
Основную часть энергии для жизнедеятельности эозинофилы получают в результате аэробного и анаэробного гликолиза. В качестве энергетического субстрата используется глюкоза, ее метаболизм осуществляется гликолитическим путем и выделяемая энергия утилизуется в виде АТФ, креатифосфата и гликогена.
Установлено повышение количества эозинофилов в крови (за пределы суточных колебаний – эозинофилия) при различных аллергических реакциях, глистных инвазиях и аутоиммунных заболеваниях, что указывает на роль эозинофильных лейкоцитов в развитии воспалительных, иммуноаллергических реакций организма, гиперчувствительности немедленного и замедленного типов, причем установлена максимальная концентрация эозинофилов в тех тканях, которые являются местом развития вышеуказанных реакций.
Функции эозинофилов обеспечиваются, прежде всего, их способностью к амебовидному перемещению под действием различных хемотаксических факторов, образующихся при сенсибилизации и аллергизации организма. Ряд факторов освобождается из гранул базофилов и тучных клеток. Они называются эозинофильными хемотаксическими факторами анафилаксии. Вторая группа соединений, вызывающих хемотаксис эозинофилов, выделется Т-лимфоцитами при их взаимодействии с макрофагами. Установлена способность сегментоядерных нейтрофилов выделять стимулятр хемотаксиса эозинофилов. Определенной хемотаксической активностью обладает также гистамин.
Таким образом, хемотаксис эозинофилов приводит к их скоплению в очагах воспаления, в местах развития иммунологических реакций, где они принимают участие в метаболизме гистамина. Эозинофилы обладают способностью фагоцитировать гранулы с гистамином, выделяемые тучными клетками и базофилами. Кроме того эозинофилы содержат фермент гистаминазу с высокой активностью, вызывающую инактивацию поглощенного гистамина. Есть данные, что эозинофилы обеспечивают также простой транспорт гистамина к органам выделения. В эозинофилах обнаружен фактор, тормозящий выделение гистамина из базофилов и тучных клеток.
В участках воспаления эозинофилы обеспечивают инактивацию брадикинина и ряда других биологически активных вещест. Таким образом, за счет функциональных особенностей эозинофилы предотвращают развитие воспалительных и аллергических реакций.
Следующая функция эозинофилов – их способность к фагоцитозу в отношении микробных клеток, комплексов антиген-антитело, благодаря чему они рассматриваются в роли микрофагов наряду с нейтрофильными лейкоцитами. Бактерицидное действие эозинофилов не является идентичным таковому у нейтрофилов, хотя оно также связано с активацией пероксидазы, усилением окисления глюкозы, утилизации кислорода и т.д.
Эозинофилы принимают участие в процессах свертывания крови и фибринолиза в связи со способностью синтезировать плазминоген.
Миграция эозинофилов в кровь при воспалении регулируется в основном IL-5, адгезию вызывают IL-1, TNF, IL-4, индуцирующие экспрессию эндотелиальных адгезивных молекул.
Морфологические и функциональные особенности базофилов
Базофилы представляют собой наименьшую популяцию гранулоцитов периферической крови и костного мозга; их содержание в крови взрослых лиц составляет 0–1 %. Созревание базофилов в костном мозге занимает около 1,5 суток. В течение нескольких суток зрелые базофилы депонируются в синусах костного мозга и в периферическую кровь выходят через 2,5–7 дней. В периферической крови базофилы циркулируют в среднем около 6 часов.
Зрелый базофил – клетка с диаметром 8–10 мкм, ядро неправильной формы или трехлопастное, цитоплазма имеет голубоватую окраску, но она заполнена гранулами пурпурного цвета, занимающими всю цитоплазму. Гранулы очень богаты гистамином, содержат половину гистамина, находящегося в периферической крови. В гранулах также содержатся в большом количестве мукополисахариды, среди которых различают гепарин, гиалуроновую кислоту и небольшое количество гликогена.
Продукция энергии в базофилах осуществляется главным образом за счет окислительного фосфолирирования, процессы которого обеспечиваются высоким содержанием в базофилах митохондрий и окислительных ферментов.
Функции базофилов связывают с их участием в аллергических и воспалительных реакциях за счет содержания в них биологически активных веществ, в частности, гистамина и гепарина.
Дегрануляция и освобождение гистамина из базофилов осуществляется под воздействием гуморальных факторов, в частности иммуноглобулинов Е, реже G. На мембране базофила имеется от 30 000 до 100 000 рецепторов для IgE, причем от 10 000 до 40 000 этих рецепторов могут фиксировать на себе IgЕ с помощью Fc-фрагмента. Процесс дегрануляции может осуществляться и под действием неиммуных факторов, в частности ц-3,5-АМФ. Уменьшение содержания его в клетках сопровождается освобождением внутриклеточного гистамина.
В сенсибилизированном организме дегрануляция базофилов происходит в кровеносном русле, в костном мозге, тканях, что определяет клинику крапивницы, сенной лихорадки и других аллергических заболеваний.
Рассматривая роль базофилов в развитии гиперчувствительности немедленного и замедленного типов, необходимо отметить их способность к направленному движению, что обеспечивает их поступление в зоны иммунологических реакций.
Важнейшими хемотаксическими факторами базофилов являются лимфокины, выделяемые сенсибилизированными Т-лимфоцитами.
Базофильные лейкоциты обладают также способностью к фагоцитозу, хотя данная функция и не является ведущей. Описана способность базофилов захватывать частички и сенсибилизированные эритроциты с формированием фагосомы.
Базофилы могут оказывать влияние на системы свертывания крови и фибринолиза. В базофилах содержатся ряд прокоагулянтных факторов, калликреин, вазоактивные амины.
В то же время гепарин является антикоагулянтом, обеспечивающим наряду с антитромбином III около 85 % всей антикоагулянтной активности крови.
Следующая не менее важная функция базофилов – это их участие в регуляции жирового обмена, так как выделяющийся при дегрануляции базофилов гепарин способен активировать липопротеиновую липазу, регулирующую расщепление В-липопротеидов.
Анализируя в целом биологическую значимость гранулоцитов периферической крови, следует прежде всего отдать должное фагоцитарной активности нейтрофилов, обеспечивающих не только развитие неспецифической резистентности против пиогенной микрофлоры, но и формирование синдрома системного воспалительного ответа с участием эндокринной, иммунной систем, а также ряда внутренних органов и тканей. В то же время базофильные лейкоциты, носители значительного количества вазодилататорных субстанций, играют важную роль в развитии локальных и системных гиперергических воспалительных реакций. Между тем эозинофилы, выполняя определенную фагоцитарную функцию, обеспечивают в значительной мере инактивацию многих медиаторов альтерации.