что такое паклитаксел и карбоплатин
Комбинация паклитаксел/карбоплатин по сравнению с комбинацией гемцитабин/паклитаксел при распространенном немелкоклеточном раке легкого: рандомизированное испытание по фазе III
Опубликовано в журнале: Journal of Clinical Oncology, 20: 3578-3585 (2002)
П. Космидис, Н. Миланакис, К. Николаидес, К. Калофонос, Э. Саманас, Дж. Буковинас, Дж. Фоунтцилас, Д. Скарлос, Т. Экономопулос, Д. Царваридис, П. Папакостас, К. Баконионис и М. Димопулос от Греческой кооперативной группы по онкологии (HeCOG)
Цель исследования.
Мы провели настоящее рандомизированное испытание по сравнению активности и токсичности комбинации паклитаксел/гемцитабин (ПГ) и комбинации паклитаксел/карбоплатин (ПК) для лечения распространенного немелкоклеточного рака легкого (НМРЛ).
Больные и методы.
Ранее не получавшие химиотерапии больные были рандомизированы на введение паклитаксела в дозе 200 мг/м 2 в первый день, плюс карбоплатин до значения AUC 6 в первый день (группа А), или на паклитаксел, как указано выше, плюс гемцитабин (1000 мг/м 2 в дни 1-й и 8-й (группа Б). Курсы повторяли каждые 3 недели. Ретроспективный анализ затрат был проведен с использованием критерия t Стьюдента для сравнения независимых групп.
Результаты.
В испытание было включено 509 больных (252 больных в группе А и 257 больных группе Б); все характеристики были хорошо сбалансированы. Медианное время выживаемости составляло 10,4 месяца (95%-ный доверительный интервал [ДИ] от 8,8 до 12 месяцев) для группы А и 9,8 месяцев (95%-ный ДИ от 8,0 до11,7 месяца) для группы Б (Р=0,32). Соответствующая выживаемость на срок в 1 год составляла 41,7 и 41,4%. Процент ответа для группы А составлял 28,0% (2% больных, давших полный ответ, ПО, 26% больных с частичным ответом, ЧО, 95%-ный ДИ от 22 до 34%). Процент ответа для группы Б составлял 35,0% (5% ПО, 30% ЧО, 95%-ный ДИ от 29 до 41%) (Р=0,12). Токсичность была незначительной. Нейтропения степени 3/4, тромбоцитопения и анемия отмечались у 15 и 15%, 2 и 1%, 5 и 2% для групп А и Б соответственно. Средние общие затраты (на визиты в амбулаторию и оплату препаратов для химиотерапии) составляли для группы А 7612,64 евро, а для группы Б 7484,77 евро. Различие не было статистически достоверным (Р 2 в день 1 в форме 3-часового внутривенного вливания с последующим введением карбоплатина до AUC 6 (в соответствии с формулой Кальверта) в форме 1-часового внутривенного вливания. В группе Б больные получали паклитаксел в тех же дозах и форме введения, после чего вводился гемцитабин в дозе 1000 мг/м 2 в форме 30-минутного внутривенного вливания в дни 1-й и 8-й каждого курса. Паклитаксел всегда вводили до карбоплатина или гемцитабина, используя следующую схему премедикации и профилактики рвоты: дексаметазон в дозе 20 мг перорально за 12 часов и внутривенно за 1 час до паклитаксела; димедрол в дозе 50 мг внутривенно за 30 минут до паклитаксела и циметидин (300 мг внутривенно) за 30 минут до паклитаксела. Кроме того, за 15 минут до химиотерапии вводили 16 мг ондансетрона внутривенно с последующим пероральным приемом в дозе по 8 мг на протяжении последующих 3 дней.
Лечение повторяли каждые три недели. Если у больного не было прогрессирующего заболевания, лечение продолжали в течение шести курсов. Если больной давал ответ, лечение продолжали по усмотрению врача. Больные со стадией IIIa и IIIb, давшие ответ на химиотерапию, получали после испытания местную лучевую терапию.
Модификации лечения
Для больных, не достигших восстановления картины крови на запланированный день лечения, полное содержание форменных элементов крови определяли два раза в неделю до достижения абсолютного содержания нейтрофилов, равного 2000/мкл и содержания тромбоцитов 1000000/мкл. Если гематологического восстановления по- прежнему не происходило к 35 дню, больную снимали с испытания. Больные также снимались с испытания, если у них появлялась симптоматическая аритмия или атриовентрикулярная блокада (за исключением блокады степени I), нейротоксичность степени 3 или гепатотоксичность степени 4, которые персистировали в течение 15 дней. Эти модификации, необходимые для безопасности наших больных, следовали из предыдущего опыта применения протоколов в нашей группе.
Исходные оценки и оценки в ходе лечения
Стадирование заболевания и ответ на лечение проводили путем клинического обследования, рентгена грудной клетки и компьютерно-томографического сканирования (получение КТ-скана). Исходная оценка включала получение полной истории болезни, физическое обследование, определение полного содержания форменных элементов крови и биохимического анализа крови. Опухоль, измеримая по двум осям, определяли с помощью методов визуализации (рентген грудной клетки, ультразвуковое исследование, КТ-сканирование, визуализация с помощью магнитного резонанса). КТ-сканирование в абдоминальной области, ультразвуковое исследование печени и надпочечников и сканирование костного скелета проводилось по усмотрению лечащего врача. Измерения опухоли для определения ответа на лечение выполнялись, по крайней мере, один раз в 6 недель; рентген грудной клетки повторяли раз в 3 недели.
Все гистопатологические стекла анализировались одной и той же группой патологов (связанной с больницами, участвовавшими в HeCOG).
Удовлетворявшие критериям участия больные, получившие, по крайней мере, два курса комбинированной химиотерапии, считались пригодными для оценки на ответ.
Удовлетворявшие критериям больные, получившие, по крайней мере, один курс химиотерапии, считались пригодными для оценки на токсичность. Для определения ответа использовались стандартные критерии ВОЗ. Время до прогрессии определялось как срок от начала химиотерапии до прогрессии заболевания, а выживаемость определялась как время от начала химиотерапии до летального исхода. Токсичность оценивали в соответствии с системой ВОЗ.
Статистический анализ
Рандомизация проводилась централизованно в офисе HeCOG. Больных включали в одну из двух групп с использованием центра в качестве фактора стратификации. При использовании уровня достоверности 0,05 и принимая во внимание стандартное отношение риска, равное 0,67, вероятность выявления достоверного различия между схемами составляет 95%, если регистрируется 404 летальных исхода. С учетом 10% выбывания больных из испытания, для выявления 50%-ного увеличения медианного контрольного значения выживаемости до 11 месяцев, в исследование необходимо было включить 440 больных. Темп набора больных в испытание, по имеющимся оценкам, составлял 150 больных в год, а максимальная продолжительность испытания должна была составлять 3 года.
Значения выживаемости и времени до прогрессии для групп лечения сравнивались с использованием лог-рангового теста. Метод Каплана-Мейрера использовался для оценки времени до события. Главные сравнения в отношении ответа были получены на основании когорты больных, пригодных для оценки на ответ, что проводилось с помощью критерия линейной ассоциации χ2 и точного критерия Фишера. Анализ регрессии с многими переменными и процедура обратной селекции использовалась для оценки наилучших прогностических факторов вероятности годичного выживания.
Данные по токсичности приводятся для всех больных, а сравнение между группами осуществлялось с помощью линейного критерия χ2. Все приведенные значения Р получены на основе двустороннего анализа с помощью программного пакета SPSS 8.0 (SPSS Inc., Чикаго, Иллинойс).
В конце испытания мы выполнили ретроспективный анализ затрат для каждой из групп. Двумя исследовавшимися факторами были абулаторные и клинические затраты и затраты на химиотерапевтические препараты. Для каждого фактора, влиявшего на анализ, были рассчитаны описательные статистические характеристики и проведены оценки с помощью критерия t Стьюдента для независимых выборок с целью сравнения фактора между группами.
РЕЗУЛЬТАТЫ
Характеристики больных
В период с февраля 1998 г. по сентябрь 2000 г. в испытание было включено всего 509 больных, 252 в группе А и 250 в группе Б – в 19 медицинских учреждениях. Все характеристики больных и характеристики заболевания до лечения (Таблицы 1 и 2, соответственно) были хорошо сбалансированы между обеими группами. Большинство больных составляли курящие мужчины с хорошим ФС и ограниченной потерей веса.
Большая часть опухолей представляли собой малодифференцированные плоскоклеточные опухоли или аденокарциномы.
Сроки до события Медианное время наблюдения для оценки времени событий для больных в группах А и Б составляло 20,7 месяца (интервал от 0,03 до 35,2+ месяца) и 20,5 месяцев (интервал от 0,07 до 30,4+ месяцев), соответственно. Медианное время наблюдения для обеих групп совместно составляло 20,7 месяцев (95%-ный ДИ от 18,0 до 21,5 месяцев). Всего шесть больных, по три в каждой группе, были потеряны для дальнейших обследований.
Таблица 1. Характеристики больных
Характеристика
Группа А
Группа Б
Число
больных
Число
больных
Потеря веса более 10%
Предшествующая лучевая терапия
Таблица 2. Характеристики заболевания
Характеристика
Группа А
Группа Б
Число
больных
Число
больных
Включено в испытание
Число очагов метастазирования
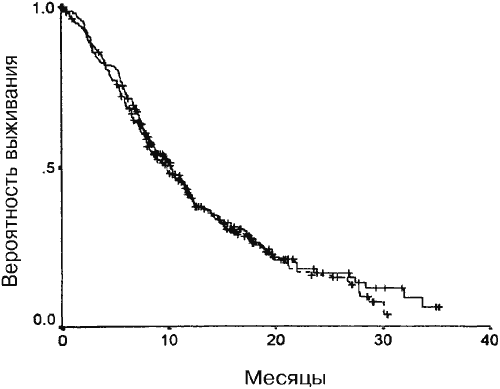
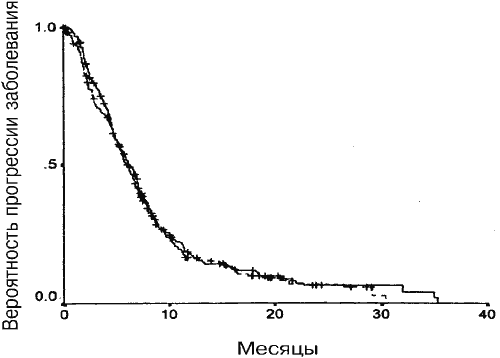
Средняя общая выживаемость и время до прогрессии для групп А и Б достоверно не отличалось. Как показано на Рис. 1, медианное время выживания составляло 10,4 месяца (95%-ный ДИ от 8,8 до 12 месяцев) для группы А и 9,8 месяцев (95%-ный ДИ от 8,0 до 11,7 месяцев) для группы Б (Р=0,32). Среднее время до прогрессии составляло 6,3 месяца (95%-ный ДИ от 5,6 до 7,1 месяца) для группы А и 6,1 месяца (95%-ный ДИ от 5,4 до 6,8 месяцев) для группы Б (Р=0,76) (Рис. 2).
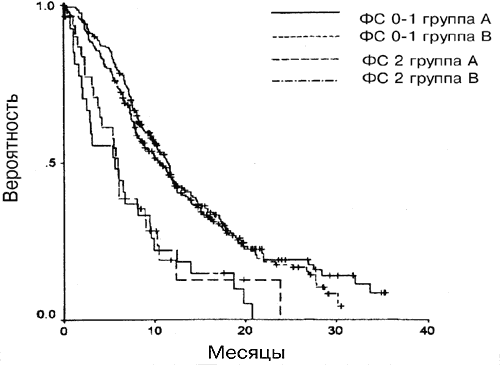
Для групп А и Б совместно медианная общая выживаемость для больных с ФС 0 или 1 была достоверно выше, чем для больных с ФС 2 (11,1 и 5,9 месяецв, соответственно) (Р=0,0001); это же относится и к медианному значению времени до прогрессии (6,6 и 3,8 месяцев, соответственно; Р
Литература
1. Ginsberg RJ, Vokes ЕЕ, Rosenzweig К: Non small cell lung cancer, in De Vita Jr, Hellman S, Rosenberg SR (eds): Cancer: Principles and Practice of Oncology (ed 6). Philadelphia, PA, Lippin-cott-Raven, 2001, pp 925-983
2. Landis SM, Murray T, Bolden S, et al: Cancer statistics, 1998. CA Cancer J Clin 48:6-29, 1998
3. Lubin JM: Lung and larynx, in Cancer Rates and Risks (ed 4). Bethesda, MD, National Institutes of Health, National Cancer Institute, 1996, pp 158-161
4. Greenlee RT, Hill-Harmon MB, Murray T, et al: Cancer statistics, 2001. CA Cancer J Clin 51:15-36, 2001
5. Chemotherapy in non-small cell lung cancer: A meta-analysis using updated data on individual patients from 52 randomized clinical trials—Non-small Cell Lung Cancer Collaborative Group. BMJ 311:899-909, 1995
6. Cullen MH, Billingham „\, Woodroffe CM, et al: Mitomycin, ifosfamide and cisplatin in unresectable non-small-cell lung cancer: Effects on survival and quality of life. J Clin Oncol 17:3188-3194, 1999
7. Lilenbaum RC, Green MR: Novel chemotherapeutic agents in the treatment of non-smallcell lung cancer. J Clin Oncol 11:1391-1402, 1993 8. Barton-Burke M: Gemcitabine: A pharmacologic and clinical overview. Cancer Nurs 22:176-183, 1999 (review)
9. Shepherd FA: Phase II trials of single-agent activity of gemcitabine in patients with advanced non-small cell lung cancer: An overview. Anticancer Drugs 6:19-25, 1995
10. Gatzemeier U, Shepherd FA, Le Chevalier T, et al: Activity of gemcitabine in patients with non-small cell lung cancer: A multicentre, extended phase II study. Eur J Cancer 32A:243-248, 1996
11. Crino L, Scagliotti G, Marangolo M, et al: Cisplatin-gemcitab-ine combination in advanced non-small-cell lung cancer: A phase II study. J Clin Oncol 15:297-303. 1997
12. Abratt RP, Bezwoda WR, Goedhals L, et al: Weekly gemcitabine and monthly cisplatin: Effective chemotherapy for advanced non-small-cell lung cancer. J Clin Oncol 15:744-749, 1997
13. Rowinsky EK, Donehower RC: Taxol: Twenty years later, the story unfolds. J Nati Cancer Inst 83:1778-1781, 1991
14. Murphy WK, Fossella FV, Winn RJ, et al: A phase II study of taxol in patients with untreated advanced non-small-cell lung cancer. J Nati Cancer Inst 85:384-388. 1993
15. Gatzemeier U, Heckmayer M, Neuhauss R, et al: Chemotherapy of advanced inoperable non-small cell lung cancer with paclitaxel: A phase II trial. Semin Oncol 22:24-28, 1995 (6 suppl 15)
16. Hainsworth JD, Thompson DS, Greco FA: Paclitaxel by 1-hour infusion: An active drug in metastatic non-small-cell lung cancer. J Clin Oncol 13:1609-1614, 1995
17. Rowinsky EK, Gilbert MR, McGuire WP, et al: Sequences of taxol and cisplatin: A phase I and pharmacologic study. J Clin Oncol 9:1692-1703, 1991
18. Rowinsky EK, Chandbry V, Forastiere AA, et al: Phase I and pharmacologic study of paclitaxel and cisplatin with granulocyte colony-stimulating factor: Neuromuscular toxicity is dose-limiting. J Clin Oncol 11:2010-2020, 1993
19. Bonomi PD, Finkelstein DM, Ruckdeschel JC, et al: Combination chemotherapy versus single agents followed by combination chemotherapy in stage IV non-small-cell lung cancer: A study of the Eastern Cooperative Oncology Group. J Clin Oncol 7:1602-1613, 1989
20. Calvert АН, Newell DR, Gumbrell LA, et al: Carboplatin dosage: Prospective evaluation of a simple formula based on renal function. J Clin Oncol 7:1748-1756, 1989
21. Kosmidis PA, Mylonakis N, Fountzilas G, et al: Paclitaxel and carboplatin in inoperable non-small-cell lung cancer: A phase II study. Ann Oncol 8:697-699, 1997
22. Langer CJ, Leighton JC, Comis RL, et al: Paclitaxel and carboplatin in combination in the treatment of advanced non-small-cell lung cancer: A phase II toxicity, response, and survival analysis. J Clin Oncol 13:1860-1870, 1995
23. Johnson DH, Paul DM, Hande KR, et al: Paclitaxel plus carboplatin in advanced nonsmall- cell lung cancer: A phase II trial. J Clin Oncol 14:2054-2060, 1996
24. Kelly К, Pan Z, Murphy J, et al: A phase I trial of paclitaxel plus carboplatin in untreated patients with advanced non-small cell lung cancer. Clin Cancer Res 3:1117-1123, 1997
25. Kosmidis P, Mylonakis N, Skarlos D, et al: Paclitaxel (175 mg/m 2 ) plus carboplatin (6 AUC) versus paclitaxel (225 mg/m 2 ) plus carboplatin (6 AUC) in advanced non-small-cell lung cancer (NSCLC): A multicenter randomized trial—Hellenic Cooperative Oncology Group (HeCOG). Ann Oncol 11:799-805, 2000
26. Kroep JR, Giaccone G, Voon DA, et al: Gemcitabine and paclitaxel: Pharmacokinetic and pharmacodynamic interactions in patients with non-small-cell lung cancer. J Clin Oncol 17:2190-2197, 1999
27. Giaccone G, Smith EF, van Meerbeeck JP, et al: A phase I-II study of gemcitabine and paclitaxel in advanced non-small-cell lung cancer patients. Ann Oncol 11:109-112, 2000
28. Monnier A, Douillard JY, Lerouge D, et al: Results of a phase II study with Taxol (paclitaxel) and Gemzar (gemcitabine) in metastatic non-small cell lung cancer (NSCLC).Proc Am Soc Clin Oncol 19:516a, 2000 (abstr 2021)
29. Auerbach M, Chaudhry M, Richards P, et al: Phase II study of gemcitabine and paclitaxel in metastatic non-small cell lung cancer. Proc Am Soc Clin Oncol 19:522a, 2000 (abstr 2052)
30. Sweeney CJ, Zhu J, Sandier AB, et al : Outcome of patients with a performance status of 2 in Eastern Cooperative Oncology Group Study E 1594: A phase III trial in patients with metastatic non-small cell lung carcinoma. Cancer 92:2639-2647, 2001
31. Scagliotti GV, De Marinis F, Rinaldi M, et al: Phase III randomized trial comparing three platinum-based doublets in advanced non-small cell lung cancer. Proc Am Soc Clin Oncol 20:308a, 2001 (abstr 1227)
32. Schiller JH, Harrington D, Belani C, et al: Comparison of four chemotherapy regimens for advanced non-small cell lung cancer. N Engi J Med 346:92-98, 2002
33. van Meerbeeck JP, Smit EF, Lianes P, et al: An EORTC randomized phase III trial of three chemotherapy regimens in advanced non-small cell lung cancer (NSCLC). Proc Am Soc Clin Oncol 20:308a, 2001 (abstr 1228)
34. Georgoulias V, Papadakis E, Alexopoulos A, et al: Platinum-based and non-platinumbased chemotherapy in advanced non-small-cell lung cancer: A randomised multicentre trial.Lancet 357:1478-1484, 2001
Рис. 1. Медианы выживаемости для групп А и Б (Р=0,32). Сплошная линия – группа А, штриховая линия – группа Б.
Рис. 2. Медианы времени до прогрессии для групп А и Б (Р=0,36). Сплошная линия – группа А, штриховая линия – группа Б.
Рис. 3. Влияние ФС на выживаемость для каждой из групп.
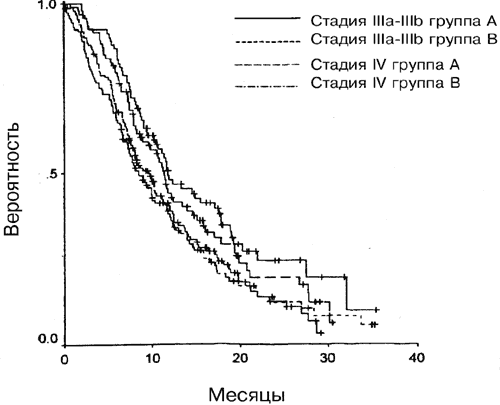
Рис. 4. Влияние стадии по TNM на выживаемость в группах А (Р=0,01) и группе Б (Р=0,05).
ПАКЛИТАКСЕЛ-ЭБЕВЕ
Лекарственная форма: КОНЦ ДЛЯ ИНФ
Производители
Инструкция по применению
Состав
1 мл концентрата содержит:
Вспомогательные вещества: макрогола глицерилрицинолеат (касторовое масло
Описание
Прозрачный раствор от бесцветного до светло-желтого цвета.
Фармакотерапевтическая группа
Фармакодинамика
Паклитаксел является противоопухолевым препаратом природного происхождения, получаемый полусинтетическим путем из растения Тис Ягодный (Taxus Baccata). Механизм действия связан со способностью препарата стимулировать «сборку» микротрубочек из димерных молекул тубулина, стабилизировать их структуру и тормозить динамическую реорганизацию в интерфазе, что нарушает митотическую функцию клетки.
Дозозависимо подавляет костномозговое кроветворение. Обладает мутагенными и эмбриотоксическими свойствами, вызывает снижение репродуктивной функции.
Фармакокинетика
Показания
— Рак яичников (терапия первой линии в комбинации с препаратами платины) и терапия второй линии при метастазах после стандартной терапии, не давшей положительного результата.
— Рак молочной железы (в качестве терапии первой и второй линии, а также адьювантного лечения).
— Немелкоклеточный рак легкого (терапия первой линии больных, которым не планируется проведение хирургического лечения и/или лучевой терапии (в комбинации с цисплатином)).
— Саркома Капоши у больных СПИДом (терапия второй линии, после неэффективной терапии липосомальными антрациклинами).
Противопоказания
— Детский возраст (безопасность и эффективность не установлены).
— Повышенная чувствительность к паклитакселу, а также другим препаратам,
лекарственная форма которых включает полиоксиэтилированное касторовое масло.
— Беременность и период кормления грудью.
— Исходное содержание нейтрофилов менее 1,5*10 9 /л у пациентов с солидными опухолями.
— Исходное (или зарегистрированное в процессе лечения) содержание нейтрофилов менее 1,0* 10 9 /л у пациентов с саркомой Капоши у больных СПИДом.
С осторожностью
С осторожностью применяют у пациентов с угнетением костномозгового кроветворения (в том числе после химио- или лучевой терапии), печеночной недостаточностью, острыми инфекционными заболеваниями (в т.ч. опоясывающий лишай, ветряная оспа, герпес), тяжелым течением ишемической болезни сердца, инфарктом миокарда (в анамнезе), аритмии.
Беременность и лактация
Контролируемых исследований применения паклитаксела у беременных женщин не проводилось. Исследования на животных показали эмбриотоксический, тератогенный и мутагенный эффекты паклитаксела. Поэтому беременным женщинам не следует применять паклитаксел.
Не известно, проникает ли паклитаксел в грудное молоко, поэтому во избежание токсического действия препарата на младенца, в период лечения следует прекратить грудное вскармливание.
Способы применения и дозы
Паклитаксел может применяться как в виде монотерапии, так и в сочетании с другими противоопухолевыми препаратами. Доза и схема приема препарата подбирается индивидуально.
Химиотерапия первой линии рака молочной железы
В случае комбинированного применения с трастузумабом, паклитаксел рекомендуется вводить в дозе 175 мг/м2 поверхности тела путем трехчасовых внутривенных инфузий с трехнедельными интервалами между курсами. Паклитаксел можно вводить на следующий день после введения первой дозы трастузумаба или немедленно после введения последующих доз, если предшествующие дозы трастузумаба хорошо переносились.
Химиотерапия второй линии рака молочной железы
Химиотерапия саркомы Капоши на фоне СПИД.
Лечение пациентов с нарушениями функиии печени. В настоящее время недостаточно данных для выработки рекомендаций по коррекции доз для больных с нарушениями функции печени легкой или средней степени тяжести. Пациентам с тяжелыми нарушениями функции печени не следует назначать паклитаксел.
Правила приготовления раствора для инфузий
При приготовлении, хранении и введении препарата Паклитаксел-Эбеве следует пользоваться оборудованием, которое не содержит поливинилхлорида (ПВХ): например из стекла, полипропилена или полиолефина. Раствор препарата готовят разведением концентрата до конечной концентрации паклитаксела от 0,3 до 1,2 мг/мл. В качестве разбавляющего раствора могут быть использованы: 0,9% раствор натрия хлорида, 5% раствор декстрозы, 5% раствор декстрозы в 0,9% растворе натрия хлорида, 5% раствор декстрозы в растворе Рингера. Приготовленные растворы могут опалесцировать из-за присутствующей в составе лекарственной формы основы-носителя. При введении препарата следует использовать систему с мембранным фильтром (размер пор не более 0,22 мкм).
Растворы для инфузий, приготовленные путем разведения Паклитаксела-Эбеве 0,9% раствором натрия хлорида или 5% раствором декстрозы, являются физически и химически стабильными в течение 51 часа в случае хранения при температуре 25°С и 14 суток в случае хранения при температуре 5°С. С микробиологической точки зрения раствор для инфузий следует вводить сразу же после приготовления. Если раствор не используется сразу после приготовления, время хранения не должно превышать 24 часа при температуре 2-8°С, если только раствор не готовился в контролируемых асептических условиях.
Для снижения риска образования осадка раствор для инфузий необходимо вводить сразу же после разведения и избегать чрезмерной тряски, вибраций и взбалтывания. Инфузионная система должна быть тщательно промыта перед использованием. В процессе введения необходимо регулярно контролировать внешний вид раствора и при обнаружении осадка прекращать инфузию.
Побочные эффекты
Частота и выраженность побочных эффектов носят дозозависимый характер.
Со стороны системы крови и лимфатической системы
очень частые: миелосупрессия, нейтропения, тромбоцитопения, анемия, лейкопения, кровотечение;
редкие: фибрильная нейтропения;
очень редкие: острый миелоидный лейкоз, миелодиспластический синдром.
Со стороны нервной системы
очень частые: нейротоксические эффекты (преимущественно периферическая
редкие: моторная нейропатия (умеренно выраженная слабость дистальных мышц, трудность выполнения точных движений);
очень редкие: вегетативная нейропатия (приводящая к паралитической непроходимости кишечника и ортостатической гипотензии), большие эпилептические припадки («grand mal»), конвульсии, энцефалопатия, головокружение, головная боль, спутанность сознания, атаксия.
Со стороны сердечнососудистой системы
частые: брадикардия, снижение артериального давления;
нечастые: кардиомиопатия, бессимптомная желудочковая тахикардия, атриовентрикулярная блокада, обморок, повышение артериального давления инфаркт миокарда, тромбоз сосудов, тромбофлебит;
очень редкие: фибрилляция предсердий, наджелудочковая тахикардия, шок.
Со стороны органов чувств
очень редкие: поражения зрительного нерва и/или нарушения зрения (мерцательная скотома), потеря слуха, шум в ушах, головокружение.
Со стороны дыхательной системы
редкие: одышка, плевральный выпот, интерстициальная пневмония, фиброз легких, эмболия легочной артерии, дыхательная недостаточность, лучевой пневмонит у больных, одновременно проходящих курс лучевой терапии; очень редкие: кашель.
Со стороны пищеварительной системы
очень частые: тошнота, рвота, диарея, воспаление слизистых оболочек; редкие: панкреатит, перфорация кишечника, ишемический колит;
очень редкие: анорексия, запор, мезентериальный тромбоз, псевдомембранозный колит, эзофагит, асцит, нейтропенический колит, некроз печени, печеночная энцефалопатия (имеются единичные сообщения о летальном исходе).
Со стороны кожи и кожных придатков
очень частые: алопеция;
частые: преходящее небольшие изменения ногтей и кожи (нарушение пигментации, обесцвечивание ногтевого ложа);
редкие: зуд кожных покровов, высыпания, эритема;
очень редкие: синдром Стивенса-Джонсона (изъязвление слизистой оболочки полости рта, горла, глаз, половых органов, других участков кожи и слизистых оболочек), эпидермальный некролиз, мультиформная эритема, эксфолиативный дерматит, крапивница, онихолизис.
Со стороны костно-мышечной системы
очень частые: артралгия, миалгия.
Со стороны иммунной системы
очень частые: инфекции (преимущественно мочевого тракта и верхних отделов дыхательных путей);
не частые: серьезные реакции гиперчувствительности, требующие принятия терапевтических мер (а именно, снижение артериального давления, ангионевротический отек, респираторный дистресс синдром, генерализованная крапивница, озноб, боль в спине, боль в груди, тахикардия, абдоминальная боль, боль в конечностях, выраженное потоотделение, повышение артериального давления);
редкие: анафилатоидные реакции.
частые: увеличение активности «печеночных» трансаминаз, увеличение концентрации щелочной фосфатазы, билирубина, креатинина в сыворотке крови.
частые: боль, локализованный отек, эритема, индурация и пигментация кожи в месте инъекции; экстравазация может вызывать воспаление и некроз подкожной клетчатки.
редкие: астения, повышение температуры тела, дегидратация, общая слабость.
Передозировка
Симптомы: угнетение функции костного мозга, периферическая нейропатия, воспаление и изъязвление слизистых оболочек.
Лечение: симптоматическое. Антидот к паклитакселу не известен.
Взаимодействие
Цисплатин снижает общий клиренс паклитаксела на 20%, поэтому при комбинированной химиотерапии паклитаксел необходимо вводить до цисплатина. Более выраженная миелосупрессия наблюдается в случае, когда паклитаксел вводят после цисплатина. При комбинированной химиотерапии (паклитаксел и цисплатин) риск развития почечной недостаточности выше, чем при монотерапии цисплатином.
Одновременное назначение с циметидином, ранитидином, дексаметазоном ши дифенгидрамином не влияет на связь паклитаксела с белками плазмы крови.
Поскольку элиминация доксорубицина и его активных метаболитов может снижаться при сокращении временного интервала между введениями паклитаксела и доксорубицина, паклитаксел необходимо вводить через 24 часа после доксорубицина.
Информация о потенциально возможном взаимодействии паклитаксела с ингибиторами и индукторами изоферментов системы цитохрома Р 450 (в частности изофермента CYP3A4) ограничена, поэтому необходима осторожность при одновременном применении ингибиторов (например, эритромицин, флуоксетин, гемфиброзил) или индукторов (например, рифампицин, карбамазепин, фенитоин, фенобарбитал) изоферментов системы цитохрома Р 450.
Ингибиторы макросомалъного окисления (в т.ч. кетоконазол, циметидин, верапамил, диазепам, хинидин, циклоспорин и др.) подавляют метаболизм паклитаксела. Однако, известно, что при одновременном приеме кетоконазола и паклитаксела, элиминация последнего не замедляется, поэтому оба препарата можно применять без коррекции доз. При одновременном применении паклитаксела и нелфинавира или ритонавира (но не индинавира) значительно снижается системный клиренс паклитаксела. Недостаточно информации о взаимодействии паклитаксела и других ингибиторов протеазы при одновременном применении.
Полиоксиэтилированное касторовое масло, входящее в состав паклитаксела, может вызвать экстракцию ди-(2-гексил)фталата (ДЭГП) из пластифицированных поливинилхлоридных контейнеров, причем степень вымывания ДЭГП увеличивается при увеличении концентрации раствора и временем. Поэтому, при приготовлении, хранении и введении препарата Паклитаксел-Эбеве следует пользоваться оборудованием, которое не содержит деталей из поливинилхлорида.
Особые указания
Применение Паклитаксела-Эбеве должно осуществляться под наблюдением квалифицированного врача, имеющего опыт работы с противоопухолевыми химиотерапевтическими препаратами. Паклитаксел-Эбеве может применяться как в виде монотерапии, так и в сочетании с другими противоопухолевыми препаратами. Доза и схема приема препарата подбирается индивидуально.
При работе с препаратом Паклитаксел-Эбеве необходимо соблюдать осторожность. Разводить препарат следует в асептических условиях в специально отведенном помещении. Этим должен заниматься подготовленный персонал. Необходимо принимать все меры для предотвращения попадания раствора паклитаксела на кожу и слизистые оболочки, в частности пользоваться защитной одеждой (халат, шапочка, маска, очки и одноразовые перчатки). При вдыхании паров или распыленных растворов паклитаксела сообщалось о возникновении одышки, боли в груди, ощущении жжения в горле, тошноте. При попадании паклитаксела на кожу или слизистые оболочки необходимо тщательно промыть мылом и водой либо (глаза) большим количеством воды.
Препарат нельзя замораживать, поскольку при этом в нем может образовываться осадок. Такой осадок обычно растворяется при нагреве флакона до комнатной температуры (25°С). Если же раствор в ранее замороженном флаконе остается мутным или в нем присутствует нерастворимый осадок, препарат использовать нельзя и такой флакон должен быть уничтожен. Приготовленный раствор для инфузий не нуждается в защите от света.
В случае развития тяжелых реакций гиперчувствительности вливание препарата Паклитаксел-Эбеве следует немедленно прекратить и начать симптоматическое лечение. Вводить препарат повторно не следует.
Во время лечения необходимо регулярно контролировать клинический анализ крови, артериальное давление, частоту сердечных сокращений и дыханий (особенно вначале инфузии), электрокардиограмму.
В случаях развития нарушений атриовентрикулярной проводимости, при повторных введениях необходимо проводить непрерывный мониторинг электрокардиограммы.
Если Паклитаксел-Эбеве используется в комбинации с цисплатином, сначала следует вводить Паклитаксел-Эбеве, а затем цисплатин.
Пациентам во время лечения препаратом Паклитаксел-Эбеве и, по крайней мере, в течение 3-х месяцев после окончания терапии следует использовать надежные методы контрацепции.
Поскольку безопасность и эффективность Паклитаксел-Эбеве у детей не установлена, не рекомендуется применять препарат у данной возрастной категории пациентов.
Влияние на способность управлять трансп. ср. и мех.
Из-за вероятности проявления побочных эффектов, таких как головная боль, головокружение, сонливость, следует воздержаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Условия хранения и срок годности
В защищенном от света месте при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Специальные меры предосторожности при уничтожении неиспользованных лекарственных препаратов
Остатки препарата и все инструменты, и материалы, которые использовались для приготовления раствора для инфузий и введения Паклитаксел-Эбеве, должны уничтожаться в соответствии со стандартной больничной процедурой утилизации отходов цитотоксических веществ, с учетом действующих нормативных актов уничтожения опасных отходов.
Не использовать после истечения срока годности, указанного на упаковке.