что такое оэо в химии
Электроотрицательность химических элементов в таблице Менделеева
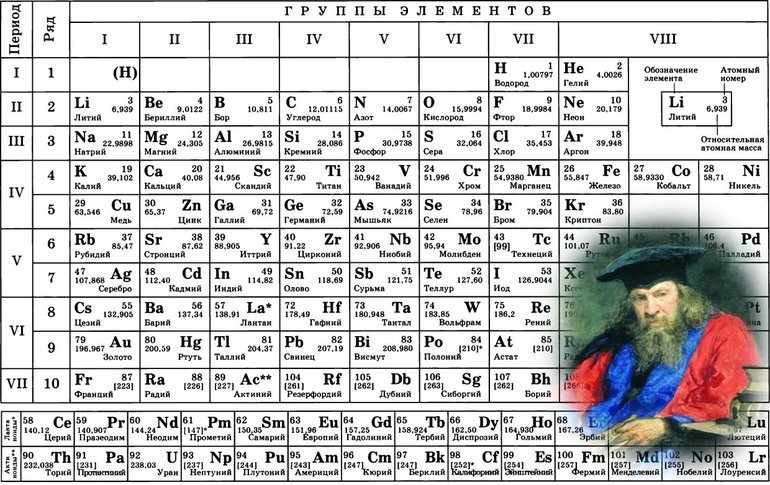
Сложные химические соединения состоят из различных элементов. В них электронная плотность всегда смещена в направлении более «сильного» соседа. Например, в атоме соляной кислоты таким окажется хлор. Чтобы определять силу атомов, необходимо разобраться с понятием электроотрицательности (ЭО). Эта величина обозначается буквой χ. Определяется электроотрицательность в таблице Менделеева.
Смысл понятия
Электроотрицательность химических элементов представляет собой способность атома вещества притягивать к себе электроны других атомов в сложных соединениях. Впервые это понятие ввел в начале XX столетия американский химик Лайнус Полинг. Простые элементы можно разделить на две большие группы в соответствии с их химическими и физическими свойствами:
Вещества из первой группы могут выступать в роли восстановителя либо окислителя в зависимости от показателя электроотрицательности элемента. Чем он выше, тем активнее вещество проявляет свойства окислителя.
Таким образом, необходимо разобраться с двумя новыми понятиями:
Полингом была составлена специальная шкала электроотрицательности. Максимальной электронегативностию обладает фтор — 4. Минимальный электроотрицательный показатель у франция, и он равен 0,7.
Кроме этого, определить показатель электронегативности любого элемента можно по таблице Менделеева. Для этого необходимо запомнить два правила:
Зная эти правила, можно достаточно просто в любом соединении найти более сильный элемент. Однако химическим элементам нельзя приписывать постоянный показатель ЭО. Эта способность веществ зависит от различных факторов, в том числе от степени окисления и валентности.
Для полного понимания темы предстоит разобраться и с этими понятиями. Степенью валентности называется условный заряд атомов вещества в сложном соединении, определенный на базе предположения, что ионные и ковалентно-полярные соединения состоят исключительно из ионов. Также следует обратить внимание на тот факт, что в соединении суммарная степень окисления атомов равна нулю.
Валентность любого химического элемента определяется числом электронов, принимающих участие в образование химической связи между веществами. В отличие от степени окисления, валентность не имеет знака и не может быть равна нулю. Понятие относительной электроотрицательности (ОЭО) в химии нельзя игнорировать.
Именно с его помощью можно быстрее разобраться с принципами образования химических связей между элементами.
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО
Значение постоянной СО этого элемента
IA группы — Li, Na, K, Rb, Cs, Fr
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент
Степень окисления практически во всех соединениях
Исключения
Фторид кислорода —
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент
Номер группы
Высшая степень окисления
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной (
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно — восстановительные.
Окислительно-восстановительные реакции
Одним из основных понятий неорганической химии является понятие о степени окисления (СО).
Степенью окисления элемента в соединении называется формальный заряд атома элемента, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
Применяют также метод Штока обозначения степени окисления римскими цифрами после символа элемента: Mn (VII), Fe (III).
Вопрос о знаке степени окисления атомов в молекуле решается на основании сопоставления электроотрицательностей связанных между собой атомов, которые образуют молекулу. При этом атом с меньшей электроотрицательностью имеет положительную степень окисления, а с большей электроотрицательностью отрицательную.
Следует отметить, что нельзя отождествлять степень окисления с валентностью элемента. Валентность, определяемая как число химических связей, которыми данный атом соединен с другими атомами, не может равняться нулю и не имеет знака « + » или « ». Степень окисления может иметь как положительное, так и отрицательное значение, а также принимать нулевое и даже дробное значение. Так, в молекуле СO2 степень окисления С равна +4, а в молекуле СН4 степень окисления С равна 4. Валентность же углерода и в том, и в другом соединении равна IV.
Несмотря на указанные выше недостатки, использование понятия степени окисления удобно при классификации химических соединений и составлении уравнений окислительно-восстановительных реакций.
При окислительно-восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление.
Окислением называется процесс потери электронов. Восстановлением процесс присоединения электронов.
Вещества, атомы или ионы которых отдают электроны, называются восстановителями. Вещества, атомы или ионы которых присоединяют электроны (или оттягивают к себе общую пару электронов), называются окислителями.
При окислении элемента степень окисления увеличивается, иначе говоря, восстановитель при реакции повышает степень окисления.
Наоборот, при восстановлении элемента степень окисления понижается, т. е. при реакции окислитель уменьшает степень окисления.
Таким образом, можно дать и такую формулировку окислительно-восстановительных реакций: окислительно-восстановительными реакциями называются реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Окислители и восстановители
К типичным восстановителям относятся простые вещества, атомы которых имеют малую ОЭО Опубликовано admin в 17:01
КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ И КАК РАССТАВЛЯТЬ КОЭФФИЦИЕНТЫ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ С ОРГАНИЧЕСКИМИ ВЕЩЕСТВАМИ
Как определить степень окисления в органических соединениях? Чем отличается определение степени окисления в органических соединениях от определения степени окисления в неорганических? Как составить уравнение окислительно-восстановительной реакции, в которой участвуют соединения углерода, и правильно расставить коэффициенты?
Обо всем этом в данной статье подробно и по порядку.
Проблема, как определить степень окисления в органических соединениях, вытекает из школьного курса химии. Определенное (но не достаточное) внимание уделяется этому вопросу на примере неорганических веществ. Об органических же веществах в этой связи речь практически не идет.
Тем не менее, об окислении соединений углерода в курсе органической химии (10 класс) говорится достаточно часто. 33 задание в ЕГЭ по химии практически всегда подразумевает хотя бы одну ОВР с участием органического вещества и необходимость не только составить схему реакции, но и расставить коэффициенты.
Придя в колледж или университет, изучая курс органической химии на более серьезном уровне, студент сталкивается все с той же проблемой: как определить степень окисления в органических соединениях. Подразумевается, что бывший выпускник школы получил эти знания в школьном курсе химии, поэтому нет надобности останавливаться на данном вопросе в профессиональном образовании.
Налицо потеря взаимосвязи и преемственности разных ступеней образования: среднего основного и профессионального (СПО и ВПО).
Итак, разберемся по порядку как определить степень окисления в органических соединениях.
Что такое электроотрицательность, степень окисления и ковалентная связь
Для того чтобы правильно определить степень окисления в органическом соединении, необходимо четко и ясно усвоить три основных понятия: собственно само понятие степень окисления, электроотрицательность и ковалентная связь.
Остановимся на них кратко, так как их рассмотрение не является основной целью данной статьи.
Что такое электроотрицательность
Понятие электроотрицательности (ЭО) впервые было введено американским химиком Л.Полингом в 1932 г.
Кстати, ЭО – это еще одна относительная величина в химии. Ее правильнее называть относительной электроотрицательностью (ОЭО). Абсолютные значения ЭО очень не удобны в расчетах, поэтому их вычисляют относительно значения ЭО лития Li. Относительные величины не имеют единиц измерения.
Были получены вполне приемлемые для расчетов и анализа числа, которые сведены в удобную таблицу, в общих чертах похожую на периодическую систему химических элементов.
Способность атомов химических элементов притягивать к себе электроны других атомов в процессе образования химической связи называется электроотрицательностью .
Почему нейтральные атомы притягиваются
Раз атомы притягивают к себе электроны, то закономерно возникает следующий вопрос. Если атом, по определению, – это электронейтральная частица, то как он может вообще к себе что-то притягивать, в частности электроны – отрицательно заряженные частицы?
Вообще этот вопрос можно бы переадресовать ученым, специалистам, занимающимся проблемами квантовой механики (один из разделов современной физики).
А мы же лишь крайне упрощенно поясним, почему такое может быть.
Необходимо вспомнить, что силовые линии электрического поля положительного заряда (а им является ядро атома) всегда заканчиваются на отрицательном заряде (электроны атома).
У атомов большинства химических элементов внешний уровень не завершен. То есть в нем есть своеобразная «дырка», сквозь которую выходят силовые линии ядра. Выходят они за пределы атома и заканчиваются на электронах другого атома. В подобной ситуации, несмотря на свою общую электронейтральность, атом ведет себя как положительная частица.
Примерно так это выглядит
При всем при этом атомы полностью не «слипаются». Это не возможно, так как положительно заряженные ядра атомов будут отталкиваться. Но поскольку расстояние между ядром одного атома и электронами другого меньше расстояния между ядрами, то можно утверждать, что силы притяжения все-таки преобладают над силами отталкивания.
Для чего необходимо понятие относительной электроотрицательности
Знание и понимание понятия ОЭО дает возможность определить тип химической связи между атомами. Для этого необходимо найти разность ОЭО двух элементов, атомы которых и образуют связь.
Если разность электроотрицательностей менее 0,5, то связь считается ковалентной неполярной. При разности от 0,5 до 1,6 – связь ковалентная полярная. Если более 2,0 – ионная. А если разность в промежутке от 1,6 до 2,0, то в присутствии металла связь считается ионной, при его отсутствии – ковалентной полярной.
Что такое ковалентная связь
Почему мы говорим здесь о ковалентной связи? Потому, что большинство органических соединений – ковалентные. А это очень важно при определении с.о. углерода в них.
ковалентная связь – связь между атомами элементов, возникающая за счет обобществления электронов, т.е. образования общих электронных пар.
Если связь образована между атомами с одинаковой ОЭО, то связь будет считаться ковалентной неполярной. Это потому, что между атомами не происходит перераспределения электронной плотности. Иными словами обобществленная электронная пара не смещается к какому-либо атому.
Такая ситуация возможна, если в образовании связи участвуют атомы одного и того же химического элемента-неметалла:
Но есть и редкие исключения. Молекула фосфина PH3 характеризуется ковалентной неполярной связью, так как относительные электроотрицательности водорода и фосфора равны: ОЭО(Н)=2,1 и ОЭО(Р)=2,1.
Если же связь образована элементами-неметаллами с разной ОЭО, то она считается ковалентной полярной. Происходит перераспределение электронной плотности между атомами, т.е. общая электронная пара смещается к атому с большей ОЭО. И чем сильнее будет разность в электроотрицательностях атомов элементов, тем полярнее будет и связь.
Что такое степень окисления и какие значения она может принимать
Степень окисления (с.о.) – важнейшее понятие в теории окислительно-восстановительных процессов. И это условная величина.
Известно, что при образовании ковалентной связи электроны общей электронной пары смещаются к атому более электроотрицательного элемента. Но лишь смещаются, а не полностью переходят к нему!
Классифицировать с.о. можно по разным признакам. Один из них – это постоянство для одного и того же химического элемента.
Согласно данному признаку, существуют элементы, проявляющие во всех без исключения сложных веществах одну и ту же ( постоянную ) степень окисления. Например:

А вот теперь самое интересное! Мы прекрасно знаем, что химический элемент углерод проявляет две степени окисления: +2 (в соединении СО) и +4 (СО2, например).
Более того, находясь в составе сложного органического соединения, углерод может иметь и нулевую степень окисления! Уж это совсем не вяжется с устоявшимися представлениями, выработанными на основе знаний о неорганических веществах. Для них мы знаем, что с.о. равная нулю возможна у атомов элементов в составе простых веществ (О3, P4, H2, N2 и т.д.)
Подведем некоторый итог.
В органических соединениях:
2) с.о. углерода может быть равна 0;
3) валентность углерода постоянна, равна IV и не всегда совпадает по значению со степенью окисления.
Как определить степень окисления в органических соединениях: примеры
Методы, которыми мы пользуемся для определения с.о. в неорганических веществах, применимы к органическим лишь в очень редких случаях.
Особенности определения с.о. в органических веществах
Определить степень окисления в органических веществах можно разными способами. Разберем самый простой и удобный, на наш взгляд. Именно для этого мы вспомнили, что такое относительная электроотрицательность, ковалентная связь и ее виды.
Вернемся к ранее упомянутому пропану С3Н8 и рассмотрим, какие виды ковалентной связи присутствуют в его молекуле.
1) запишем полную структурную формулу вещества и пронумеруем атомы углерода;
2) определим, какие связи в молекуле будут ковалентными полярными и ковалентными неполярными;
Приведем другие примеры.
Приведенные примеры позволяют сделать общие выводы о том, как определить степень окисления в органических соединениях.
2) Каждая ковалентная полярная связь, электронная плотность которой смещается ОТ атома углерода (С→О, С→N и т.д.), добавляет в его значение с.о. +1.
Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Итак, начнем с самых простых окислительно-восстановительных реакций, в которых реагентами выступают органические соединения. Для определения степени окисления углерода будем использовать выше описанный метод. В каждом конкретном примере на этом останавливаться уже не будем.
Пример 1. СН4 + О2 → СО2 + Н2О
При расстановке коэффициентов в данном случае лучше воспользоваться методом электронного баланса:
1) определим с.о. элементов;
2) составим схемы полуреакций с элементами, изменяющими свою с.о.;
3) используя данные по числу отданных и принятых электронов в полуреакциях, найдем наименьшее общее кратное и определим множители для каждой из полуреакций;
4) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
5) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
6) подберем коэффициенты для всех остальных химических элементов;
7) помним, что баланс количества атомов кислорода проверяем в последнюю очередь. Обычно, если число атомов кислорода слева (до стрелки) и справа (после стрелки) сходится, то это означает, что реакция составлена правильно и все остальные коэффициенты верны.
Пример 2. С3Н8 + О2 → СО2 + Н2О
В данном случае также удобнее использовать метод электронного баланса.
Пример 3. Н2C2O4 + KMnO4 → СО2 + K2CO3 + MnO2 + Н2О
Для расстановки коэффициентов вновь воспользуемся методом электронного баланса.
Пример 4. CH3OH + K2Cr2O7 + H2SO4 → HCOOH + Cr2(SO4)3 + K2SO4 + Н2О
В данном случае метанол и дихромат калия реагируют в кислой среде. Для расстановки коэффициентов можно воспользоваться любым из методов. Еще раз применим метод электронного баланса.
Пример 5. C6H12O6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + Н2О
Расставим коэффициенты тремя разными способами.
Способ 2. Расставим коэффициенты методом электронного баланса, используя все три с.о. углерода.
Способ 3. Поскольку реакция между глюкозой и перманганатом калия проходит в кислой среде (в H2SO4), расставим коэффициенты ионно-электронным методом (полуреакций):
1) молекулярные вещества (а к ним относится и глюкоза) на ионы не диссоциируют, поэтому в схемах полуреакций записываются в исходном виде;
2) количество недостающих кислорода и водорода в полуреакциях компенсируем, дописывая по необходимости молекулы воды H2O или ионы водорода Н + ;
3) считаем слева и справа в каждой полуреакции суммарный заряд (он создается ионами, образовавшимися при диссоциации реагирующих веществ, и ионами водорода Н + );
4) разницу зарядов компенсируем отдаваемыми или принимаемыми электронами;
5) так же, как и в методе электронного баланса, находим наименьшее общее кратное, определяем множители для каждой из полуреакций;
6) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
7) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
8) подберем коэффициенты для всех остальных химических элементов;
9) помним, что баланс количества атомов кислорода проверяем в последнюю очередь.
Пример 6. C3H4 + KMnO4 + H2SO4 → CH3COOH + CO2 + MnSO4 + K2SO4 + Н2О
Такое разнообразие степеней окисления одного элемента затрудняет применение метода электронного баланса. Поэтому лучше воспользоваться методом полуреакций.
Действие окислителей на органические вещества
В зависимости от строения и состава органических веществ (разветвленность углеродного скелета, наличие функциональных групп и их количество), а также от условий процесса (избыток или недостаток окислителя, его концентрация, рН раствора, нагревание или охлаждение) окисление происходит по-разному.
Так, например, при окислении алкена раствором KMnO4 в мягких условиях (без нагревания и в нейтральной или слабощелочной среде) образуется двухатомный спирт. А при окислении алкена раствором KMnO4 в жестких условиях (с нагреванием и в кислой или сильнощелочной среде) молекула по двойной связи разрушается, и образуются совершенно иные продукты. Это могут быть и карбоновая кислота, и ее соль и СО2.
Знание действия окислителей на органические вещества тех или иных классов поможет верно определить продукты окислительно-восстановительной реакции и правильно расставить в них коэффициенты.
Итак, ответ на вопрос: «Как определить степень окисления в органических веществах», – позволяет правильно составить схему реакции с участием органических веществ и подобрать наиболее оптимальный метод расстановки коэффициентов.