Что такое фенолы в химии
Фенолы
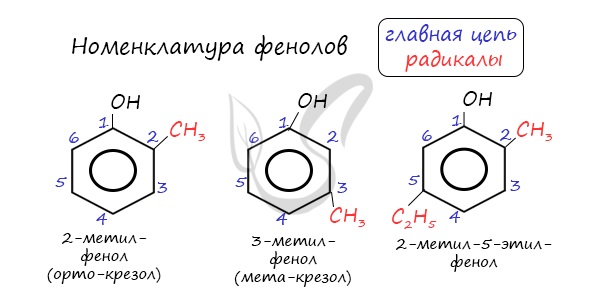
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
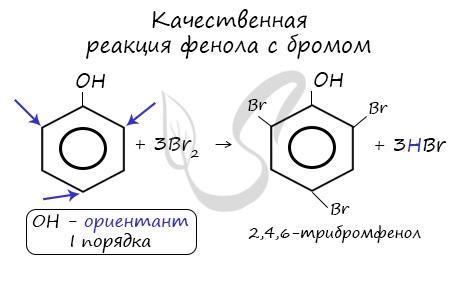
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
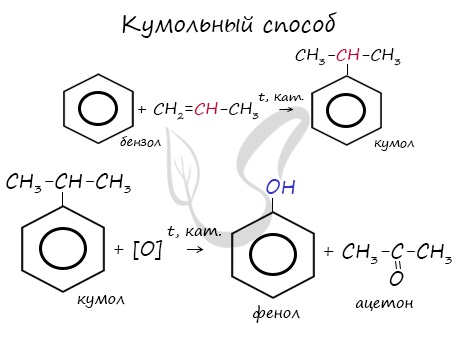
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
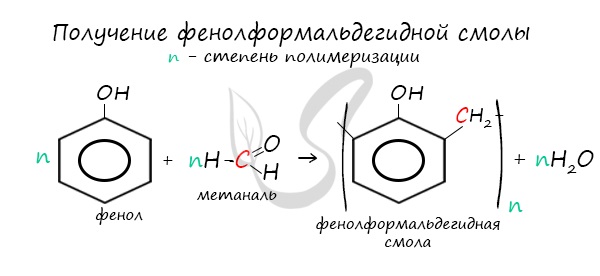
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Фенол
Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производств фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Содержание
Получение
На 2006 год производство фенола в промышленном масштабе осуществляется тремя способами:
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Химические свойства
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Биологическая роль
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает энзим тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
По данным на 2006 год мировое потребление фенола имеет следующую структуру:
Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт».
Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу.
Попадая в организм, фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
Примечания
Полезное
Смотреть что такое «Фенол» в других словарях:
ФЕНОЛ — в химии под этим общим названием известен ряд органических углеродистых соединений: карболовая кислота, сольвеол, лизол, резорцин, нафталин и др. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. ФЕНОЛОВАЯ… … Словарь иностранных слов русского языка
фенол — сущ. • карболовая кислота • карболка Словарь русских синонимов. Контекст 5.0 Информатик. 2012. фенол сущ., кол во синонимов: 15 • … Словарь синонимов
ФЕНОЛ — (карболовая кислота), C6H5OH, бесцветные, розовеющие на воздухе кристаллы, tпл 43шC. Выделяют из каменноугольной смолы или получают синтетически. Сырье в производстве синтетических смол (например, феноло формальдегидных), капролактама, красителей … Современная энциклопедия
ФЕНОЛ — ФЕНОЛ, фенола, муж. (от греч. phaino освещаю и лат. oleum масло) (хим.). Карболовая кислота. || чаще мн. Общее название группы веществ, представляющих собой производные бензола, как и карболовая кислота. Толковый словарь Ушакова. Д.Н. Ушаков.… … Толковый словарь Ушакова
ФЕНОЛ — ФЕНОЛ, а, муж. Карболовая кислота. | прил. феноловый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Фенол — – производные бензола с одной или несколькими гидроксильными группами. Применяется в производстве фенолформальдегидных пластмасс, синтетического волокна капрона, красителей, пестицидов, лекарственных препаратов (аспирин, салол) … Нефтегазовая микроэнциклопедия
ФЕНОЛ — (карболовая кислота C6H5OH) бесцветные (розовеют на воздухе) кристаллы с характерным запахом. Ф. ядовит. Получают из каменноугольной смолы. Применяют в производстве феноло формальдегидных смол, синтетического волокна, красителей, пестицидов,… … Российская энциклопедия по охране труда
феноліт — іменник чоловічого роду … Орфографічний словник української мови
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Фенолы — номенклатура, получение, химические свойства
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.