что такое болезнь легких цепей
Что такое болезнь легких цепей
аутоТГСК — трансплантация аутологичных гемопоэтических стволовых клеток крови
БДЛЦ — болезнь депозитов легких цепей
МГПП — моноклональная гаммапатия с преимущественным поражением почек
ММ — множественная миелома
ОхЧР — очень хорошая частичная ремиссия
ПН — почечная недостаточность
ПР — полная гематологическая ремиссия
СКФ — скорость клубочковой фильтрации
ХБП — хроническая болезнь почек
ЧР — частичная ремиссия
Болезнь депозитов легких цепей (БДЛЦ) — редкое системное заболевание, характеризующееся отложением моноклональных легких цепей (ЛЦ) в различных органах, что приводит к прогрессирующему нарушению их функции. БДЛЦ может быть ассоциирована с лимфопролиферативными заболеваниями: в 20% случаев выявляют множественную миелому (ММ), значительно реже — макроглобулинемию Вальденстрема, другие индолентные лимфомы [1]. В большинстве случаев БДЛЦ признаки гемобластоза или лимфомы отсутствуют. Для обозначения заболеваний, вызванных секретируемым парапротеином, но не пролиферацией опухолевых клеток, предложен термин «моноклональная гаммапатия с преимущественным поражением почек» (МГПП) или monoclonal gammopathy of renal significance—MGRS), объединяющий AL-амилоидоз, БДЛЦ, иммунотактоидную нефропатию, моноклональный криоглобулинемический гломерулонефрит и другие варианты поражений почек [2].
При БДЛЦ в 70—80% случаев выявляют секрецию моноклональных ЛЦ κ [3—6]. Количество моноклональных ЛЦ в сыворотке при БДЛЦ значительно меньше, чем при каст-нефропатии (КН), и, как правило, составляет 500 — 1500 мг/л [6, 7]. В 15—20% случаев выявить секрецию моноклональных ЛЦ не удается.
Основным проявлением БДЛЦ служит нефропатия. В 35% случаев наблюдается вовлечение других органов, главным образом, сердца и печени. Описано также отложение моноклональных иммуноглобулинов в периферических нервах, лимфатических узлах, головном мозге, селезенке, кишечнике, надпочечниках, сосудах, легких, коже [8—11].
Диагноз БДЛЦ можно установить только на основании морфологического исследования биоптата пораженного органа (чаще почки) с применением световой, иммунофлюоресцентной и иногда электронной микроскопии. При исследовании биоптата почки методом световой микроскопии при БДЛЦ выявляется характерный нодулярный гломерулосклероз [4, 12]. Клубочки имеют узловатый вид за счет неравномерного увеличения мезангиального матрикса с различной степенью его клеточности. В базальных мембранах и внеклеточном матриксе обнаруживают гомогенный, негативный при окрашивании конго-красным, PAS-позитивный материал с мелкозернистой ультраструктурой. Основной локализацией депозитов ЛЦ являются базальные мембраны канальцев и капилляров клубочков, в меньшей степени — мезангиальный матрикс, базальные мембраны гладкомышечных стенок артерий и интерстициальная ткань. Вместе с тем многие исследователи отмечают гетерогенность изменений при световой микроскопии. В ряде случаев клубочки могут выглядеть неизмененными или отмечается небольшое расширение мезангия. В 32% случаев БДЛЦ изменений при световой микроскопии не выявлено [13].
Наиболее информативным методом исследования в диагностике нефропатии вследствие БДЛЦ является иммунофлюоресцентное исследование биоптата почки. Диагноз считают подтвержденным при обнаружении линейно расположенных депозитов вдоль базальной мембраны канальцев и/или клубочков, содержащих моноклональные ЛЦ одного типа (чаще κ). Реже депозиты выявляют в других структурах нефрона: в мезангии (83%), интерстициальной ткани (30%), артериолах (65%) [3, 5].
При электронной микроскопии выявляют гранулярные электронно-плотные депозиты, расположенные в базальной мембране клубочков, канальцев, стенках артерий, мезангиальном матриксе и интерстициальной ткани. В базальной мембране клубочков мелкогранулярный электронно-плотный материал локализуется преимущественно субэндотелиально, при локализации в канальцевой базальной мембране — вдоль наружной ее части, обращенной к интерстициальной ткани.
Нефропатия вследствие БДЛЦ проявляется клубочковой протеинурией, микрогематурией, характерна артериальная гипертония, примерно в половине случаев развивается нефротический синдром. Почечную недостаточность (ПН) выявляют в момент диагностики у 96% пациентов. В среднем через 2 года от начала заболевания у 57% развивается уремия, при которой требуется лечение программным гемодиализом (ГД) [3].
При исследовании биоптатов почек лишь у 2—8% больных ММ выявляют БДЛЦ [6, 14, 15]. Чаще (в 15— 27% случаев) выявляют сочетанное поражение в виде БДЛЦ и К.Н. При сочетанном поражении почек нефротический синдром отсутствует, часто в дебюте заболевания развивается зависимая от диализа П.Н. При световой микроскопии нодулярный гломерулосклероз выявляют значительно реже — лишь в 18% случаев. Клубочки могут выглядеть неизмененными, иногда обнаруживают умеренное расширение мезангия [15, 16].
Терапия БДЛЦ направлена на эрадикацию клона плазматических клеток. При легкой и умеренной ПН (скорость клубочковой фильтрации — СКФ более 30 мл/мин) в результате успешного лечения возможно сохранение или улучшение функции почек. При тяжелой ПН (СКФ 
В результате терапии по программе VCD у 4 пациентов получена ПР, у 3 — ОхЧР. В связи с неэффективностью 2 больных переведены на терапию второй линии, включающую леналидомид и дексаметазон (Rd), что позволило достигнуть ПР и частичной ремиссии (ЧР). После завершения индукционной терапии в 2 случаях выполнена высокодозная ХТ с аутоТГСК. Несмотря на достижение гематологического ответа у всех больных, функция почек улучшилась лишь у 2 (табл. 2).

Обсуждение
Диагноз БДЛЦ основан на морфологическом исследовании биоптата пораженных органов, в основном почек, что сопряжено с необходимостью выполнения пункционной биопсии и связанным с этим риском развития геморрагических осложнений. Во всех представленных случаях поражение почек было основным синдромом заболевания, что послужило основанием для госпитализации пациентов в нефрологическую клинику. Впервые выявленная ПН неясной природы явилась показанием к выполнению биопсии почки, что позволило диагностировать БДЛЦ.
Нефропатия вследствие БДЛЦ — показание к углубленному гематологическому обследованию для уточнения выраженности плазматической инфильтрации костного мозга, показателей моноклональной секреции, а также для исключения опухолевых заболеваний системы крови. Наш небольшой опыт показал, что у большинства больных при тщательном диагностическом поиске, включающем цитологическое, гистологическое, а также иммуногистохимическое исследование костного мозга, низкодозовую компьютерную томографию всех костей скелета, доказана М.М. Лишь у 3 пациентов признаки опухолевого заболевания не обнаружены, на основании чего БДЛЦ рассматривалась в рамках МГПП. Обращает внимание, что ММ с БДЛЦ (без сопутствующей КН) характеризуется небольшой опухолевой массой (I стадия по классификации Durie—Salmon, 1975 г.) и соответственно отсутствуют такие симптомы ММ, как оссалгии, гиперкальциемия, мягкотканные образования. Эти наблюдения подтверждают, что симптомы заболевания в большей степени определяются повреждением органов секретируемым парапротеином, чем пролиферацией плазматических клеток и опухолевой массой.
Независимо от того, ассоциирована ли БДЛЦ с ММ или нет, терапия направлена на редукцию моноклональной секреции и основывается на принципах терапии М.М. Лечение по схемам, содержащим бортезомиб, позволило достигнуть гематологического ответа у 7 из 9 пациентов, в остальных 2 случаях оказалась эффективной терапия второго ряда с леналидомидом. У 2 пациентов использована высокодозная ХТ с мелфаланом с последующей аутоТГСК. Несмотря на то что у 8 из 9 больных достигнута высокая степень гематологического ответа (у 5 пациентов ПР, у 3 ОхЧР), улучшение функции почек отмечено лишь в 2 случаях. Столь низкая частота «почечного» ответа обусловлена тем, что у большинства больных лечение начато поздно — в IV и V стадиях ХБП.
Заключение
Следует обратить внимание специалистов на эту патологию, которую с широким внедрением в нефрологическую практику метода пункционной биопсии почки стали выявлять все чаще. Современные программы терапии позволяют эффективно редуцировать моноклональную секрецию у большинства больных. Однако лишь при своевременно начатом лечении возможно сохранить функцию пораженных органов и существенно продлить жизнь пациентам.
Клинические рекомендации по диагностике и лечению системного амилоидоза
В клинических рекомендациях, подготовленных специалистами различного профиля, рассматриваются методы диагностики и лечениясистемного амилоидоза, в том числе АА (вто-ричный амилоидоз при хронических воспалительных заболеваниях, включая ревматоидныйартрит, анкилозирующий спондилит, аутовоспалительные заболевания, хроническиенагноения, злокачественные опухоли и др.), AL (амилоидоз при плазмоклеточных дискразиях – идиопатический, при миеломной болезни и макроглобулинемии Вальденстрема) иATTR (транстиретиновый; семейные формыполиневропатического, кардиопатического идругого амилоидоза, системный старческийамилоидоз). Диагноз амилоидоза, которыйможно заподозрить на основании клиническихданных, необходимо подтвердить при гистологическом исследовании (окрашивание препаратов ткани конго-красным с последующей микроскопией в поляризованном свете). Чтобы замедлить или приостановить прогрессирование амилоидоза любого типа, необходимо добиться уменьшения количества (или, если возможно, удаления) белков-предшественников путем лечения хронического воспаленияпри АА-амилоидозе или подавления пролиферации клона плазматических клеток для уменьшения продукции легких цепей иммуно-глобулинов при AL-амилоидозе. Для замедления прогресирования ATTR-амилоидоза упациентов с полиневропатией применяют тафамидис, который ингибирует диссоциацию мутантного транстиретина и снижает его амилоидогенность.
Определение, классификация, группы риска и принципы диагностики
Амилоидоз – группа заболеваний, отличительным признаком которых является отложение в тканях и органах фибриллярного гликопротеида амилоида. Специфическое свойство амилоида, отличающее его от других фибриллярных белков стромы, – способность к двойному лучепреломлению, что проявляется свечением в поляризованном свете предварительно окрашенных конгокрасным препаратов амилоида с изменением красного цвета конгофильных амилоидных отложений на яблочно-зеленый (дихроизм).
В основе амилоидогенеза лежит синтез большого количества нестабильных белковпредшественников, которые агрегируются с образованием амилоидной фибриллы. Клю чевое значение имеет амилоидогенность основного белка-предшественника амилоида, специфичного для каждой формы амилоидоза (в настоящее время известно более 30 таких белков), обозначение которого положено в основу современной классификации заболевания (ВОЗ, 2016 г.). Названия типов амилоида включают в себя букву А, означающую “амилоид», и обозначение конкретного фибриллярного белка амилоида – А (амилоидный А-протеин), L (легкие цепи иммуноглобулинов), TTR (транстиретин), β2М (β2-микроглобулин), В (В-протеин), IAPP (островковый амилоидный полипептид). Используют также производные наименования – иммуноглобулиновый амилоидоз (AL), транстиретиновый (ATTR) и др. (табл. 1) 2. Следует отметить, что Международная классификация болезней (МКБ) 10-го пересмотра базируется на клиническом принципе, не учитывает особенности патогенеза различных форм амилоидоза и не позволяет обосновать адекватное лечение.
| Белок амилоида | Белок-Белок-предшественник | Клиническая форма амилоидоза |
|---|---|---|
| АА | SSA-белок | Вторичный амилоидоз при хронических воспалительных заболеваниях, в том числе периодической болезни и синдроме Макла-Уэллса |
| AL | λ, κ-легкие цепи иммуноглобулинов | Амилоидоз при плазмоклеточных дискразиях – идиопатический, при миеломной болезни и макроглобулинемии Вальденстрема |
| ATTR | Транстиретин | Семейные формы полиневропатического, кардиопатического и др. амилоидоза, системный старческий амилоидоз |
| Аβ2М | β2-микроглобулин | Диализный амилоидоз |
| AGel | Гелсолин | Финская семейная амилоидная полиневропатия |
| AApoAI | Аполипопротеин А-I | Амилоидная полиневропатия (III тип по van Allen, 1956 г.) |
| AFib | Фибриноген | Амилоидная нефропатия |
| Aβ2 | β-белок | Болезнь Альцгеймера, синдром Дауна, наследственные кровоизлияния в мозг с амилоидозом |
| APrPScr | Прионовый белок | Болезнь Крейтцфельда-Якоба, болезнь Герстманна-Штраусслера-Шейнкера |
| AANF | Предсердный натрийуретический фактор | Изолированный амилоидоз предсердий |
| AIAPP | Амилин | Изолированный амилоидоз в островках Лангерганса при сахарном диабете 2 типа, инсулиноме |
| ACal | Прокальцитонин | При медуллярном раке щитовидной железы |
| ACys | Цистатин С | Наследственные кровоизлияния в мозг с амилоидозом (Исландия) |
АА-амилоидоз чаще всего развивается при ревматоидном артрите, серонегативных спондилоартропатиях, аутовоспалительных наследственных периодических лихорадках, в том числе периодической болезни (семейной средиземноморской лихорадке), а также при хронических нагноениях, туберкулезе. АА-амилоид образуется из сывороточного предшественника SAA (serum amyloid A) – острофазового белка, продуцируемого в значительных количествах в ответ на воспаление. По этой причине АА-амилоидоз называют также реактивным или вторичным.
Клинические формы AL-амилоидоза обусловлены единым этиологическим фактором – В-лимфоцитарной дискразией, характеризующейся формированием аномального клона плазматических или В-клеток в костном мозге, которые продуцируют аномальные иммуноглобулины, обладающие амилоидогенностью (легкие цепи моноклонального иммуноглобулина, чаще λ, реже κ-типа). При первичном AL-амилоидозе плазмоклеточная дискразия относительно более доброкачественная, в то время как при В-гемобластозах (множественной миеломе, болезни Вальденстрема и др.) она обладает признаками злокачественной опухоли. Аномальный амилоидогенный клон плазматических клеток может формироваться также из плазмоцитов, локализующихся вне костного мозга, что может привести к развитию локального амилоидоза. Наиболее распространенные локальные формы AL-амилоидоза – амилоидоз трахеи, бронхов и гортани, мочевого пузыря. Выявление плазмоклеточной дискразии необходимо для диагностики AL-амилоидоза, а также для оценки его риска и дифференциального диагноза.
ATTR-амилоидоз является необратимо прогрессирующим заболеванием с высокой степенью инвалидизации вследствие тяжелого поражения сердца, периферической и/или автономной полиневропатии. Пациенты обычно умирают в течение 10-12 лет от первых проявлений. Развитие ATTR-амилоидоза обусловлено мутациями в молекуле транстиретина или возрастным нарушением секреции тетрамеров транстиретина печенью. В обоих случаях происходит распад тетрамеров транстиретина до мономеров, обладающих выраженной конформационной нестабильностью.
Рекомендации:
Клинические проявления
Для вторичного АА-амилоидоза характерно более раннее начало, чем для AL-амилоидоза (средний возраст больных составляет около 40 и 65 лет, соответственно). ATTR-амилоидоз, несмотря на наследственную природу, характеризуется низкой пенетрантностью и также проявляется обычно после 35 лет.
Поражение почек – ведущий клинический признак АА- и AL-амилоидоза, наблюдающийся практически у всех больных. Поражение почек встречается и у больных с многими формами семейного амилоидоза (AFib, ALys, AGel и др.). При ATTR-амилоидозе нефропатия отмечается лишь у 20-23% больных. Клинически амилоидная нефропатия характеризуется неуклонно прогрессирующим течением с последовательной сменой стадий: протеинурия, нефротический синдром, хроническая почечная недостаточность (ХПН). Иногда возможно развитие ХПН без предшествующего нефротического синдрома.
Поражение сердца развивается у подавляющего большинства больных AL-амилоидозом и у 50-60% пациентов с АTTR-амилоидозом, но не характерно для АА-амилоидоза (рис. 1). При эхокардиографии у больных амилоидозом сердца наблюдается утолщение межжелудочковой перегородки и стенки левого желудочка (чаще симметричное), которое не сопровождается электрокардиографическими признаками гипертрофии миокарда. У части больных отмечается снижение вольтажа зубцов на ЭКГ, хотя отсутствие этого признака не исключает диагноз амилоидоза сердца. Нарушение диастолической функции левого желудочка (рестриктивный тип) приводит к развитию сердечной недостаточности, которая быстро прогрессирует, плохо поддается лечению и почти у 50% пациентов оказывается причиной смерти. Кроме того, у больных амилоидозом сердца часто наблюдаются различные аритмии и нарушения проводимости.
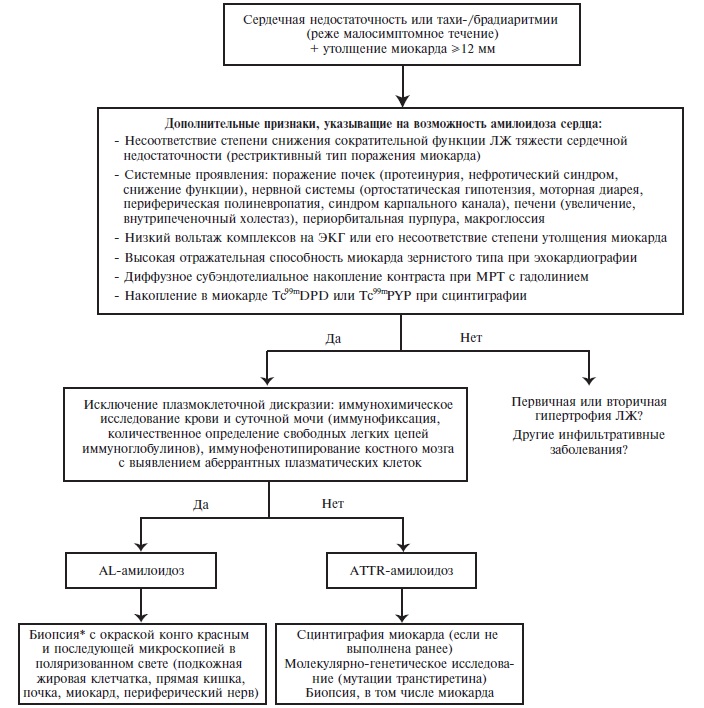
При AL-амилоидозе и особенно ATTR-амилоидозе часто встречается ортостатическая артериальная гипотензия – вариант сосудистой недостаточности, при которой сосуды теряют способность поддерживать нормальное артериальное давление в условиях ортостатических нагрузок. Она проявляется ощущением дурноты и потемнением в глазах в ортостазе в сочетании с резким снижением АД. Обычно этот симптом связан с дисфункцией автономной нервной системы (амилоидоз нервных сплетений сосудов). Тяжелая ортостатическая гипотензия сопровождается обмороками, а иногда приводит к развитию острого нарушения мозгового кровообращения.
Поражение желудочно-кишечного тракта может проявляться, особенно при AL-амилоидозе, тяжелой диареей или динамической непроходимостью, которые чаще связаны с нарушениями моторики кишечника вследствие дисфункции автономных нервных сплетений. Иногда выявляют изъязвления или перфорацию стенок с возможным кровотечением. При поражении пищевода возможна дисфагия.
Поражение печени при АА- и AL-типах амилоидоза наблюдают практически в 100% случаев. Функция печени чаще остается сохранной, редким признаком амилоидоза печени является внутрипеченочная портальная гипертензия. При некоторых вариантах семейного ALys-амилоидоза описаны тяжелые спонтанные внутрипеченочные кровотечения.
Увеличение селезенки, обусловленное амилоидным поражением, отмечается у большинства больных и обычно сопутствует увеличению печени.
Поражение нервной системы, представленное симптомами периферической соматической и автономной невропатии, отмечают у 17-35% больных AL-амилоидозом и практически у всех пациентов с наследственной амилоидной полиневропатией разных типов (ATTR, AApoA1 и др.). В большинстве случаев развивается дистальная симметричная полиневропатия с неуклонно прогрессирующим течением, различные дисфункции автономной нервной системы. Реже выявляют двусторонний синдром запястного канала, обусловленный сдавлением срединного нерва депозитами амилоида.
Поражение кожи наблюдают почти у 40% больных AL-амилоидозом. Помимо параорбитальных геморрагий описаны также папулы, бляшки, узелки, пузырьковые высыпания, склеродермоподобная индурация кожи.
Амилоидные отложения в мышцах чаще встречаются при AL-амилоидозе. Макроглоссия – патогномоничный симптом AL-амилоидоза, развивающийся примерно у 20% пациентов.
Редким проявлением амилоидоза, описанным при AL- и, в особенности, АTTR-типах, бывает поражение глаз (сухой кератоконъюнктивит, вторичная глаукома, помутнение стекловидного тела, дисфункции зрачка).
Клиническая картина других типов амилоидоза варьируется в зависимости от основной локализации и распространенности амилоидных депозитов, которые иногда могут быть значительными и напоминать проявления AL-амилоидоза.
Рекомендации:
Лечение системного амилоидоза
Целью терапии любого типа амилоидоза служит уменьшение количества (или, если возможно, удаление) белков-предшественников для того, чтобы замедлить или приостановить прогрессирование болезни. Неблаго приятный прогноз при естественном течении амилоидоза оправдывает применение агрессивных методов лечения. Клиническое улучшение, достигаемое с помощью лечения, включает стабилизацию или восстановление функции жизненно важных органов, а также предотвращение функциональных нарушений с увеличением продолжительности жизни больных. Лечение амилоидоза должно включать симптоматические методы, направленные на уменьшение выраженности сердечной недостаточности, аритмии, отечного синдрома, коррекцию артериальной гипотензии и др.
Лечение АА-амилоидоза
Цель терапии АА-амилоидоза – подавление продукции белка-предшественника SAA (вплоть до устойчивой нормализации), что достигается активным лечением хронического воспаления (в том числе субклинического). Это позволяет уменьшить клинические проявления и предотвратить прогрессирование амилоидной нефропатии и существенно улучшить прогноз.
Рекомендации:
Лечение АL-амилоидоза
При AL-амилоидозе, как и при множественной миеломе, целью лечения служит подавление пролиферации клона плазматических клеток для уменьшения продукции легких цепей иммуноглобулинов. В отличие от множественной миеломы, принципиальной задачей лечения AL-амилоидоза является по возможности полная элиминация патологического клона. В связи с быстрым прогрессированием заболевания важное значение имеет применение быстродействующих схем лечения на основе бортезомиба. По мере достижения ремиссии у некоторых больных применяют высокодозную химиотерапию с поддержкой аутологичными стволовыми клетками. При строгом подборе больных с исключением противопоказаний к этой терапии эффект достигают у 60% больных. У больных с клиническими симптомами амилоидоза сердца, ортостатической гипотензией, диареей, желудочно-кишечными кровотечениями в анамнезе, а также у лиц старше 70 лет с амилоидным поражением двух и более систем организма проведение высокодозной химиотерапии не рекомендуется. Тяжелый агранулоцитоз и другие осложнения существенно ограничивают ее применение. Проводят также лечение талидомидом или леналидомидом. Колхицин при AL-амилоидозе не эффективен.
Рекомендации:
Лечение ATTR-амилоидоза
До недавнего времени единственным методом лечения ATTR-амилоидоза была трансплантация печени, секретирующей нормальный транстиретин. Поскольку 98% всего сывороточного транстиретина синтезируется печенью, это позволяло прервать продукцию мутантного транстиретина. Трансплантация печени существенно замедляет прогрессирование ATTR-амилоидоза, а 20летняя выживаемость больных после трансплантации составляла 55,3% [36]. Однако уже имеющиеся массы амилоида способны выступать в роли ядра нуклеации для новых депозитов амилоида на основе нормального транстиретина (амилоидускоряющая субстанция). В настоящее время у больных с ранними стадиями ATTRамилоидной полиневропатии апробированы консервативные методы стабилизации тетрамерной структуры мутантного транстиретина и, следовательно, подавления его амилоидогенности. Один из таких препаратов – тафамидис замедлял на 52% (р=0,027) прогрессиро вание неврологических нарушений у больных ATTRамилоидозом, сохраняя функцию периферических соматических и автономных нервных волокон [12]. В клиническом исследовании III фазы лечение тафамидисом по сравнению с плацебо у больных с ATTR-амилоидозом сердца вызывало снижение общей смертности и частоты госпитализаций по сердечно-сосудистым причинам и задерживало ухудшение функциональной активности [81]. В Российской Федерации применение тафамидиса зарегистрировано только для лечения ATTR-амилоидоза с периферической полиневропатией.
В качестве стабилизатора транстиретина изучается также дифлюнизал из группы нестероидных противовоспалительных препаратов, однако его эффективность показана только в экспериментальных условиях.
Что такое болезнь легких цепей
Болезни отложения иммуноглобулинов – это группа заболеваний, при которых нарушается работа отдельных органов из-за отложения там неполноценных, дефектных иммуноглобулинов.
Иммуноглобулин – это очень крупная молекула, главный боец защитных сил организма. Такая молекула состоит из четырех иммуноглобулиновых молекул поменьше, которые ученые называют «цепи». Этих цепей четыре, из них две легкие и две тяжелые. Как детский конструктор на магнитах, отдельные цепи сами «складываются» в единую большую молекулу иммуноглобулина. При болезнях отложения иммуноглобулинов в костном мозге появляются больные плазматические клетки, которые производят дефектные цепи. Сборка больших молекул иммуноглобулинов нарушается, и неполноценные свободные цепи начинают откладываться, «складироваться» во внутренних органах. Ученым пока не удалось выяснить, почему у одних людей страдают почки, у других, например, сердце, а у третьих печень. Являются ли эти болезни опухолями? Ответить на это вопрос сложно. Скорее всего, в организме не образуется отдельная группа больных клеток, как это происходит при опухолях, а в общем нарушается действие внутренних иммунных сил. Поэтому, например, когда при тяжелых заболеваниях (хронической инфекции, множественной миеломе, некоторых опухолях…) процесс производства иммуноглобулинов слишком затягивается и неизбежно возникает некоторое количество «бракованных» иммуноглобулинов, то тоже может начаться их отложение во внутренних органах.
Болезни отложения иммуноглобулинов следующие:
Первичный амилоидоз
Слово амилоидоз образовано от греческих слов amylon «крахмал» и eidos «вид», поскольку при анализе в клетках больного организма находят вещество амилоид, который, как и крахмал, окрашивается в синий цвет, когда его обрабатывают йодом и серной кислотой. Амилоидозом чаще заболевают люди старше 40 лет, и средний возраст больных около 65 лет. Первичный амилоидоз – это болезнь, при которой нарушается работа отдельных внутренних органов, утолщаются кожа и слизистые оболочки из-за отложения там легких цепей иммуноглобулинов. Если пострадало сердце, то начинаются перебои в его работе и отекают ноги; если вовлечена печень, то появляется желтуха; если поражен желудочно-кишечный тракт, то возникают умеренные желудочные и кишечные кровотечения, нарушается стул, и так далее.
Чтобы поставить диагноз, берут для гистологического исследования маленький кусочек заболевшего органа. Диагноз «амилоидоз» ставят, если находят в нем амилоид.
В лечении больных амилоидозом есть два главных подхода. Если пациент достаточно молод и здоров, то его можно лечить большими дозами химиопрепаратов, что позволяет на годы забыть о болезни. В других случаях используют маленькие, но достаточные дозы лекарств, которые дают возможность затормозить развитие болезни.
Болезнь отложения легких или тяжелых моноклональных цепей (болезнь Рандалла)
Болезнь Рандалла встречается очень редко. Средний возраст больных около 56 лет. Обычно она сопровождает множественную миелому. При болезни Рандалла во внутренних органах (чаще – в почках) откладываются легкие и\или тяжелые цепи иммуноглобулинов. Если страдают почки, то возникают отеки, резко повышается белок в моче, поднимается артериальное давление.
Диагноз ставят, если находят отложения легких или тяжелых моноклональных цепей при гистологическом исследовании маленького кусочка заболевшего органа.
Лечение пациентов с болезнью Рандалла похоже на лечение пациентов с множественной миеломой. В зависимости от общего состояния больного выбирают наиболее подходящую терапию. Средний срок жизни больных от постановки диагноза составляет около четырех лет.
Остеосклеротическая миелома
Остеосклеротическая миелома – это болезнь плазматических клеток, при которой в костном мозге вместо нормальных кроветворящих клеток разрастаются клетки грубой соединительной ткани. Остеосклеротическая миелома часто встречается в составе другой болезни – POEMS-синдрома. Средний возраст пациентов около 50 лет.
Чтобы поставить диагноз, необходимо сделать гистологическое исследование костного мозга.
Лечение пациентов с остеосклеротической миеломой такое же, как и при множественной миеломе, однако прогноз более благоприятный. Среднее время жизни больных от постановки диагноза около пятнадцати лет.