что такое биологические препараты для лечения
Что такое генно-инженерная терапия?
Принимать ГИБП можно лишь по заключению врача
Генно-инженерная терапия — это современная терапия с применением генно-инженерных биологических препаратов. Генно-инженерные биологические препараты (ГИБП) — это лекарственные средства, различными по механизму действия. Они могут блокировать и ингибировать цитокиновые рецепторы, являются гуманизированными или человеческими моноклональными антителами и.т.д.
Говоря простым языком, в препаратах имеются молекулы, способные прерывать взаимодействия между клетками хозяина и субстанциями, провоцирующими бесконтрольное воспаление.
Такие лекарства используют только ревматологи?
Нет. Также эти препараты используют гематологи, онкологи, гастроэнтерологи, офтальмологи и неврологи, но назначаться они могут только узкоспециализированными экспертами. Ревматолог не может назначить терапию онкологическому пациенту, гастроэнтеролог — пациенту офтальмолога.
Всем ли пациентам с аутоиммунной патологией можно назначать такую терапию?
Связано ли это с высокой стоимостью препаратов?
Экономический аспект, естественно, имеет значение. Но во главу угла ставится здоровье пациента. Это довольно новая группа препаратов, нуждающаяся в крайне аккуратном и выверенном назначении. До первого введения или приема медикамента пациент должен быть детально обследован, необходимо оценить активность заболевания. Необходимо, чтобы это была не субъективная оценка самочувствия, а ряд исследовательских индексов активности. Помимо этого, должна быть доказана неэффективность других лекарственных средств.
Стоит ли приобретать генно-инженерные препараты, не попробовав другие лекарства?
Нет! Это серьезное решение, и принимается оно совместно с врачом — нужно взвесить все «за» и «против».
За генной инженерией будущее, а цитостатики — вчерашний день?
Это совсем не так. Нельзя делить лекарства по принципу «новое — значит надёжное, а старое — неэффективное». Это в корне неверно, а иногда и крайне опасно.
Можно ли принимать такие препараты без заключения ревматолога?
Данная группа средств требует регулярного взаимодействия с ревматологом. Самолечение может привести к огромному количеству проблем, например: отсутствие лекарственного обеспечения, ускользание эффекта, нежелательные побочные явления и обострение скрытых инфекций. Даже несколько инъекций, выполненных без назначения и контроля ревматолога, могут привести к плачевным исходам. Это авантюра, которая в некоторых случаях может привести к летальному исходу. Принимать ГИБП можно лишь по заключению врача, который умеет работать с ними и осуществлять контроль безопасности. Это очень важно.
Запишитесь на консультацию к врачу-ревматологу в медицинский центр «Неббиоло» и получите ответы на все интересующие вас вопросы о генно-инженерной биологической терапии!
Вся правда о БИОпрепаратах: плюсы, минусы и рекомендации
В чем отличие БИОпрепаратов от химпрепаратов, каковы плюсы и минусы применения, и какие препараты есть сейчас на рынке?
Так как охватить все разнообразие биопрепаратов в одном материале не представляется возможным, то мы остановимся в основном на биопрепаратах, применяемых для борьбы с болезнями и вредителями.
Какие бывают БИОпрепараты? какие у них преимущества перед химпрепаратами и какие недостатки?
Что такое биопрепараты и какие они бывают?
Биопрепараты – живые организмы или естественные биологически высокоактивные химические соединения, синтезируемые живыми организмами.
Спектр биологических препаратов очень широк, выделяют:
Плюсы биопрепаратов
Авермектины
Токсические вещества, продукты жизнедеятельности грибов Streptomyces avermitilis. Препараты на их основе определяют как биопестициды.
Авермектины обладают инсектицидными и акарицидными свойствами. Впервые эти свойства были доказаны специалистами фирмы «Мерк и Ко» еще в 1970-е годы, уже в 1984 году они были
получены в лаборатории искусственно.
Авермектины – препараты с нейротоксинным типом действия. Они эффективны даже против насекомых, устойчивых ко многим другим классическим пестицидным препаратам. Рабочая температура для авермектинов +20 °С, при температуре выше +28 °С эффективность возрастает вдвое.
Плюсы авермектинов
Минусы авермектинов
Опасность для человека
Класс опасности для человека: 3
При этом токсичность напрямую зависит от возраста человека: они опаснее людям до 21 года. К работе с ними и в зону обработки нельзя допускать детей, подростков и беременных женщин. В целом авермектины не вызывают кожно-раздражающих и аллергических реакций, однако возможна индивидуальная чувствительность.
БИОпрепараты авермектиновой группы
Акарин Биологический препарат контактно-кишечного действия для борьбы с клещами на смородине и овощных культурах. Также эффективен и против комплекса насекомых-вредителей.
Фитоверм Защищает от широкого спектра насекомых-вредителей и клещей, в том числе паутинных клещей, тлей, белокрылок, гусениц чешуекрылых, личинок пилильщиков.
опрыскивание плодового сада в период плодоношения
Триходермины
Это биопестициды на основе грибов Trichoderma (препараты на их основе – триходермины). Они способны подавлять возбудителей корневой, семенной и почвенной инфекции, а также предотвращать развитие болезней плодов и листьев при нанесении препарата непосредственно на их поверхность.
Плюсы триходерминов
Минусы триходерминов
Опасность для человека
Класс опасности для человека: 4
БИОпрепараты триходерминовой группы
Триходерма Вериде Защищает от корневых и плодовых гнилей, черной ножки, белой и серой гнили, макроспориоза, фузариоза, фитофтороза, антракноза, вилта и др.
Трихоцин Подавляет возбудителей грибных заболеваний (корневые гнили, пятни стости) зерновых колосовых, овощных, плодовых, цветочных культур.
Трихофлор Защищает от корневых и плодовых гнилей, черной ножки, фузариоза, фитофтороза, антракноза, вилта и др.
Бактериальные инсектициды
Биологические инсектициды, созданные на основе различных штаммов энтомопатогенной бактерии Bacillus thuringiensis. Эффективны в отношении четырех сотен разных видов насекомых.
В настоящее время 80–90 % всех инсектицидов – это препараты на основе этого патогена.
Действие препарата простое: бактерии и их токсины, попадая с пищей внутрь насекомого, повреждают внутренние органы, вызывая тем самым паралич и следом – гибель насекомых на 3–5-е сутки после обработки. Максимум эффекта достигается примерно на 10-е сутки.
Плюсы бактериальных инсектицидов
Минусы бактериальных инсектицидов
Опасность для человека
Класс опасности для человека: 3–4
Препараты нетоксичны или малотоксичны для человека. Но, как и в случае с любыми химпрепаратами, не исключена возможность аллергической реакции.
При попадании на открытые участки тела рекомендуется промыть теплой водой с мылом.
БИОпрепараты из группы бактериальных инсектицидов
Лепидоцид Действует избирательно в отношении широкого спектра вредных чешуекрылых. Подходит для борьбы с гусеницами на овощных, ягодных, плодовых и декоративных культурах.
Битоксибациллин (БТБ) Эффективен в отношении вредных чешуекрылых насекомых, паутинного клеща и личинок колорадского жука.
опрыскивание лилий в период бутонизации
Бактериальные фунгициды
Препараты на основе бактерий-антагонистов.
Действующие вещества биопрепаратов представляют собой живые клетки и комплекс метаболитов. К бактериальным фунгицидам, применяющимся в настоящее время, относятся препараты на основе бактерий: Bacillus subtilis, Pseudomonas aureofaciens, Pseudomonas fluorescens, Streptomyces lavendulae. Используются для борьбы с различными болезнями плодовых и овощных культур.
Плюсы бактериальных фунгицидов
БИОпрепараты из группы бактериальных фунгицидов
Альбит Регулятор роста растений со свойствами фунгицида и комплексного удобрения. Повышает сопротивляемость растений болезням (корневые гнили, септориоз, бурая ржавчина, мучнистая роса, сетчатая пятнистость, бактериозы, фитофтороз и т. д.).
Бактофит Препарат для борьбы с грибными и бактериальными болезнями овощных и декоративных растений.
Фитолавин Препарат для профилактики и лечения бактериозов, бактериальной вершинной гнили, альтернариоза, черной бактериальной пятнистости.
Фитоспорин-М Микробиологический препарат, предназначенный для защиты огород ных, садовых, комнатных и оранжерейных растений от комплекса грибных и бактериальных болезней. Защищает растения от мучнистой росы, бурой ржавчины, ризоктониоза, альтернариоза, сухих и мокрых гнилей клубней, фомоза, пероноспороза (ложная мучнистая роса), черной бактериальной пятнистости, бактериального рака, гнили при хранении (белая гниль, серая гниль), фитофтороза, снежной плесени, парши, плодовой гнили, ржавчины, белой пятнистости, ржавой пятнистости, американской мучнистой росы и др.
Вирусы насекомых
Класс пестицидов, содержащих в качестве действующего вещества вирусы, вызывающие болезни насекомых. При их использовании можно снижать численность вредителей до экономически неопасного уровня.
Плюсы препаратов на основе вирусов
Минусы препаратов на основе вирусов
Опасность для человека
Класс опасности для человека: 4
БИОпрепараты на основе вирусов насекомых
Карповирусин, Мадекс Твин Против яблоневой плодожорки
Энтомопатогенные нематоды
Действие препаратов основано на том, что нематоды семейства Steinernematidae обладают симбиотической связьюс патогенными бактериями родов Proteus, Pseudomonas, Staphylococcus, Flavobacterium, которые в свою очередь вызывают гибель насекомых.
Разработчиком препаратов на основе энтомопатогенных нематод является ГНУ «Всероссийский научно-исследовательский институт защиты растений Россельхозакадемии».
Плюсы применения препаратов с нематодами
Минусы применения препаратов с нематодами
Опасность для человека
Класс опасности для человека: 4
БИОпрепараты с нематодами
Нет препаратов, официально зарегистрированных для ЛПХ (личных подсобных хозяйств), для применения в сельском хозяйстве рекомендованы Немабакт и Энтонем-F.
опрыскивание в период плодоношения
Биопрепараты из экстрактов растений
Препараты, полученные из растительных экстрактов (хвои, роз, барбариса и женьшеня) и способные «работать» как фунгициды и стимуляторы (укреплять иммунитет растений и повышать урожайность).
Используются для предпосадочной обработки семян, клубней и луковиц. В период вегетации растений можно проводить 1–2 корневые и 2–3 внекорневые подкормки растений (по инструкции).
Опасность для человека
Класс опасности для человека: 4
БИОпрепараты на основе экстрактов растений
✔ При использовании биопрепаратов важно соблюдать инструкции!
✔ Биопрепараты хранятся обычно около 2 лет (за исключением препаратов с нематодами).
✔ Растворы необходимо готовить непосредственно перед использованием (максимум за пару часов) и использовать сразу.
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 4. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 8. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
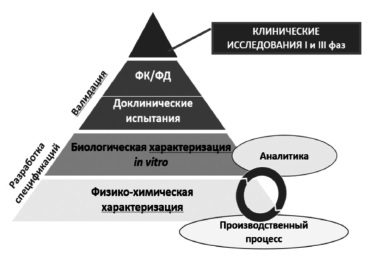
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 19 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.







