что такое бета окисление жирных кислот
Диагностика и лечение метаболических кардиомиопатий, возникающих при нарушениях обмена жирных кислот, у детей
Рассмотрены причины метаболических кардиомиопатий (КМП), возникающих на фоне нарушений обмена жирных кислот. Выделены экстракардиальные и кардиальные критерии диагностики. Ранняя диагностика позволяет своевременно начать специфическое лечение, направленно
Are examined the reasons for metabolic cardiomyopathy (KMP), disturbances of the exchange of fatty acids appearing against the background. The extracardial and cardiac criteria of diagnostics are listed. Early diagnostics makes it possible to begin the specific treatment in proper time, directed toward the correction of metabolic disorders.
Кардиомиопатии (КМП) — гетерогенная группа заболеваний сердца, характеризующихся структурной перестройкой миокарда, с непрерывно прогрессирующим течением и неблагоприятным прогнозом. В большинстве случаев диагностика КМП основывается на клинических симптомах и данных функционального обследования, в первую очередь эхокардиографии [1–3]. При этом истинная этиология КМП не всегда устанавливается. По данным наиболее крупного регистра КМП у детей США и Канады среди группы, в которой причина КМП была установлена, в 29,1% был диагностирован миокардит, в 24,2% — семейная изолированная КМП, в 22,2% — нейромышечные заболевания, в 15,4% — врожденные нарушения метаболизма и в 8,8% — различные генетические синдромы [3–6].
Причинами метаболических КМП являются врожденные нарушения обмена веществ или нарушения функции органелл клетки. Нарушения метаболизма жирных кислот являются наиболее частой причиной развития метаболических КМП. По данным педиатрического регистра при гипертрофических КМП в 20% случаев выявлены нарушения транспорта карнитина или дефекты окисления жирных кислот, нарушения окислительного фосфорилирования [7]. При дилатационных КМП дефекты транспорта карнитина/нарушения оксидации жирных кислот встречаются в 40% [8]. Наследственные дефекты обмена жирных кислот являются причиной не менее 5% случаев внезапной детской смерти [9].
Нарушения метаболизма жирных кислот могут возникать вследствие дефицита карнитина, нарушения транспорта карнитина при недостаточности ферментов, обеспечивающих перенос соединений карнитина, а также при дефектах оксидации жирных кислот [10].
Дефицит карнитина можно определить как дефицит внутриклеточного содержания карнитина, при котором концентрация карнитина в плазме менее 20 мкмоль/л, а содержание карнитина в тканях менее 20% от нормы. В зависимости от причины дефицита карнитина выделяют первичный дефицит карнитина, возникающий при генетически детерминированных дефектах метаболизма карнитина, и вторичный дефицит карнитина, связанный с нарушением обмена органических кислот, дефицитом ацил-КоА-дегидрогеназ, дефектами в цепи дыхательных ферментов митохондрий, рядом соматических заболеваний и патологических состояний [11].
Первичный дефицит карнитина может проявляться в двух формах: системной [13, 14] и мышечной [11, 16]. Системный дефицит карнитина обусловлен мутацией гена SLC22A5, локализованного на длинном плече 5-й хромосомы (5q319), продуктом которого является белок, переносящий карнитин (OCTN2). Результатом этой мутации является дефицит карнитина в тканях. Заболевание наследуется по аутосомно-рецессивному типу [13–14]. При гомозиготной форме сроки манифестации заболевания варьируют от 1 месяца до 7 лет, в среднем 2 года. При гетерозиготной форме манифестация заболевания возникает в подростковом возрасте [14–16].
При раннем дебюте заболевания первыми признаками являются отказ от кормления, раздражительность, низкая прибавка в весе, отставание в физическом и психомоторном развитии. Характерным признаком является гипокетотическая гипогликемическая энцефалопатия (вялость, сонливость, повторная рвота), имеющая приступообразное течение. Во время гипогликемического криза возникают общая слабость, тахикардия, церебральная дисфункция (повышенная возбудимость, раздражительность). В дальнейшем развиваются гепатомегалия, стеатоз печени, нарушения желудочно-кишечного тракта (боли в животе, диарея), скелетная миопатия (мышечная слабость, гипотония), синдром Рейе. Как правило, дети часто болеют интеркуррентными заболеваниями: инфекционные заболевания верхних дыхательных путей и острый гастроэнтерит. У ряда пациентов возникает гипохромная анемия. Тяжесть заболевания варьирует от легких до крайне тяжелых вариантов. При легком течении отставание в физическом и психомоторном развитии может быть единственным проявлением заболевания [14–16].
На ЭКГ определяется высокий вольтаж комплексов QRS за счет компенсаторной гипертрофии субэпикардиальных слоев миокарда. Обязательным признаком являются смещение сегмента ST ниже изолинии в стандартных и левых грудных отведениях, отрицательный зубец Т в этих отведениях, однако могут быть «гигантские» зубцы Т, превышающие по величине зубец R желудочкового комплекса (специфичный признак карнитиновой КМП); признаки гипертрофии левого желудочка, левого предсердия. Рентгенологически определяется кардиомегалия преимущественно за счет увеличения левого желудочка и левого предсердия. Данные эхокардиографии (ЭХО-КГ) выявляют резкое снижение фракции выброса, значительную дилатацию левого желудочка и левого предсердия, гипокинезию межжелудочковой перегородки, смещение митрального клапана к задней стенке левого желудочка, уплотнение эхосигнала от эндокарда.
У гетерозиготных носителей мутации гена SLC22 A5 карнитиновая недостаточность может проявиться в более старшем возрасте в виде гипертрофической КМП [16].
Лабораторные признаки системного дефицита карнитина: низкий уровень карнитина в тканях (печени, мышцах); приступы гипогликемии, не сопровождающиеся кетозом; повышение активности трансаминаз, уровня аммиака в крови; гипохромная анемия. Уровень свободного карнитина в крови обычно резко снижен. При исследовании методом тандемной масс-спектрометрии содержание свободного карнитина (С0) 70–100. В фибробластах снижена активность карнитинпальмитоилтрансферазы I (около 10% от нормы), окисление пальмитата составляет около 5% от нормы [23, 24].
Дефицит карнитинпальмитоилтрасферазы II. Наследование аутосомно-рецессивное, вызывается мутациями в гене карнитинпальмитоилтрансферазы II. Заболевание может протекать в трех формах: неонатальной (летальной), детской (инфантильной) и поздней (форма взрослых).
Неонатальная (летальная) форма характеризуется манифестацией с первых дней жизни, прогрессирующим течением, очень тяжелым состоянием детей и плохим прогнозом. Заболевание проявляется полиорганным поражением. У новорожденных развиваются гипотермия, летаргия, судороги, гипотония, гиперрефлексия и гепатомегалия, почечная недостаточность. Характерны дисморфии лица, контрактуры коленей и локтей, длинные сужающиеся пальцы рук и ног, гепатомегалия (макровезикулярный стеатоз), поликистоз почек, дисплазия почечной паренхимы, гидронефроз, тубулярные расстройства (проксимальный и дистальный канальциевый ацидоз), грубые изменения ЦНС (вентрикуломегалия, кальцификаты, дисплазия мозолистого тела, полимикрогирии, кисты паравентрикулярные и базальных ядер) [25].
Поражение сердца проявляется с рождения в виде гипертрофии левого желудочка или бивентрикулярной гипертрофии, реже возможно развитие кардиомегалии с низкой сократительной способностью сердца. В большинстве случаев регистрируются нарушения ритма сердца, возникновение желудочковой тахиакардии часто является причиной внезапной смерти [25].
Лабораторные признаки: некетотическая гипогликемия, увеличение в сыворотке, моче и тканях длинноцепочечных ацилкарнитинов (С16, С18), снижение плазменного общего и свободного карнитина, длинноцепочечная дикарбоновая ацидурия, гипераммониемия, увеличение общего билирубина, трансаминаз печени, кретинфосфокиназы, высокое содержание дикарбоксильных кислот в моче. Заболевание верифицируется выраженным снижением активности (менее 10% от нормы) карнитинпалмитоилтрансферазы II в большинстве тканей, отсутствием белка CPT II [24, 25].
При морфологическом исследовании обнаруживается накопление липидов в ткани печени, почек, скелетных мышц, легких, надпочечников и др.
Инфантильная форма манифестирует с 3 месяцев, провоцируется лихорадочными состояниями и нарушениями питания. Характерны гепатомегалия, миопатический синдром, судороги. Поражение сердца — по типу дилатационной КМП. Миопатическая форма (поздняя) протекает благоприятно, может дебютировать как в детском возрасте, так и у взрослых. Основные проявления: боли в мышцах, обычно сопровождающиеся миоглобинурией. Характерна высокая активность креатинфосфокиназы в крови, при голодании может возникать умеренный кетоз. Изменения со стороны сердца минимальны [24].
Дефицит карнитинацилкарнитинтранслоказы — редкое аутосомно-рецессивное заболевание, приводящее к нарушению утилизации длинноцепочечных жирных кислот [24]. Выделяют две формы заболевания: неонатальная и инфальтильная. Неонатальная форма характеризуется высокой летальностью вследствие сердечно-легочной недостаточности. Основные проявления: нарушение общего состояния и психомоторного развития, расстройства дыхания, изменения со стороны ЦНС в виде мышечной слабости, судорог, возможно развитие комы на фоне голодания, гепатомегалия с нарушением функции печени.
Поражение сердца встречается чаще по типу дилатационной КМП, характерно снижение систолической функции, возможны нарушения ритма: брадикардия, атриовентрикулярная блокада, желудочковая экстрасистолия, тахикардия. На ЭКГ — признаки гипертрофии левого желудочка. У новорожденных описаны случаи внезапной смерти вследствие апноэ, кардиореспираторного ареста. Если заболевание возникает в более позднем возрасте, то КМП протекает на фоне мышечной слабости и энцефалопатии [10, 26].
Отклонения в лабораторных показателях включают гипогликемию при отсутствии кетоза, увеличение в крови уровня аммиака, иногда калия и мочевой кислоты, высокую активность креатинфосфокиназы, трансаминаз, дикарбоксильную и гидроксидикарбоксильную ацидурию, а также увеличение уровня ацилкарнитинов в крови (С16–С18) в сочетании с низким уровень свободного карнитина (С0). Патология верифицируется низкой активностью карнитин-ацилкарнитин-транслоказы.
Дефекты окисления жирных кислот. Карнитин-ацилтрансферазы осуществляют перенос карнитина к ацильным компонентам коротких, средних и длинных цепей. Ацил-КоА-дегидрогеназы длинных цепей обеспечивают внутримитохондриальную бета-оксидацию жирных кислот с длинными карбоновыми цепями. Ацил-КоА-дегидрогеназы средних цепей регулируют внутримитохондриальное окисление жирных кислот средней длины карбоновых цепей. Ацил-КоА-дегидрогеназы коротких цепей обуславливают внутримитохондриальное окисление жирных кислот с короткой длиной карбоновых цепей, являются буфером ацильных групп, регулируя их поступление в цикл Кребса [27–29].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью возникает в результате мутации гена дегидрогеназы очень длинной цепи ацил-КоА, наследование аутосомно-рецессивное. Мультисистемная патология: поражаются печень (гепатомегалия, стеатоз печени, гепатоцеллюлярный некроз), мышцы. Симптомами поражения мышц являются гипотония, мышечная слабость, связанная с голоданием или инфекцией, боль в мышцах при физической нагрузке, ригидность мышц, рабдомиолиз при физической нагрузке. Миопатические эпизоды вызваны физическими упражнениями, голоданием, инфекцией, воздействием низких температур. По срокам появления первых признаков выделяют 3 формы заболевания: неонатальную, детскую и позднюю [27–29].
Неонатальная форма характеризуется ранней манифестацией, в течение первых дней жизни, с развитием КМП и ранней смерти. Поражение сердца по типу гипертрофической КМП в сочетании со сниженной контрактильной способностью, часто возникают жизнеугрожающие нарушения сердечного ритма. Во время гипогликемической комы возможно развитие асистолии и внезапной смерти [30].
При детской форме (около 40% больных) начальные симптомы обычно появляются на протяжении первого года жизни. Поздняя форма характеризуется более благоприятным течением, манифестирует в подростковом возрасте, клинически проявляется болями в мышцах, как правило, сердце не вовлекается в патологический процесс.
Лабораторные признаки: некетоновая гипогликемия, дикарбоновая ацидурия, повышение концентрации лактата в крови. Диагностический маркер — снижение свободного карнитина при увеличении ацилкарнитинов (С14:1 и С14, С16OH), повышение активности креатинфосфокиназы, ацидурия дикарбоксильных кислот с длинной углеродной цепью (С14–С18) [23]. Специфична низкая активность дегидрогеназы очень длинной цепи ацил-КоА в фибробластах или мононуклеарных лейкоцитах.
Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи возникает в результате мутации гена средней цепи ацил-КоА-дегидрогеназы, наследования аутосомно-рецессивное. Наиболее распространенное нарушение окисления жирных кислот [27, 29].
Характер поражения сердца аналогичен таковому при карнитиновой КМП. Часто возникают тяжелые нарушения сердечного ритма, остановка синусового узла, желудочковая тахикардия (по типу приступов пируэтной тахикардии (torsades de pointes)) [10, 30]. Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи является в 1–3% причиной внезапной смерти у детей раннего возраста [10].
Лабораторные признаки: гипогликемия, метаболический ацидоз, дикарбоновая ацидурия средних цепей, ацилглицинурия, низкое содержание плазменного карнитина. Может отмечаться умеренная кетонурия. В крови повышен уровень среднецепочечных ацилкарнитинов (С6–С10). В моче определяется специфическая органическая ацидурия с преобладанием среднецепочечных дикарбоновых кислот, глициновых конъюгатов [27–28].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с короткой длиной углеродной цепи. Возникает в результате мутации гена короткой цепи ацил-КоА-дегидрогеназы, наследование аутосомно-рецессивное.
Генерализованная форма может проявиться у новорожденных или детей первого года жизни, течение неблагоприятное, возможен летальный исход. Характерны судороги, задержка развития, микроцефалия, повторные приступы рвоты, прогрессирующая мышечная слабость, вялость, сонливость. Поражение сердца характеризуются дилатационной КМП, осложненной тяжелой СН. При мышечной форме первые признаки болезни появляются в старшем возрасте. В клинической картине на первый план выступают миопатические расстройства, низкая толерантность к физической нагрузке. Поражение сердца по типу дилатационной КМП протекает субклинически и выявляется обычно у подростков [29, 30].
Множественный дефицит ацил-КоА-дегидрогеназ описан как глутаровая ацидурия 2-го типа, наследование аутосомно-рецессивное. Патология обусловлена дефектом электронно-транспортного флавопротеина и дефицитом нескольких флавопротеин-содержащих дегидрогеназ, что значительно снижает эффективность митохондриального бета-окисления. Нарушены функции изовалерил-, изобутирил-, метилбутирил-, глутарил-КоА-дегидрогеназ, участвующих в метаболизме ряда аминокислот и холина.
Выделяют несколько клинических форм: неонатальную форму с врожденными аномалиями (летальную), неонатальную форму без врожденных аномалий, позднюю форму.
Метаболические проявления включают тяжелый метаболический ацидоз, гипогликемию, гипераммониемию. Кетоз выражен умеренно или отсутствует, гиперлактат- и гиперпируватемия с увеличением их соотношения до 20 и выше (норма
И. В. Леонтьева, доктор медицинских наук, профессор
Ю. М. Белозеров, доктор медицинских наук, профессор
ФГБУ НИИ педиатрии и детской хирургии Минздравсоцразвития России, Москва
Что такое бета окисление жирных кислот
а) Расщепление жирных кислот до ацетилкоэнзима А путем бета-окисления. Молекула жирной кислоты расщепляется в митохондрии путем постепенного отщепления двууглеродных фрагментов в виде ацетилкоэнзима А (ацетил-КоА). Этот процесс, ход которого представлен на рисунке ниже, называют процессом бета-окисления.
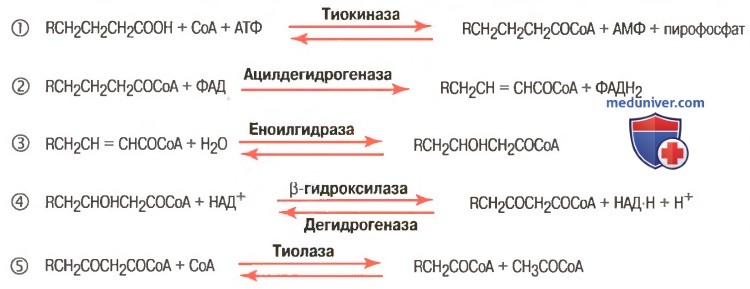
Обратите внимание, что первый этап бета-окисления представляет собой взаимодействие молекулы жирной кислоты с коэнзимом А (КоА) с образованием ацил-КоА жирной кислоты. В уравнениях 2, 3 и 4 бета-углерод (второй углерод справа) ацил-КоА жирной кислоты взаимодействует с молекулой кислорода, вследствие этого бета-углерод окисляется.
В правой части уравнения 5 двууглеродная часть молекулы отщепляется, образуя ацетил-КоА, выделяющийся во внеклеточную жидкость. В то же время другая молекула КоА взаимодействует с концом оставшейся части молекулы жирной кислоты, вновь формируя ацил-КоА жирной кислоты. Сама молекула жирной кислоты в это время становится короче на 2 атома углерода, т.к. первый ацетил-КоА уже отделился от ее терминали.
Затем эта укоротившаяся молекула ацил-КоА жирной кислоты выделяет еще 1 молекулу ацетил-КоА, что приводит к укорочению исходной молекулы жирной кислоты еще на 2 атома углерода. Кроме высвобождения молекул ацетил-КоА из молекул жирных кислот в ходе этого процесса выделяются 4 атома углерода.
б) Окисление ацетил-КоА. Образующиеся в митохондриях в ходе процесса бета-окисления жирных кислот молекулы ацетил-КоА немедленно поступают в цикл лимонной кислоты и, взаимодействуя прежде всего с щавелево-уксусной кислотой, образуют лимонную кислоту, которая затем последовательно окисляется посредством хемоосмотическои. системы окисления митохондрий. Чистый выход реакции цикла лимонной кислоты на 1 молекулу аце-тил-КоА составляет:
Таким образом, после начального расщепления жирной кислоты с образованием ацетил-КоА окончательное их расщепление осуществляется так же, как расщепление ацетил-КоА, образовавшегося из пировиноградной кислоты в процессе метаболизма глюкозы. Образующиеся при этом атомы водорода окисляются той же системой окисления митохондрий, которая используется в процессе окисления углеводов, с образованием большого количества аденозинтрифосфата.
в) При окислении жирных кислот образуется огромное количество АТФ. На рисунке выше показано, что 4 атома водорода, высвобождающиеся при отделении ацетил-КоА от цепочки жирной кислоты, выделяются в виде ФАДН2, НАД-Н и Н+, поэтому при расщеплении 1 молекулы стеариновой кислоты образуется, кроме 9 молекул ацетил-КоА, еще 32 атома водорода. В процессе расщепления каждой из 9 молекул ацетил-КоА в цикле лимонной кислоты выделяются еще 8 атомов водорода, что в итоге дает 72 атома водорода.
Суммарно при расщеплении 1 молекулы стеариновой кислоты выделяются 104 атома водорода. Из этого общего количества 34 атома выделяются, будучи связанными с флавопротеинами, а остальные 70 высвобождаются в форме, связанной с никотинамидадениндинуклеотидом, т.е. в виде НАД-Н+ и Н+.
Окисление водорода, связанного с этими двумя типами веществ, осуществляется в митохондриях, но они вступают в процесс окисления в разных точках, поэтому окисление каждого из 34 атомов водорода, связанных с флавопротеинами, приводит к выделению 1 молекулы АТФ. Еще 1,5 молекулы АТФ синтезируется из каждых 70 НАД+ и Н+. Это дает к 34 еще 105 молекул АТФ (т.е. всего 139) при окислении водорода, отщепляющегося при окислении каждой молекулы стеариновой кислоты.
Дополнительно 9 молекул АТФ образуются в цикле лимонной кислоты (помимо АТФ, получаемой при окислении водорода), по 1 на каждую из 9 молекул метаболизирующегося ацетил-КоА. Итак, при полном окислении 1 молекулы стеариновой кислоты образуются в сумме 148 молекул АТФ. С учетом того, что при взаимодействии стеариновой кислоты с КоА на начальной стадии метаболизма этой жирной кислоты расходуются 2 молекулы АТФ, чистый выход АТФ составляет 146 молекул.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Что такое бета окисление жирных кислот
Наследуемый дефицит карнитин пальмитоилтрансферазы входит в группу митохондриальных болезней с нарушением бета-окисления жирных кислот. Врождённые дефекты оксидации жирных кислот, особенно интенсивно изучающиеся в последние 10–15 лет, насчитывают, по меньшей мере, 12 заболеваний, согласно количеству ферментов, участвующих в процессе окисления. Указанные метаболические дефекты могут иметь серьезные клинические последствия в виде гипогликемических судорог, повреждения мышц, метаболи ческого ацидоза и поражения печени. Считается, что такие клинические состояния, как рабдомиолиз после физической нагрузки, неясная печеночная энцефалопатия и гипокетонемическая гипогликемия с судорожным синдромом в раннем младенческом возрасте, в большинстве случаев ассоциированы с врожденными дефектами митохондриального окисления жирных кислот. Кроме того, известно, что часть случаев синдрома внезапной смерти младенческого возраста асс оциирована с наличием мутаций, характерных для митохондриальных болезней.
● Митохондриальные болезни (в том числе, болезни нарушения бета-окисления жирных кислот) – 20.3 на 100 000;
● Лизосомальные болезни накопления – 19.3 на 100 000;
● Нарушения обмена аминокислот (исключая фенилкетонурию) – 18.7 на 100 000;
● Органические ацидемии – 12.6 на 100 000;
● Фенилкетонурия – 8.1 на 100 000;
● Пероксисомные болезни – 7.4 на 100 000;
● Болезни накопления гликогена – 6.8 на 100 000;
● Болезни нарушения цикла мочевины – 4.5 на 100 000.
Жирные кислоты (ЖК) с различной длиной углеродной цепи (коротко-, средне- и длинноцепочеч ные) являются компонентами триглицеридов и фосфолипидов. Ос новным источником жирных кислот во время голодания являются триглицериды жировой ткани, которые расщепляются под влиянием липаз (ингибируются инсулином), далее жирные кислоты поступают в печень и активируются путем присоединения ацетил-КоА и формирования комплекса ацетил-КоА-ЖК (процесс этерификации, специфический для каждой жирной кислоты). Комплекс ацетил-КоА-ЖК формируется в цитоплазме гепатоцитов, но для проникновения в митохондрии длинноцепочечных ЖК необходим отдельный метаболический путь с участием карнитина и специфических ферментов.
Метаболический путь с участием карнитин пальмитоилтрансферазы (CPT). Во время фазы насыщения организма фермент ацетил-КоА карбоксилаза активен и конвертирует ацетил-КоА (коэнзим А) в малонил-КоА, которы й ингибирует активность CPT 1 типа. Во время фазы голодани я глюкагон деактивирует ацетил-КоА карбоксилазу путём фосфорилирования. Концентрация малонил-КоА падает, что активирует CPT1, которая, находясь на внешней стороне мембран митохондрий, заменяет молекулы КоА на карнитин в цитоплазматически х длинноцепочечных жирных кислотах (ДЖК). Комплекс карнитин-ДЖК перемещается на внутреннюю часть мембран митохондрий, где посредством CPT 2 типа происходит обратная замена карнитина на ацетил-КоА и комплекс ацетил-КоА-ДЖК поступает во внутренние компартаменты митохондрий для участия в процессе бета-оксидации жирных кислот. Процесс переноса длинноцепочечных ЖК через мембрану митохондрий с участием карнитина и соответствующих ферментов носит условное название «карнитиновый шаттл» (рис. 1).
В отличие от длинноцепочечных жирных кислот (C16-18), коротко- и среднецепочечные жирные кислоты не нуждаются в «карнитиновом шаттле» и способны прямо проникать через митохондриальную мембрану. Эта их способность используется в терапевтических целях путем диетического замещения при состояниях, которые связаны с тем или иным нарушением «карнитинового шаттла» (системный дефицит карнитина, дефицит CPT 1 и 2 типов и т.д.).
Дефекты бета-окисления длинноцепочечных жирных кислот можно разделить на 4 группы, имеющие различающиеся клинические проявления и подходы к терапии:
1. Дефект карнитинового траспортера, ведущий к дефициту карнитина – дефицит OCTN2 (organic cation carnitine transporter 2).
2. Дефекты вышеописанного «карнитинового шаттла» – дефициты CPT1 и CPT2 (carnitine palmitoyl-CoA transferase 1 and 2), дефицит CACT (carnitine acylcarnitine translocase).
3. Дефекты непосредственно процесса бета-оксидации – дефицит VLCAD (very-long-chain acyl-CoA dehydrogenase), дефицит LCHAD (long-chain 3-hydroxyacyl-CoA dehydrogenase), дефицит mTFP (mitochondrial trifunctional protein), дефицит LKAT (long-chain 3-ketoacyl-CoA thiolase), дефицит ACAD9 (acyl-CoA dehydrogenase 9).
4. Множественный дефицит ацетил-КоА дегидрогеназ – MAD (multiple acyl-CoA dehydrogenase) дефицит.Митохондриальные болезни с нарушением бета-окисления жирных кислот в большинстве случаев имеют аутосомно-рецессивный характер наследования, клинические проявления чаще всего интермиттирующие и выявляются в периоды повышенной энергетической потребности. Кризы могут быть связаны с голоданием, стрессом (например, инфекцией) и интенсивной физической нагрузкой. Для большинства указанных метаболических дефектов описаны одна или несколько каузальных мутаций, формирующие различающиеся по степени выраженности клинических проявлений фенотипы.
N. Gregersen с соавт. [6] предложили выделять три клинических фенотипа наследуемого дефицита окисления длинноцепочечных жирных кислот:
2. Манифестация в первые годы жизни с относительно нетяжелым течением. В основном проявляется гипокетонемической гипогликемий при стрессовых условиях (голодание, инфекции) и гепатомегалией вследствие гепатостеатоза. Клинические проявления весьма похожи на MCAD дефицит (см. выше). При соответствующем лечении прогноз благоприятный с полной реверсией стеатоза. Терапия такая же, как и при первом фенотипе.
3. Поздняя манифестация (подростки, взрослые) с преобладанием мышечных симптомов. Характеризуется эпизодами мышечной слабости, болей в мышцах и рабдомиолиза после физической нагрузки. Характерна острая или персистирующая гиперферментемия (увеличение концентраций креатинфософкиназы, аминотрансфераз). Анамнез иногда указывает на наличие признаков 1 или 2 фенотипов в раннем детстве. Соответствующие протективные меры (легкоусвояемые углеводы перед предполагаемой нагрузкой, запрет на занятия профессиональным спортом) позволяют избежать потенциально фатального рабдомиолиза.
Ассоциация клинических проявлений с метаболическим дефектом при врожденных нарушениях митохондриального окисления жирных кислот показана в таблице.
Проведенный в последние годы неонатальный скрининг показал, что многие дети с наличием метаболического дефекта окисления длинноцепочечных жирных кислот (VLCAD – оказался самым частым выявляемым дефектом из этой группы, а также CPT1 и CPT2) остаются бессимптомными на протяжении длительного периода наблюдения [12]. Некоторые VLCAD позитивные пациенты со временем развивают симптомы миопатии. Считается, что в основе благоприятного клинического течения митохондриальных болезней может лежать относительно высокая резуидальная активность затронутого дефектом фермента [12].
Ассоциация клинических проявлений с метаболическим дефектом при врожденных нарушениях митохондриального окисления жирных кислот)
Гипокетонемическая гипогликемия после голодания/катаболического стресса
PCD = primary carnitine deficiency, CACT. CPT1, CPT2, LCHAD, MCAD, SCAD, MTP, VLCAD, ACAD9

