что такое бертолетова соль где ее применяют
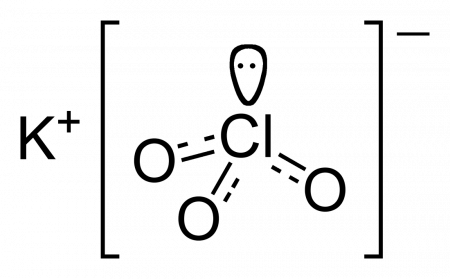
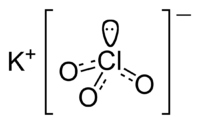
Хлорат калия
| Хлорат калия | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорат калия |
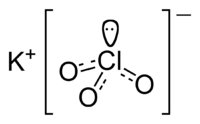
| Химическая формула | KClO3 |
| Физические свойства | |
| Состояние (ст. усл.) | Бесцветные кристаллы |
| Отн. молек. масса | 122.55 а. е. м. |
| Молярная масса | 122.55 г/моль |
| Плотность | 2,32 г/см³ |
| Термические свойства | |
| Температура плавления | 356 °C |
| Температура разложения | |
| Энтальпия образования (ст. усл.) | -391,204 кДж/моль |
| Химические свойства | |
| Растворимость в воде при 0°C | 3,25 г/100 мл |
| Растворимость в воде при 20°C | 7,3 г/100 мл |
| Растворимость в воде при 100°C | 56,2 г/100 мл |
| Растворимость в воде при 104,2°C | 61,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | [3811-04-9] |
Содержание
История
Впервые получен Клодом Бертолле в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:

Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующиеся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, диспропорционирующего далее на хлорат калия и исходный хлорид калия.
Химические свойства
400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:


В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до

Применение
Взрывчатые вещества
Смеси хлората калия с восстановителями (фосфором, серой, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
В медицине
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
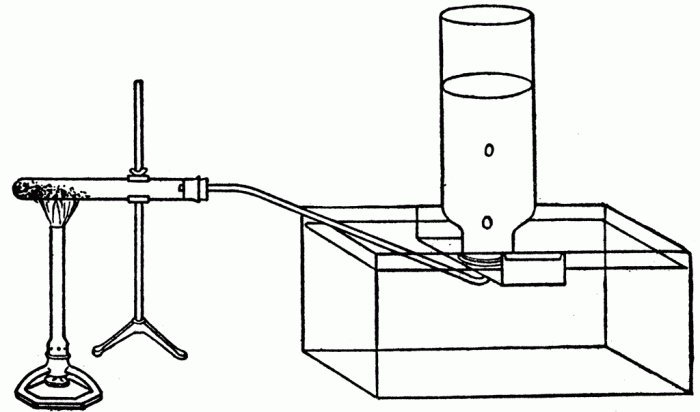
Для получения кислорода
В начале XX века использовалась для лабораторных экспериментов — получения кислорода, но из-за высокой опасности её перестали применять.
Для получения диоксида хлора
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
Полезное
Смотреть что такое «Хлорат калия» в других словарях:
хлорат калия — карбонат калия, хлорноватокислый калий … Cловарь химических синонимов I
Хлорат кальция — Общие Эмпирическая формула Ca(ClO3)2 Физические свойства Молярная масса 206.98 г/моль Плотность 2.71 г/см³ … Википедия
Хлорат меди(II) — Общие Систематическое наименование Хлорат меди(II) Традиционные названия Хлорноватокислая медь Химическая формула Cu(ClO3)2 Физические свойства … Википедия
Хлорат бария — Общие Систематическое наименование Хлорат бария Химическая формула Ba(ClO3)2 Физические свойства Состояние (ст. усл.) твердый … Википедия
Хлорат серебра — Общие Систематическое наименование Хлорат серебра Традиционные названия Хлорноватокислое серебро Химическая формула AgClO3 Физические свойства … Википедия
Хлорат аммония — Общие Систематическое наименование Хлорат аммония Традиционные названия Хлорноватокислый аммоний Химическая формула NH4ClO3 Физические свойства … Википедия
КАЛИЯ ХЛОРАТ — (бертоллетова соль) KClO3, бесцветные кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном производстве и пиротехнике. Ядовит … Большой Энциклопедический словарь
калия хлорат — (бертолетова соль), KClO3, бесцветные кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном производстве и пиротехнике. Ядовит. * * * КАЛИЯ ХЛОРАТ КАЛИЯ ХЛОРАТ (бертолетова соль), KClO3, бесцветные кристаллы. Растворим в воде.… … Энциклопедический словарь
калия хлорат — kalio chloratas statusas T sritis chemija formulė KClO₃ atitikmenys: angl. potassium chlorate rus. бертолетовая соль; калий хлорноватокислый; калия хлорат ryšiai: sinonimas – kalio trioksochloratas sinonimas – Bertoleto druska … Chemijos terminų aiškinamasis žodynas
КАЛИЯ ХЛОРАТ — (Kalii chloras), бертолетова соль, бесцветные блестящие кристаллы. Растворим в воде. Разлагаясь в водных р рах с образованием хлорида калия, действует подобно перекиси водорода, но значительно слабее. В комбинации с тальком (1 : 10) применяют… … Ветеринарный энциклопедический словарь
Бертолетова соль: химические свойства, получение и применение
Происхождение названия
История открытия
Впервые была получена в 1786 году французским химиком Клодом Бертолле. Он пропустил хлор сквозь горячий концентрированный раствор гидроксида калия (фото).
Бертолетова соль: получение
Химические свойства
Если температура нагревания достигает 400 о С, происходит разложение бертолетовой соли, при котором выделяется кислород и промежуточно образуется перхлорат калия. С катализаторами (оксид марганца (4), оксид железа (3), оксид меди и т.п.) температура, при которой происходит этот процесс, становится гораздо меньшей. Бертолетова соль и сульфат аммония могут реагировать в водно-спиртовом растворе и образовывать при этом хлорат аммония.
Применение
Смеси восстановителей (фосфора, серы, органических соединений) и хлората калия являются взрывчатыми и чувствительными к ударам и трению (фото выше). Чувствительность увеличивается, если присутствуют броматы и соли аммония. Из-за высокой чувствительности составы, в которых присутствует бертолетова соль, почти не применяются в производстве военных и промышленных взрывчатых веществ. Иногда ее используют в пиротехнике в качестве источника хлора для составов с цветным пламенем.
Заключение
Теперь вы знаете про бертолетову соль всё. Она может быть как полезной, так и чрезвычайно опасной для человека. Если вы имеете дома спички, то каждый день наблюдаете одну из отраслей применения бертолетовой соли в быту.
Бертолетова соль
Бертолетова соль
| Хлорат калия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорат калия |
| Химическая формула | KClO3 |
| Отн. молек. масса | 122.55 а. е. м. |
| Молярная масса | 122.55 г/моль |
| Физические свойства | |
| Плотность вещества | 2,344 г/см³ |
| Состояние (ст. усл.) | Бесцветные кристаллы |
| Термические свойства | |
| Температура плавления | 356 °C |
| Температура разложения | |
| Химические свойства | |
| Растворимость в воде | 7.3 (20°C) г/100 мл |
| Классификация | |
| номер CAS | [3811-04-9] |
400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до
2KClO3 = 2KCl + 3O2 (150—300 °C, кат. MnO2).