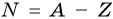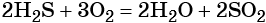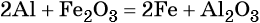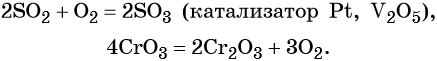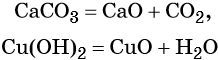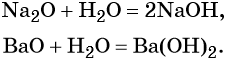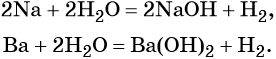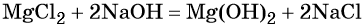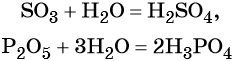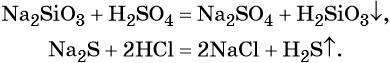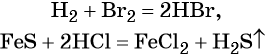что такое атом и молекула в химии
Атом, молекула, вещество
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Атомное ядро состоит из элементарных частиц протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям двигаются электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы (а.е.м.) и зарядом +1 условную единицу.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы.
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Электрон (е – ) — элементарная частица с массой 1/1836 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома.
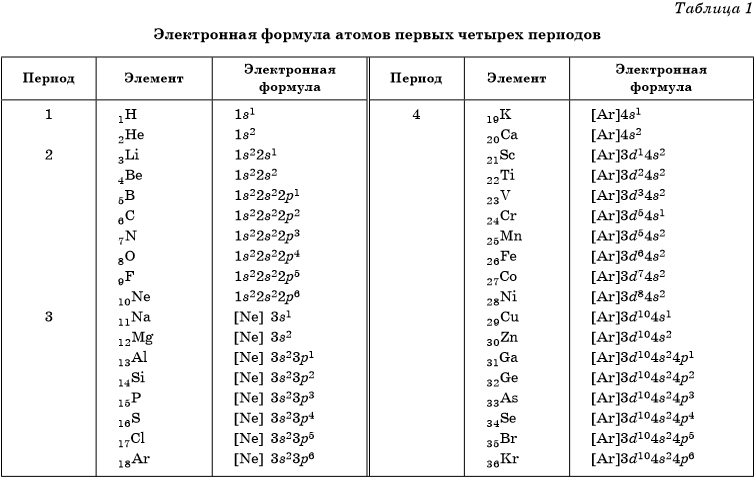
В таблице 1 приведены электронные конфигурации атомов химических элементов первых четырех периодов.
Химический элемент — совокупность атомов с определенным значением (величиной) заряда ядра.
Изотопы — атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Молекула — наименьшая электронейтральная частица вещества, способная к самостоятельному существованию и обладающая его химическими свойствами.
Вещество — любая совокупность атомов и молекул.
Простое вещество образуют одинаковые атомы (например, H2, N2).
Сложное вещество образуют атомы двух и более видов (например, H2SO4, NH3).
Свойства веществ (температуры плавления и кипения, плотность, цвет и т.д.) относятся к совокупности атомов.
Из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Это практически все органические вещества, большинство неметаллов, углекислый газ и вода. У них сравнительно низкие температуры плавления и кипения.
В узлах веществ с атомными кристаллическими решетками находятся отдельные атомы, соединенные между собой очень прочными ковалентными связями. Для этих веществ характерны высокая прочность, высокие температуры плавления (например, алмаз, диоксид кремния).
В узлах веществ с металлическими кристаллическими решетками находятся ионы, между которыми двигаются электроны, общие для всего образца. Это обусловливает общие для металлов свойства: высокую электро- и теплопроводность, характерный металлический блеск.
В узлах веществ с ионными кристаллическими решетками находятся ионы. Их образуют вещества с ионной связью. К таким веществам относятся соли, некоторые оксиды и гидроксиды металлов. Вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий базового уровня сложности с кратким ответом.
Атомы, ионы, молекулы
Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē. Электроны движутся вокруг ядра, перемещаясь по сложным траекториям. Ядро атома состоит из двух типов частиц: протонов и нейтронов. Протоны обозначают буквой р, а нейтроны – n.
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда совпадает с количеством протонов. С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд. Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8.
Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8. Как определить количество нейтронов?
В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
С учетом вышесказанного можем записать несколько простых выражений:
Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»).
Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов. Нуклиды обозначают символом элемента и массовым
Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд).
Есть и элементы одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Ионы
В отличие от атомов, ионы – это заряженные частицы. Ионы образуются в том случае, если нейтральный атом «потеряет» или «приобретет» часть электронов. Например, в результате некоторой реакции, атом натрия утратил один электрон. Обратимся к Периодической Системе, согласно которой узнаем, что в атоме натрия 11 электронов. Если один электрон покинет атом, их останется 10, тогда нарушится принцип электронейтральности атома и положительно заряженное ядро будет доминировать, то есть частица приобретет положительный заряд. Частица Na+ и есть ион. Возможен и другой вариант, атом, в результате химической реакции, может присоединять электроны. В этом случае образуется избыток электронов и, следовательно, суммарный отрицательный заряд электронов больше, чем положительный заряд ядра. Такой ион будет заряжен отрицательно.
Молекулы
Из курса природоведения вам известно, что молекулы образуются из атомов посредством их взаимодействия в результате химических реакций. Например, молекула водорода Н2, образуется при взаимодействии двух атомов водорода. Молекула – наименьшая частица вещества, обладающая его химическими свойствами, состоящая из двух или более атомов Подобно молекулам водорода образуются и другие молекулы, например: молекула азота N2, кислорода О2, хлора Cl2 и другие молекулы. Конечно же, существуют и более сложные молекулы, состоящие из большего числа атомов. Например, сладкий вкус фруктам придает глюкоза. Существуют очень большие молекулы, в состав которых входят десятки, сотни и даже тысячи атомов! Например, молекулы белков, из которых состоят все живые организмы, состоят из сотен и тысяч различных атомов!
Атомно-молекулярная теория
Процесс познания складывается таким образом, что блестящие догадки и великие теории, являвшиеся в свое время результатом гениального творчества, через более или менее продолжительное время становятся едва ли не тривиальными фактами, которые большинство людей принимает на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая, или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят всем известными положениями.
Но для ученых прошлого, пытавшихся решить два основных вопроса:
Результатом стала атомно- молекулярная теория, основные положения которой можно сформулировать следующим образом:
Вывод из статьи про Атомы, ионы, молекулы
Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекулой называют наименьшую электронейтральную частицу вещества, способную к самостоятельному существованию и обладающую его химическими свойствами. Молекула представляет собой систему взаимодействующих между собой атомов, образующих определённую структуру с помощью химических связей.
Химический элемент — совокупность атомов, характеризующихся одинаковым значением (величиной) заряда ядра.
Ионами называют электрически заряженные частицы, возникающие при потере или присоединении электронов атомами или молекулами.
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
Вещество — любая совокупность атомов и молекул.
Свойства веществ (температуры плавления и кипения, плотность, цвет и т. д.) относятся к совокупности атомов или молекул.
По химическому составу неорганические вещества делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента (например, H2, O2).
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В периодической таблице Д.И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведённой через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Сложными называют вещества, которые состоят из атомов двух и более элементов (например, H2S, NO2).
Для выражения состава вещества используют различные химические формулы. При их написании используют общепринятые символы химических элементов. Символ элемента состоит из первой буквы или первой и одной из последующих букв латинского названия элемента, при этом первая буква всегда прописная, а вторая — строчная.
Названия и обозначения атомов совпадают с символами химических элементов. Например, О — атом кислорода, 2О — два атома кислорода, О2 — молекула кислорода, О3 — молекула озона.
Сложные вещества разделяют на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. В формуле сложного вещества вначале ставят катион, а затем — анион, например KBr, CuSO4. Названия сложного вещества читают справа налево, т. е. вначале называют его электроотрицательную составляющую в именительном падеже, а затем электроположительную в родительном падеже.
Для бинарных, т. е. состоящих из двух элементов соединений, действуют следующие правила. Если соединение состоит из металла и неметалла, то на первом месте всегда ставят металл (как более электроположительный элемент): K2S, BaCl2.
В формулах соединений, состоящих только из неметаллов, на первом месте всегда ставят элемент, находящийся левее в условном ряду неметаллов, построенном по их возрастающей электроотрицательности:
Например, IBr — бромид йода, CS2 — дисульфид углерода.
Формула молекулярная (брутто-формула) включает символы всех химических элементов, входящих в состав соединений. Около каждого символа ставят числовой индекс, показывающий, сколько атомов данного вида входит в состав соединения. Таким образом, молекулярная формула показывает качественный и количественный состав молекулы. Например, формула KNO3 показывает, что вещество состоит из 1 атома калия (индекс, равный 1, не ставится), 1 атома азота и 3 атомов кислорода.
Чтобы правильно прочитать формулу, надо знать как русские, так и латинские обозначения элементов. Называя вещество «вода», мы говорим, что его формула H2O (читается «аш два о»). Данное вещество состоит из двух атомов водорода и одного атома кислорода.
Называя вещество сульфат калия, K2SO4, мы читаем его формулу «калий два эс о четыре». Данное вещество состоит из двух атомов калия, одного атома серы и четырех атомов кислорода.
Если в формуле структурный фрагмент повторяется несколько раз, его заключают в круглые скобки и за скобками ставят числовой индекс, который произносят «дважды», «трижды», например, Ca(NO3)2 читается «кальций эн о три дважды», Mg3(PO4)2 читается «магний три пэ о четыре дважды».
Коэффициент, стоящий перед формулой вещества в уравнении реакции, читают как число, например: 3HNO2 — «три аш эн о два».
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и атома кислорода со степенью окисления –2.
Называют оксиды, руководствуясь следующими правилами:
Примеры: K2O — оксид калия, N2O5 — оксид азота (V), CrO3 — оксид хрома (IV).
Для некоторых распространённых оксидов используют тривиальные названия, например CaO — негашеная известь, N2O — веселящий газ, CO — угарный газ, CO2 — углекислый газ.
Оксиды классифицируют так.
Низшими называют оксиды, в которых элемент проявляет низшую степень окисления, например MnO — оксид марганца (II).
Высшими называют оксиды, в которых элемент проявляет высшую степень окисления, например Mn2O7 — оксид марганца (VII).
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни основные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, Rb2O, Cs2O, MgO, CaO, SrO, BaO, Cu2O, Ag2O, HgO, CrO, FeO.
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства, в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Существует несколько способов получения оксидов.
Реакции простых веществ с кислородом:
При взаимодействии сложных веществ с кислородом часто образуется смесь оксидов элементов:
Оксиды металлов реагируют с химически более активными металлами. При этом образуется новый оксид и новый металл:
Некоторые высшие оксиды получают доокислением низших оксидов, а ряд низших оксидов получают разложением высших оксидов:
Иногда для получения оксидов используют реакции разложения солей и гидроксидов:
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания, например: NaOH — однокислотное, Mg(OH)2 — двухкислотное и т. д.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щёлочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Называют основания следующим образом:
Для некоторых распространённых гидрокидов используют тривиальные названия, например: Ca(OH)2 — гашёная известь; NaOH — едкий натр, или каустик.
Существуют следующие способы получения оснований:
Реакция основных оксидов с водой:
Взаимодействие некоторых металлов с водой:
Реакция обмена между солями и основаниями:
Первые два способа применяют для получения растворимых, а последний — для получения нерастворимых в воде оснований. Существуют и иные способы получения оснований.
Все растворы щелочей имеют pH > 7. При этих значениях pH происходит изменение окраски индикаторов: лакмуса — на синюю, фенолфталеина — на малиновую, метилового оранжевого — на жёлтую, что является качественным методом обнаружения щелочей. Более подробный материал о показателе pH будет изложен в уроке 24.
Кислотами называют класс химических соединений, которые содержат в своём составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Основностью кислоты называют число способных замещаться на металл атомов водорода в её молекуле. По основности кислоты делят на одно-, двух- и трёхосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3. Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
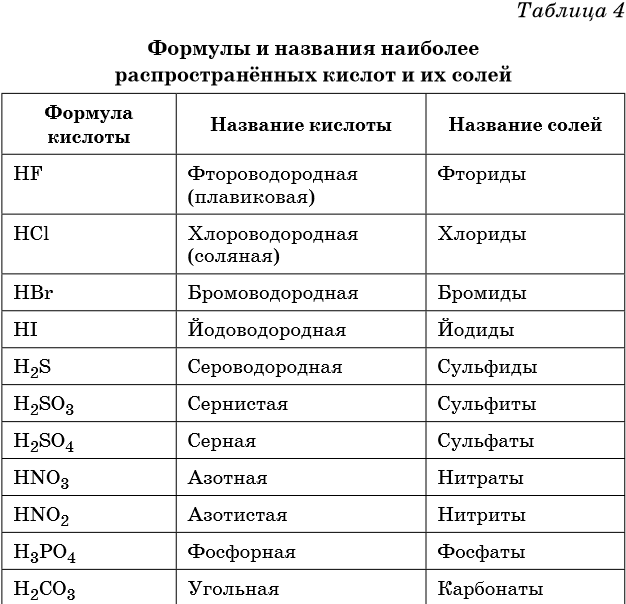
В таблице 4 приведены формулы и названия наиболее распространенных кислот и их солей.
Сильные кислоты: HI, HBr, HCl, HClO3, HClO4, H2SO4, HNO3.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2. Некоторые гидроксиды, например Cu(OH)2, Fe(OH)3, проявляют амфотерные свойства с преобладанием основных.
Большинство кислородных кислот получают реакцией соответствующих оксидов с водой:
Некоторые кислоты получают из солей путём вытеснения более сильной кислотой, например:
Бескислородные кислоты получают прямым взаимодействием неметалла с водородом либо действием более сильных кислот на соответствующие соли:
При обычных условиях кислоты представляют собой жидкости (HNO3, H2SO4), твёрдые (H3PO4) и газообразные (HCl) вещества. Большая часть кислот смешиваются с водой в любых соотношениях. Водные растворы кислот имеют pH
Урок 3 Бесплатно Атомы. Молекулы
Атомно-молекулярное учение в химии
Вы уже знакомы с молекулярным учением.
Оно было нужно учёным для объяснения физических явлений.
Основные положения этой теории говорят нам о том, что:
Однако эти постулаты не могли объяснить, каким образом при упругом столкновении образуются новые вещества.
Решил эту проблему великий русский учёный-энциклопедист Михаил Васильевич Ломоносов.
У меня есть дополнительная информация к этой части урока!
Михаил Васильевич Ломоносов (1711- 1765)– русский учёный-энциклопедист (естествоиспытатель, химик, физик, математик, астроном, металлург).
Основные его достижения в химии: создал первую лабораторию при академии наук, сформулировал закон сохранения массы веществ, разработал рецепты приготовления цветных стёкол.
Основал Московский Университет, который сейчас носит его имя.
В своей книге «Элементы математической химии» Ломоносов сформулировал основы атомно-молекулярного учения, а именно, он рассматривал каждую молекулу как уникальную комбинацию атомов и изменение этих комбинаций в ходе химических взаимодействий. Это именно те тезисы, которыми пользуются учёные до сих пор.
Однако, как и все теории, атомно-молекулярное учение было принято не сразу. В основном из-за того, что работать с такими объектами очень тяжело, ведь атомы и молекулы невозможно увидеть и убедиться в их существовании, а попытки измерения атомных масс часто были неверны.
Через полвека после Ломоносова известный английский ученый Джон Дальтон пошёл ещё дальше. Он утверждал, что атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части или превратить друг в друга. По Дальтону, все атомы одного элемента имеют совершенно одинаковый вес и отличаются от атомов других элементов.
Тезисы Ломоносова и Дальтона в сочетании дали прочный фундамент для дальнейшего развития учения об атомах и молекулах.
Но лишь спустя около 50 лет после Дальтона все эти постулаты были официально признаны учёными того времени.
Основное содержание атомно-молекулярного учения можно представить следующими положениями.
1. Молекула – наименьшая часть вещества, сохраняющая его состав и химические свойства.
2. Молекулы состоят из атомов. Атомы одного элемента сходны друг с другом, но отличаются от атомов других химических элементов.
3. Атомы и молекулы находятся в непрерывном хаотичном движении.
4. Молекулы разрушаются при химических явлениях и сохраняются при физических.
5. Атомы в химических реакциях не разрушаются. Новые вещества образуются в процессе химических реакций из тех атомов, из которых состояли исходные вещества.
Распространение атомно-молекулярного учения способствовало утверждению определений важнейших химических понятий, формированию и развитию единого химического языка, объяснению открытых законов и развитию теоретических исследований. Это позволяет говорить об огромной роли атомно-молекулярного учения в развитии химии.
Пройти тест и получить оценку можно после входа или регистрации
Масса атома. Атомная единица массы
Современная химия располагает данными о массах атомов химических элементов. Эти массы могут быть выражены в любых единицах массы: граммах, килограммах и т. п. Однако вследствие очень малой величины атомов значения их массы, выраженные в этих единицах, очень неудобны для использования. Например, вот массы атомов нескольких химических элементов:
Химический элемент
Масса атома, кг
Мы специально указали числа с одинаковым показателем степени, чтобы вы могли сравнить, насколько сильно отличаются массы атомов разных химических элементов.
Очевидно, что использовать эти значения неудобно.
Поэтому химики решили значения масс всех атомов сократить таким образом, чтобы полученные значения было легко использовать.
Осталось только определиться, что взять за основу.
В итоге за основу была принята масса атома углерода.
Именно углерод взяли по нескольким причинам. Главная из них в том, что углерод составляет основу всех органических соединений.
Если посмотреть на таблицу выше, то можно увидеть, что масса атома углерода в 12 раз больше массы атома водорода – самого легкого химического элемента.
Поэтому была принята атомная единица массы (сокращенно «а.е.м.»), равная 1/12 части массы атома углерода.
Иногда эту единицу называют «Дальтон» в честь ученого Джона Дальтона, который сделал огромный вклад в развитие атомно-молекулярного учения.
Если дополнить нашу таблицу значениями атомных единиц массы для тех же элементов, то сразу станет видно, что такие значения использовать намного удобнее: