что такое антагонист лейкотриеновых рецепторов
Антагонисты леикотриеновых рецепторов в лечении бронхиальной астмы
Опубликовано в журнале:
Южно-Российский медицинский журнал »» N 1-2 / 2001 Пульмонология Голубев Л.А., Бабак С.Л., Григорьянц Г.А.
Московский НИИ пульмонологии
В развитии воспаления важное значение имеют генетические факторы, в частности, атопия. В то же время имеется большое количество доказательств, что факторы окружающей среды являются факторами риска и могут приводить к дебюту заболевания.
Вдыхание аллергенов домашнего клеща, пассивное курение являются особенно важными. К факторам риска также относятся воздействие выбросов автомобилей и профессиональных сенсибилизаторов. Развивающееся воспаление ведет к развитию гиперреактивности бронхов, их обструкции, что поддерживается триггерными механизмами [5].
Хроническое воспаление характерно для астмы вне зависимости от ее тяжести. Воспаление сопровождается развитием гиперреактивности бронхов и бронхиальной обструкции, являющихся двумя определяющими факторами, лежащими в основе нарушения легочной функции. Гиперреактивность дыхательных путей проявляется в чрезмерной бронхоконстрикторной реакции на различные раздражители. Бронхи являются важным компонентом в этой реакции. [5].
В патогенез бронхиальной астмы вовлечены различные медиаторы, продуцирующиеся этими клетками, которые вносят свой вклад в повышение бронхиальной реактивности и клинические проявления астмы. Такие медиаторы, как гистамин, простагландины и лейкотриены непосредственно приводят к сокращению гладкой мускулатуры дыхательных путей, повышению проницаемости сосудов, увеличению секреции слизи в просвет дыхательных путей, активируют другие воспалительные клетки, высвобождающие вторичные медиаторы воспаления.
Одним из механизмов нарушения функции дыхания является бронхиальная обструкция.
По данным P.Devillier и соавт. [17] в основе обструкции дыхательных путей лежит сокращение гладкой мускулатуры бронхов, отек слизистой, увеличение секреции слизи и инфильтрация дыхательных путей клетками воспаления (преимущественно эозинофилами).
В последние годы в патогенезе бронхиальной астмы выявлена роль посредников воспаления нового класса, получивших название лейкотриены.
История открытия лейкотриенов [15, 22] связана с исследованием медленно реагирующей субстанции анафилаксии (SAS-A), Broklekast, 1960.
В 1983 г. B.Samuelsson индентифицировал LTC4, LTD4 и LTE4. В 1993 г. L.Laltlnen и соавт. и в 1997 г. Z.Diamant и соавт. [19] описали триггерную реакцию при активизации рецепторов цистеинил-лейкотриенов в дыхательных путях и клетках воспаления, эффект бронхоконстрикции, отек тканей, секрецию слизи в дыхательных путях и стимуляцию клеток воспаления в легочной ткани. Цистеинил-лейкотриены являлись медиаторами обструкции дыхательных путей при астме.
Лейкотриены образуются из арахидоновой кислоты при участии липоксигеназы. Лейкотриены синтезируются различными клетками [31, 26] под воздействием специфических стимулов: IgE, IgJ, эндотоксинов, факторов фагоцитоза.
Роль лейкотриенов в патогенезе бронхиальной астмы заключается в усилении секреции слизи, подавлении ее клиренса, увеличении выработки катионных белков, повреждающих эпителиальные клетки. Лейкотриены усиливают приток эозинофилов, повышают проницаемость кровеносных сосудов. Они ведут к сокращению гладких мышц бронхов, способствуют миграции клеток, участвующих в развитии воспалительного процесса (активированные Т-клетки, тучные клетки, эозинофилы) [13, 35, 39]. В ряде исследований показано, что у больных бронхиальной астмой в моче обнаруживается лейкотриен Е4 [20].
LTC4 и LTD4 обладают мощным бронхоконстрикторным действием. Эффект бронхоспазма, в отличие от вызванного гистамином, развивается медленнее, но является более продолжительным. Лейкотриены усиливают проницаемость сосудов в 1000 раз эффективнее гистамина. Повышение проницаемости венул объясняется образованием щелей за счет сокращения эндотелия. LTD4 более активно влияет на процесс усиления секреции слизи слизистой оболочкой бронхов.
Установлено, что лейкотриены В4, С4, D4, Е4 играют важную роль в механизмах воспаления и вызывают изменения, характерные для бронхиальной астмы [6, 35]. Лейкотриены С4, D4 приводят к ранним изменениям и вызывают миграцию клеток в зону воспаления дыхательных путей.
Клинические эффекты лейкотриена В4 обуславливают хемотаксис лейкоцитов, адгезию нейтрофилов к эндотелию, освобождение протеаз и образование супероксида нейтрофилами. Это способствует повышению проницаемости капилляров. Лейкотриены D4, С4 и Е4 приводят к спазму гладкой мускулатуры бронхов, развитию отека, привлечению эозинофилов, повышению секреции слизи и нарушению ее транспорта.
Установлено, что лейкотриены связываются рецепторами, локализованными на плазматических мембранах клеток [7]. Выделено три основных типа рецепторов лейкотриенов.
1. Рецептор LTI к лейкотриенам LTC/D/E4. Данный рецептор опосредует бронхоконстрикторный эффект лейкотриенов.
2. Рецептор LT2 к LTC/D/E4; ему принадлежит важная роль в контроле над сосудистой проницаемостью.
3. Рецептор LTB4 опосредует хемотаксический эффект лейкотриенов.
Ингибиторы рецепторов лейкотриенов
Представления о лейкотриенах, как о медиаторах воспаления, позволили разработать концепцию создания нового класса лекарственных препаратов, получивших название «антилейкотриеновые субстанции» [7, 12].
Антилейкотриеновые субстанции включают в себя антагонисты рецепторов к цистеиновым лейкотриенам и препараты, ингибирующие синтез лейкотриенов [24].
Создание лекарственных препаратов, влияющих на синтез лейкотриенов, осуществляется в следующих направлениях. [1, 9, 21, 34, 36].
1. Создание антагонистов рецепторов лейкотриенов. К ним относятся зафирлукаст (акколат, субстанция 1С1204219) пранлукаст (субстанция ONO-1078), побилукаст (субстанция SKF 104353), монтелукаст (сингуляр, субстанция МЛ-0476).
2. Поиск ингибиторов 5-липоксигеназы. Представителем этой группы препаратов является зилеутон (субстанция Ф-64077).
Экспериментальными исследованиями показано, что антагонисты рецепторов лейкотриенов препятствовали развитию бронхоспазма, снижали количество воспалительных клеток (лимфоцитов и эозинофилов) в бронхоальвеолярной жидкости. Данные клинических исследований свидетельствуют о том, что антагонисты лейкотриеновых рецепторов предупреждают развитие симптомов бронхиальной астмы, улучшают функцию легких [40].
Показано, что in vitro антагонисты цистеинил-лейкотриенов конкурируют с лейкотриеном D4 за связь с рецепторами, которые присутствуют в мембранах клеток легких морских свинок и человека [16]. Их сходство с лейкотриеном D4 превышает естественный лиганд примерно в два раза. Антагонисты лейкотриенов (зафирлукаст, монтелукаст, побилукаст) блокируют лейкотриены D4 и Е4, вызывающие сокращение гладкой мускулатуры изолированной трахеи морской свинки, но не блокируют спазм, вызванный лейкотриеном С4. Под их влиянием уменьшается концентрация медиаторов воспаления в зоне развития воспалительного процесса, тормозится заключительная фаза антигениндуцированного бронхоспазма, обеспечивается защита при различных провокациях. [8, 10, 11, 30, 32, 33, 36]
Все ингибиторы рецепторов лейкотриенов с различной степенью активности предупреждают LTD4-индуцированную бронхоконстрикцию [30]. Они блокируют ранний и поздний ответ на воздействие антигена, эффекты на влияние холода и аспирина, увеличивают FEV при легкой и умеренной астме, снижают применение бета-агонистов, усиливают действие антигистаминных препаратов.
Антилейкотриеновые препараты хорошо переносятся больными, не приводят к развитию серьезных осложнений [38]. Важным является то обстоятельство, что они применяются в таблетированной форме один-два раза в день.
Последние исследования показывают, что антагонисты лейкотриенов могут быть использованы в качестве альтернативы кортикостероидной терапии при устойчивой астме легкого течения [21, 27]. Антагонисты лейкотриенов снижают дозу ингаляционных кортикостероидов при обострении астмы.
Лейкотриен D4, действуя на гладкую мускулатуру бронхов, не влияет на синтез ДНК, содержание РНК, коллагена, эластина, бигликана, фибронектина [29]. Некоторые антилейкотриены активировали в печени микросомальную активность и аминотрансферазы.
Антилейкотриены эффективны при индукции бронхоспазма аллергенами, холодным воздухом, физическими упражнениями, аспирином. Клинические наблюдения осуществлены, как в течение короткого, так и длительного наблюдения [23].
Антагонисты лейкотриенов позволяют снизить дозировку других препаратов, используемых для лечения бронхиальной астмы, в частности, b2-агонистов [18]. В настоящее время признано, что лучшим противовоспалительным эффектом обладают кортикостероиды. В то же время, при их длительном применении могут возникать серьезные побочные эффекты [40]. Многие пациенты испытывают трудности при пользовании устройствами для ингаляции, так как ее необходимо проводить несколько раз в день. Отмечены случаи развития локальной и системной толерантности к кортикостероидам [18, 41]. Необходимы дальнейшие исследования в целях определения их эффективности при совместном применении с ингаляционными кортикостероидами [14, 39].
Что такое антагонист лейкотриеновых рецепторов
История открытия лейкотриенов начинается в 1938 году, когда W. Feldberg и C.H. Kellaway занимались изучением влияния яда кобры на легкие морских свинок и обнаружили в перфузате легких вещество, способное вызывать медленное, стойкое сокращение гладких мышц. В 1940 г. C.H. Kellaway и E.R. Trethewie заметили, что это сокращение отличается по продолжительности от сокращения, вызываемого гистамином, и назвали новый медиатор медленно реагирующей субстанцией анафилаксии (МРС-А). В 1960 г. W. Brocklehurst заметил, что при добавлении аллергена к фрагментам легкого, взятых у больного бронхиальной астмой, в них вырабатывается МРСА. Это свидетельствует о том, что МРС-А – медиатор, отвечающий за симптоматику бронхиальной астмы, так как он вызывает более длительный бронхоспазм, чем другой бронхоконстриктор, например, гистамин. А в конце 70-х ученым удалось выяснить, что МРС-А является лейкотриенами. И после этого открытия учеными были предприняты попытки создания лекарств, являющихся ингибиторами синтеза и антагонистами лейкотриенов, которые используются при лечении бронхиальной астмы. [2]
Синтез лейкотриенов – это сложный, многоступенчатый процесс, который начинается с отщепления арахидоновой кислоты от фосфолипидов цитоплазматической мембраны с помощью фермента фосфолипаза А2. Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием циклооксигеназы она превращается в простагландины, а под влиянием липоксигеназной ферментной системы в лейкотриены. Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным ферментом является 5-липоксигеназа (5-ЛОГ). Арахидоновая кислота под воздействием комплекса 5-ЛОГ превращается в оксиэйкозатетраеновые кислоты, из которой в свою очередь образуется LТА4. Во внутриклеточной среде к LТА4 под действием LТС4- синтазы присоединяется глутатион и образуется LТС4. Далее LТС4 выходит во внеклеточную среду, где от него отщепляется остаток глутаминовой кислоты и образуется лейкотриен D4. LТЕ4 образуется при отщеплении остатка глицина от LТD4. (рис.1) Лейкотриены С4, D4 и Е4 содержат цистеин, поэтому их называют цистеиновыми лейкотриенами. Именно цистеиниловые лейкотриены были названы МРС-А. Они имеют одно действие, но лейкотриен Е4 имеет меньшую активность. Ферментные системы, необходимые для синтеза лейкотриенов, были обнаружены в альвеолярных макрофагах, тучных клетках и лейкоцитах. А именно эозинофилы и тучные клетки являются основными эффекторами в патогенезе астмы. [4]
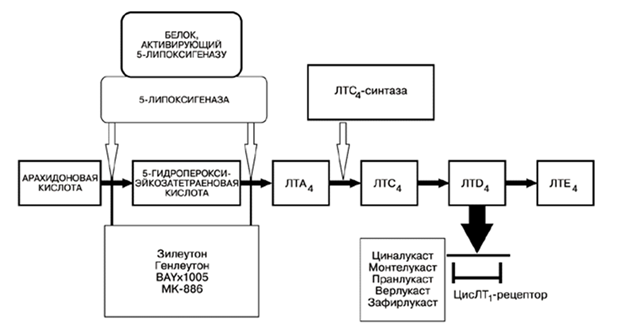
Рис. 1. Биосинтез цистеинил лейкотриенов.
Биологическое действие лейкотриенов опосредовано через рецепторы, которые относятся к группе пуриновых рецепторов, 7-кратно пронизывающих мембрану и связанных с G-белком. По специфическому связыванию с лигандами они делятся на 2 подкласса: связывающиеся с лейкотриеном B4, называемые BLT рецепторами, и цистеинил лейкотриеновые рецепторы – CysLTR. Эндогенными лигандами цистеинил лейкотриеновых рецепторов являются лейкотриены C4, D4 и E4.
Основное биологическое действие LTB4 заключается в стимуляции хемотаксиса, активации макрофагов и синтезе хемокинов и цитокинов. Считается, что он играет важную роль в формировании гнойного воспаления, ревматоидного артрита и других воспалительных заболеваниях. Однако его роль в патогенезе бронхиальной астмы не ясна, так как при использовании антагонистов рецепторов к LTB4 для лечения БА симптоматика не меняется.[5]
Выделяют две разновидности цистеинил лейкотриеновых рецепторов: CysLTR1 и CysLTR2. Эксперименты на мышах с дефицитом CysLTR2 или сверхэкспрессией CysLTR2 в легких показали, что CysLTR2 не способствуют бронхоспазму, а скорее способствуют воспалению, проницаемости сосудов и фиброзу тканей. Цистеиниловые лейкотриены повышают экспрессию таких молекул адгезии, как Р-селектин, который опосредует адгезию лейкоцитов к эндотелию сосудов в процессе острого воспаления. Модификаторы лейкотриенов могут снижать экспрессию цитокинов, блокируя их действия. Обратное явление также верно: цитокины могут модулировать экспрессию лейкотриенов. В целом цистеиниловые лейкотриены вызывают расширение периферических и сужение коронарных сосудов, увеличивают проницаемость бронхов, подавляют пролиферацию лимфоцитов и способствуют их дифференцировке. Ингаляции LTE4 увеличивают число эозинофилов в биоптате дыхательных путей, а ингаляции LTD4 повышают число эозинофилов в мокроте больных с бронхиальной астмой. Также именно этот комплекс ответственен за медленную фазу бронхоспазма при бронхиальной астме. [2,5]
Это объясняет усугубление астматических приступов у больных с непереносимостью нестероидных противовоспалительных препаратов (НПВП). У таких больных в бронхах увеличена экспрессия LTC4-синтазы, что приводит к увеличению продукции цистеиниллейкотриенов. Частичным объяснением этого явления может быть генетический полиморфизм гена LTC4-синтазы. Общий вариант промотора гена создает предрасположенность к аспириновой астме(АА) путем усиления эффекторного механизма бронхоконстрикции. Исследования с аспирином в сочетании с оценкой полиморфизма синтазы LTC 4 и экскреции LTC 4 с мочой указывают на некоторую гетерогенность среди пациентов с AA. Они тормозят образование простагландинов, высвобождая метаболический шунт арахидоновой кислоты в пользу лейкотриенов. Это проявляется в виде покраснений кожных покровов, приступов удушья и кашля, подъема температуры, конъюнктивита и отека Квинке. Степень аллергической реакции на НПВП зависит от антициклооксигеназной активности препарата и его количества. К препаратам с высокой антициклооксигеназной активностью относятся салицилаты (аспирин), полициклические кислоты (индометацин, толметин), ненасыщенные жирные кислоты (диклофенак, ибупрофен, кетопрофен, тиапрофеновая кислота), оксикамы (пироксикам, лорноксикам). [5]
Исходя из выше сказанного для лечения бронхиальной астмы, особенно у пациентов с непереносимостью НПВП, можно применять препараты, действующие на лейкотриеновую систему – антилейкотриены. С теоретической точки зрения, подавить активность лейкотриенов можно двумя путями: первый, это ингибировать их синтез, воздействуя на ферментную систему (в настоящее время удалось ингибировать только фермент 5-липоксигеназу), а второй это препятствовать связыванию лейкотриенов с их рецепторами. На рисунке 1 также показаны основные места действия различных антилейкотриенов. [4]
К первой группе этих препаратов относятся зилеутон (Zileuton) и генлеутон. Они явдяются антагонистами белка, активирующего 5-липоксигеназу. Ко второй антагонисты цистеинил лейкотриеновых рецепторов (CysLTR) – зафирлукаст (Zafirlucast), монтелукаст, циналукаст.
Зилеутон принимают перорально и он быстро всасывается. Жирная пища стимулирует его абсорбцию. При первом прохождении через печень из него образуются глюкурониды. Максимальная концентрация в крови наблюдается через 1,8-2,5 ч. Метаболиты выделяются почками. t
1-2,3 ч. Препарат рекомендован для применения взрослым. [3]
Результаты исследования A.R. Fischer et al. Показали, что прием Зилеутона не только уменьшает воспаление дыхательных путей, но и снижает их реактивность, то есть уменьшается степень и скорость сужения бронхов после контакта с бронхоконстрикторами. [7] Зилеутон помимо лечения бронхиальной астмы может использоваться и при ревматоидном артрите и язвенном колите. При применении Зилеутона возможны побочные эффекты: лихорадка, миалгия, утомляемость, головокружения, головная боль, диспепсия, повышение уровня трансаминаз и другие. [3]
Зафирлукаст избирательно и длительно блокирует рецепторы для LTE4 и LTD4 и обладает выраженным противовоспалительным действием. При бронхиальной астме это проявляется в виде уменьшения проницаемости сосудов, снижения отека слизистой, секреции густой мокроты, расширении бронхиол. Также было замечено, что зафирлукаст блокирует микросомальные ферменты, что сказывается на метаболизме и фармакокинетике других лекарств. Клинический эффект препарата развивается примерно через одни сутки, поэтому он используется для профилактики и длительного лечения бронхиальной астмы. Для купирования острых астматических приступов данный препарат не пригоден. Но он может использоваться в совокупности с быстродействующими антиастматическими лекарственными средствами. [6] Применение зафирлукаста может вызвать такие побочные действия, как головная боль, гастрит, фарингит, миалгия, артралгия и другие.
Препарат принимается перорально, хотя эффективен и при ингаляции. Максимальная концентрация определяется через 3 часа. Приимать следует натощак, так как наличие пищевых масс в кишечнике уменьшает всасывание на 40%. Через гематоэнцефалический барьер проникает плохо. Его метаболиты выделяются кишечником и почками, t
10 ч. Рекомендован для применения взрослым и детям старше 5 лет. [3]
Также к блокаторам антилейкотриеновых рецепторов относится Монтелукаст. Он является избирательным антагонистом LTD4, но в отличие от Зафирлукаста не ингибирует микросомальные ферменты, поэтому не влияет на фармакокинетику других препаратов. Известно, что при блокаде CysLTR1 Монтелукастом значительно снижается эозинофильное воспаление, что сопровождается количественным уменьшением медиаторов: нейрокинина А и вещества Р в лаважной, назальной жидкости пациентов с полиппозом носа и астмой, с непереносимостью НПВС или без нее. [8]
Монтелукаст вводится внутрь, всасывается быстро. Его абсорбция от состава пищи не зависит. Метаболиты выделяются в основном кишечником. t
2,7-5,5 ч. Область применения такая же, как и у Зафирлукаста, но препарат рекомендован для применения взрослым и детям старше 6 месяцев. [3]
Зафирлукаст и Монтелукаст, в настоящее время, активно не используются в связи с низкой эффективностью и высокой стоимостью. Однако они имеют и свои преимущества: простой режим лечения, 1-2-кратный прием и появление эффекта в течение 24 часов после приема препарата. Также на фоне приема антилейкотриенов возможно развитие синдрома Черджа-Стросса, однако этот факт требует дальнейшего изучения. И в современной медицинской практике антагонисты лейкотриенов не применяются для куппирования приступов бронхиальной астмы. [8]
Антилейкотриены могут служить альтернативой монотерапии ингаляционными кортикостероидами при лечении легкой персистирующей астмы у взрослых и детей. Но из-за плохого контроля над астмой и, как следствие, возникновения приступов, и последующего назначения кортикостероидов использование лейкотриенов для монотерапии бронхиальной астмы пока остается под вопросом. Однако применение ингибиторов синтеза лейкотриенов может снизить необходимость экстренного применения ингаляционных стероидов или системного лечения стероидами. [6]
Изучение Конкрейновской базы данных показало, что использование антилейкотриенов при астме менее эффективно, чем использование ингаляционных кортикостероидов (ИГКС). Была проведена оценка 14 эксперементов, 12 из которых были проведены у взрослых, одно у взрослых и подростков (≥ 12лет), одно у детей (
10 лет). Продолжительность вмещательства варьировала от 4 до 37 недель. Из антилейкотриеновых препаратов использовали монтелукаст, пранлукаст и зафирлукаст. У пациентов, получавших антилейкотриены больше, чем кортикостероиды, наблюдалось увеличение обострений бронхиальной астмы. Из этого следует вывод, что применение кортикостероидов более эффективно. [7]
В нашей стране антилейкотриены обозначаются как дополнительная терапия в совокупности с ингаляционными кортикостероидами и являются альтернативой длительно действующим β2-агонистам при персистирующей бронхиальной астме. Но по сравнению с β2-агонистами монтелукаст менее эффективен и к тому же более дорогой.
Современная терапия бронхиальной астмы должна отвечать поставленным целям:
1. Достижение и поддержание контроля симптомов БА в течение длительного времени;
2. Минимизация рисков будущих обострений БА.
Именно поэтому был разработан специальный ступенчатый подход к ее лечению. Каждая ступень соответствует определенной выраженности клинических проявлений БА и представляет собой варианты ее терапии. По данной схеме антилейкотриены могут применять на 2, 3 и 4 ступенях.
На 2 ступени антилейкотриены рекомендуются для терапии пациентам с БА в сочетании с аллергическим ринитом, пациетам с вирусиндуцированной БА, с астмой физического усилия. На 3 ступени – у детей младше 5 лет в качестве дополнения к терапии ИГКС; у детей старше 5 лет лечения БА в качестве дополнения к базисной терапии низкими/средними дозами ИГКС. На 4 ступени детям 5-12 лет с неконтролируемым течением БА на фоне терапии 400 мкг беклометазона дипропионата или его эквивалнента в день в комбинации с длительно действующими бэта-агонистами (ДДБА) рекомендуется увеличение дозы ИГКС до максимальной в сочетании с ДДБА или добавление антилейкотриенов. (рис. 2) [1]
Таким образом, несмотря на большое количество исследований в данной области, эффективность применения антилейкотриеновых препаратов до сих пор остается под вопросом. При их назначении необходимо учитывать соотношение польза/вред, стадию течения бронхиальной астмы, индивидуальные реакции организма на препарат. Но одно можно сказать точно, антилейкотриеновые препараты – это достаточно перспективное направление в области лечения бронхиальной астмы, которое при дальнейшем развитии может привести к разработке новых препаратов и снижении побочных эффектов уже существующих.
Рисунок 2. Ступенчатая терапия бронхиальной астмы.
Что такое антагонист лейкотриеновых рецепторов
М.В. Леонова (1), Э.Э. Алимова (1), А.С. Дворников (2)
1) Кафедра клинической фармакологии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва; 2) Кафедра дерматовенерологии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва
Аллергия – это реакция, вызываемая аллергеном и сопровождающаяся инфильтрацией воспалительных клеток в органы-мишени. Аллергическая реакция может быть IgE (иммуноглобулин Е)-опосредованной и IgE-независимой, проявляться ранней и поздней фазами. Ранняя фаза реализуется в течение 15 минут и обусловлена высвобождением гистамина; лейкотриены (LT) как медиаторы воспаления участвуют и в ранней, и в поздней фазах.
Лейкотриены (LTC4, LTD4, LTЕ4) образуются из арахидоновой кислоты в тучных клетках после воздействия аллергена, провоспалительных цитокинов или других рецептор-зависимых стимулов [1]. Высвобождаясь из тучных клеток, они взаимодействуют со специ-фическими цистеиниловыми рецепторами (CysLT1), экспрессированными на клетках иммунной системы (моноцитах, макрофагах, эозинофилах, базофилах, нейтрофилах, Т- и В-лимфоцитах, тучных клетках) и таргетных клетках структурных органов, таких как гладкомышечные клетки дыхательных путей, эпителиальные и эндотелиальные клетки, а также фибробласты, дендритные клетки. Взаимодействие LT с CysLT1-рецепторами тесно связано со многими аспектами иммунопатогенеза бронхиальной астмы (БА), включая хроническое воспаление, бронхоконстрикцию, бронхиальную гиперреактивность, гиперсекрецию слизи и ремоделирование дыхательных путей, а также вазодилатацию, увеличение проницаемости сосудистой стенки и развитие отека, что приводит к развитию ринита, крапивницы. LT являются более мощным провоспалительным медиатором, в 100 раз активнее гистамина. Эозинофилы, базофилы и тучные клетки служат главным источником LT, а также эпидермальные клетки способны к преобразованию LTА4 в LTВ4, LTС4 [2].
Среди препаратов, воздействующих на активность LT, выделяют антилейкотриены – антагонисты лейкотриеновых рецепторов (LT-рецепторов): пранлукаст, зафирлукаст, монтелукаст, а также ингибитор биосинтеза LT: зилеутон. Действие на LT позволяет оказывать специфическое воздействие на аллергическое воспаление, ринит, астму, крапивницу. Механизмы развития противовоспалительных эффектов антагонистов LT-рецепторов перечислены в табл. 1.
Антагонисты LT-рецепторов рекомендованы в качестве альтернативных препаратов в лечении аллергического ринита (АР) в дополнение к антигистаминным препаратам (АГП) в лечении хронической крапивницы в дополнение к ингаляционным глюкокортикоидам (ИГКС) при лечении БА, особенно в педиатрии.
Монтелукаст – один из популярных препаратов группы антагонистов LT-рецепторов. Помимо известной способности монтелукаста блокировать CysLT1-рецепторов и уменьшать аллергические реакции и воспаление препарат имеет дополнительные вторичные механизмы противовоспалительного действия, связанные с ингибированием 5-липооксигеназы [3], значительным уменьшением высвобождения цитокинов Th2-клеток и уменьшением сосудистого эндотелиального фактора роста и TGF-β1 (β1-трансформирующий фактор роста) в легочной ткани, что может уменьшить ремоделирование дистальной паренхимы легкого и развитие фиброза легких [4].
Монтелукаст обладает наилучшей фармакокинетикой среди препаратов данного класса. В отличие от других антагонистов LT-рецепторов монтелукаст имеет высокую биодоступность после приема внутрь (табл. 2). Монтелукаст доступен на фармацевтическом рынке в нескольких пероральных формах, таких как обычные таблетки с немедленным высвобождением, жевательные таблетки, что позволяет применять его детям и пожилым пациентам.
Монтелукаст наиболее предпочтителен среди антилейкотриенов: он лишен клинически значимых лекарственных взаимодействий, применяется однократно в сутки, разрешен к применению у детей. По данным ТОР-анализа наиболее часто назначаемых препаратов в мире монтелукаст вошел в первую десятку в 2015 г.
Антагонисты LT-рецепторов в лечении БА
БА относится к аллергическим заболеваниям, но при этом характеризуется наличием хронического воспаления в дыхательных путях, обусловленного активацией тучных клеток, эозинофилов, базофилов, Т-лимфоцитов и высвобождением гистамина, простагландинов и LT. LT играют важную роль в патогенезе развития всех вариантов и фенотипов БА. Они вызывают сокращение гладких мышц бронхов, выделение слизи, отек и повышение проницаемости сосудов, способствуют эозинофильному воспалению [5]. К факторам, стимулирующим образование и высвобождение LT, относятся различные аллергены, охлаждение и сухость дыхательных путей. Максимальное увеличение продукции LT наблюдается при тяжелом течении БА, при обострении заболевания, индуцированном вирусной инфекцией, аллергической провокацией, табачным дымом, ацетилсалициловой кислотой, при астме физической нагрузки, а также у пациентов с повышенным индексом массы тела.
Противовоспалительные эффекты антагонистов LT-рецепторов при БА опосредуются блокадой CysLT1-рецепторов на тучных и других клетках иммунной системы и таргетных клетках верхних и нижних дыхательных путей. Антагонисты LT-рецепторов уменьшают выраженность спазма гладкой мускулатуры бронхиол и сосудов, отека; подавляют миграцию эозинофилов и макрофагов; уменьшают секрецию слизи и улучшают мукоцилиарный транспорт [6].
Эффективность антагонистов LT-рецепторов в лечении БА изучалась с 1990-х гг. За последние годы были проведены серии мета-анализов, объединивших результаты этих исследований. Показано, что применение антагонистов LT-рецепторов улучшает симптомы БА и проходимость бронхов; добавление антагонистов LT-рецепторов к терапии ИГКС уменьшается риск обострений заболевания на 36–48% [7–9]. Кроме того, применение антагонистов LT-рецепторов пациентами с легкими персистирующими симптомами БА позволят достигать лучшего контроля БА.
Эффективность монтелукаста в лечении БА у взрослых и детей была показана в нескольких исследованиях.
В двух ранних плацебо-контролируемых исследованиях взрослых с БА монтелукаст улучшал показатели ОФВ1 (объем форсированного выдоха за первую секунду), потребность в β2-агонистах, симптомы ночной астмы [10, 11]. В крупном плацебо-контро-лируемом исследовании у 681 взрослого больного БА применение монтелукаста в дозе 10 мг в вечернее время улучшало ОФВ1, пиковую скорость выдоха и симптомы БА [12]. В крупном наблюдательном исследовании в реальной практике у взрослых с неконтролируемой БА добавление монтелукаста приводило к увеличению ОФВ1 и контролю симптомов астмы (утренние и ночные симптомы, дневная активность, одышка), но не уменьшало потребности в приеме β2-агонистов [13].
В сравнительном исследовании у 895 пациентов с хронической БА монтелукаст (10 мг/сут перед сном) по эффективности уступал беклометазону (200 мкг 2 раза в сутки): прирост ОФВ1 составил 7,4 против 13,1% соответственно [14]. Однако в наблюдательном исследовании в реальной практике у 326 пациентов с БА (в возрасте 12–80 лет) монтелукаст показал сопоставимую эффективность с ИГКС в качестве терапии 1-й линии для контроля симптомов БА или потребности в добавлении β2-агонистов длительного действия [15].
В исследовании монтелукаста в дозе 10 мг/сут и флутиказона пропионата 500 мкг/сут у 1019 пациентов с БА и длительным анамнезом курения монтелукаст показал сопоставимый клинический эффект по контролю симптомов БА в течение 6 месяцев лечения (45 и 49% дней без симптомов в группах соответственно), причем монтелукаст был эффективнее флутиказона пропионата при стаже курения более 11 лет [16].
Все антагонисты LT-рецепторов лицензированы для применения при БА у детей, но наиболее изученным в клинических исследованиях препаратом является монтелукаст. Антагонисты LT-рецепторов рекомендованы в качестве альтернативных препаратов ИГКС при нетяжелой БА у детей или при невозможности применения ИГКС детьми, а также для дополнения к терапии ИГКС при недостаточном контроле симптомов БА средней тяжести и тяжелой формы.
В исследовании 336 детей в возрасте 6–14 лет с БА было показано, что применение монтелукаста 5 мг/сут увеличивает ОФВ1 на 8,23% от исходного уровня по сравнению с 3,58% в группе плацебо [17]. Аналогичный эффект монтелукаста был получен при терапии БА у детей в возрасте 2–5 лет без клинически значимых побочных эффектов [18]. Однако в сравнительном исследовании с будесонидом различий в клинической эффективности в течение 52 недель между группами не наблюдалось [19]. В когорте, которая включила 506 детей (2–18 лет) с умеренной персистирующей БА, монтелукаст назначался как стартовый препарат в течение 6 недель. В результате значительно улучшались показатели симптомов и тяжести БА, участвовавшие педиатры и родители были удовлетворены лечением [20].
Кроме того, лечение монтелукастом связано с уменьшением сопротивления дыхательных путей при астме, вызванной физическими упражнениями, особенно у детей [21]. В первом исследовании 27 детей 6–14 лет с БА изучалась эффективность монтелукаста в тесте с физической нагрузкой в качестве конечной точки. Монтелукаст при регулярном приеме приводил к уменьшению степени снижения ОФВ1 в течение 60 минут после физического усилия. В последующих исследованиях изучалась возможность однократного приема одной дозы монтелукаста перед физической нагрузкой детьми (прием перед нагрузкой «по потребности») и был показан защитный эффект препарата в течение 12 часов.
В недавнем мета-анализе 26 рандомизированных контролируемых исследований (РКИ) было показано, что применение монтелукаста для длительного лечения БА значительно уменьшало число обострений БА (относительный риск [ОР]=0,60) как при использовании в качестве препарата 1-й линии (ОР=0,54), так и в дополнение к проводимой терапии (ОР=0,58); но уступал ИГКС и ИГКС в комбинации с β2-агонистами длительного действия в качестве 1-й линии лечения и уступал β2-агонистам длительного действия в качестве дополнительной терапии. Наибольший клинический эффект наблюдался в подгруппе больных с БА и АР (ОР=0,55). При обострениях БА монтелукаст показал тенденцию к уменьшению потребности в госпитализации (ОР=0,72; р=0,09), достоверно улучшал пиковую скорость выдоха и потребность в системных кортикостероидах (ОР=0,43) [22].
Антагонисты LT-рецепторов в лечении АР
АР – это симптоматическое и воспалительное заболевание слизистой оболочки носа, характеризующееся зудом в носу, пароксизмальным повторяющимся чиханием, водянистой ринореей, пониженным обонянием и заложенностью носа.
Патогенез заболевания указывает на то, что АР связан с другими воспалительными заболеваниями слизистых оболочек, такими как БА, риносинусит, хронический средний отит и аллергический конъюнктивит [23]. Медиаторы воспаления, такие как гистамин и LT, играют ключевую роль в развитии симптомов АР; АГП и антагонисты LT-рецепторов являются широко применяемыми средствами для лечения.
Монтелукаст изучался при лечении сезонного АР, поскольку LT играют роль в его патогенезе.
В систематическом обзоре 8 РКИ (n=3950) с применением монтелукаста для лечения АР в качестве первичной конечной точки оценивалась шкала тяжести дневных симптомов, полученных при индивидуальной самооценке заложенности носа, ринореи, носового зуда и чихания [24]. Во всех исследованиях монтелукаст показал достоверное улучшение симптомов ринита по сравнению с плацебо. В качестве монотерапии монтелукаст проявлял эффективность, сопоставимую с лоратадином, но меньшую, чем таковую интраназального кортикостероида флутиказона пропионата. Использование монтелукаста в сочетании с АГП, такими как лоратадин или цетиризин, приводило к большей эффективности, чем при использовании этих препаратов в монотерапии, а в некоторых исследованиях результаты были сравнимыми с интраназальными кортикостероидами [25, 26].
Проведен мета-анализ 20 РКИ (n=10270) по оценке эффективности применения монтелукаста для лечения АР [27]. По сравнению с плацебо монтелукаст приводил к достоверному уменьшению выраженности симптомов на 3,4% по шкале дневных назальных симптомов, в т.ч. в подгруппе с хроническим ринитом – на 4,6% и при сочетании с БА – на 4,4%; по шкале оценки качества жизни RQLQ (Rhinoconjunctivitis Quality-of-Life Questionnaire) монтелукаст превосходил плацебо на 0,2 балла. В сравнительных исследованиях АГП на 3% превосходили эффективность монтелукаста по тяжести дневных назальных симптомов, но не отличались по динамике шкалы качества жизни RQLQ. В сравнительных исследованиях назальные кортикостериоды по эффективности превосходили монтелукаст на 8,4% по шкале дневных назальных симптомов; но в подгруппе пациентов с сочетанием АР и БА достоверных различий между назальными кортикостероидами и монтелукастом не было. В исследованиях с использованием комбинации монтелукаста с АГП отмечалась наибольшая динамика на 11,8% по шкале дневных назальных симптомов и на 0,4 балла – по шкале качества жизни RQLQ по сравнению с плацебо; различий в эффективности назальных кортикостероидов не было (разница – 2% по шкале дневных назальных симптомов).
В другом мета-анализе 11 РКИ (n=14 809) при сравнении эффективности применения монтелукаста и лоратадина в лечении АР по шкалам назальных симптомов и качества жизни были получены сопоставимые результаты динамики дневных назальных симптомов и показателей шкалы RQLQ и лучшая эффективность по шкале ночных назальных симптомов в группе монтелукаста [28].
Особое практическое значение имеет применение антагонистов LT-рецепторов в терапии сочетанной БА и АР. Все чаще признается, что эти два состояния взаимосвязаны общим патофизиологическим механизмом и зачастую описываются как «одно связанное заболевание дыхательных путей»: 40% пациентов с АР имеют БА, у 80% больных БА имеется АР [30].
В двух крупных наблюдательных когортных исследованиях оценивалась эффективность применения монтелукаста в качестве дополнительной терапии при лечении БА и симптомов АР у пациентов, получавших ИГКС и β2-агонисты длительного действия. Были включены 5769 (возраст ≥4 лет) и 5855 пациентов соответственно. Оценивали симптомы астмы и АР. Добавление монтелукаста приводило к значительному улучшению всех симптомов АР (чихание, зуд, ринорея, заложенность носа, покраснение глаз) в дополнение к контролю симптомов астмы. Было показано, что добавление монтелукаста позволяет улучшать течение БА и ринита у пациентов, неадекватно контролируемых на терапии ИГКС и β2-агонистами длительного действия [31, 32].
Кроме того, применение монтелукаста пациентами с хроническим АР на фоне полипоза также улучшает симптомы ринита, в т.ч. при добавлении к интраназальным кортикостероидам [33].
Антагонисты LT-рецепторов в лечении аллергических заболеваний кожи
Крапивница относится к числу аллергических заболеваний кожи и характеризуется появлением локального отека, эритемы, волдырей и кожного зуда; длительность симптомов более 6 недель относится к хронической крапивнице. Патофизиологической основой крапивницы является локальная вазодилатация с повышенной проницаемостью капилляров и малых венул, за которыми следует транссудация плазменных составляющих в папиллярную и верхнюю ретикулярную дерму. Многие медиаторы воспаления вовлечены в патогенез хронической крапивницы, такие как гистамин, LT, простагландины, цитокины [34]. LT играют важную роль в патогенезе развития хронической крапивницы и других кожных аллергических заболеваний, таких как атопический дерматит [35].
АГП являются препаратом 1-й линии для всех пациентов с хронической крапивницей [36]. Однако хроническая крапивница часто может быть рефрактерной к стандартной терапии АГП даже в увеличенных дозах. Для пациентов с тяжелым течением крапивницы, которая не купируется стандартной терапией АГП, применяются антагонисты LT-рецепторов.
Положительные результаты лечения антагонистами LT-рецепторов получены от больных разными формами хронической крапивницы, особенно вызванной нестероидными противовоспалительными средствами [37–39].
В двух исследованиях сравнивалась эффективность применения монтелукаста с АГП (фексофенадин, цетиризин) в лечении хронической идиопатической или аспириновой крапивницы. Результаты показали сопоставимую эффективность монтелукаста с АГП.
Монтелукаст показал эффективность в лечении хронической крапивницы, резистентной к АГП. В исследовании у 25 пациентов добавление к терапии АГП монтелукаста по 10 мг/сут значительно улучшало течение хронической крапивницы у 50% больных [40].
В ряде исследований пациентов с хронической крапивницей применение монтелукаста в комбинации с АГП имело наилучшие результаты по эффективности. Так, в крупном сравнительном исследовании у 160 больных хронической крапивницей изучалась эффективность монотерапии монтелукастом в дозе 10 мг/сут и дезлоратадином в дозе 5 мг/сут, а также их комбинации в течение 6 недель [41]. Эффективность терапии оценивали по общей динамике симптомов заболевания, динамике ночных симптомов и дневной активности. Во всех группах по сравнению с плацебо наблюдалась достоверная динамика по количеству и размеру волдырей, но наилучшая эффективность была достигнута в группе комбинации дезлоратадина и монтелукаста.
В другом исследовании 81 пациенту с хронической крапивницей проводилось сравнение эффективности монотерапии дезлоратадином и комбинация монтелукаста с дезлоратадином [42]. Лечение продолжалось в течение 8 недель; критерием оценки эффективности была динамика симптомов по шкале UAS (Urticarial Activity Score) и визуальной аналоговой шкале. В конце лечения в группе монотерапии дезлоратадином динамика симптомов составила 69%, в группе комбинации с монтелукастом – 88,9%, полное купирование симптомов крапивницы отмечено у 16 и 73% пациентов соответственно.
В сравнительном исследовании у 120 пациентов с хронической крапивницей изучалась эффективность в трех группах комбинаций: гидроскизин с цетиризином, гидроксизин с фамотидином и гидроскизин с монтелукастом по сравнению с плацебо [43]. Клиническая эффективность оценивалась по динамике симптомов по шкале UAS. Через 4 недели терапии из группы плацебо выбыли 43% больных; эффективность в группах активной терапии составила 23,3%, 63,3 и 53,3% соответственно в виде уменьшения баллов по шкале на 25% и более.
В двух исследованиях у 30 и 29 пациентов с хронической крапивницей добавление монтелукаста к лечению способствовало достоверному улучшению симптомов по шкале UAS и качества жизни по сравнению с плацебо [44, 45].
LT участвуют в патогенезе развития атопической экземы, ассоциируемой с активацией тучных клеток и высвобождением провоспалительных медиаторов [46]. В нескольких исследованиях у пациентов с атопической экземой отмечено достоверное улучшение течения заболевания на фоне терапии монтелукастом в дозе 5–10 мг в течение 4–8 недель.
Заключение
LT как провоспалительные медиаторы играют важную роль в патогенезе развития аллергических заболеваний, что обосновывает применение антагонистов LT-рецепторов. Монтелукаст – наиболее часто назначаемый препарат класса антагонистов LT-рецепторов, обладающий оптимальной фармакокинетикой. Монтелукаст имеет большую доказательную базу по эффективности контроля симптомов БА и может применяться в качестве альтернативной терапии ИГКС в лечении нетяжелой БА, особенно у детей, что подтверждается результатами длительных исследований в условиях реальной практики. Особое значение имеет применение монтелукаста пациентами в с сочетанием БА и АР. В лечении хронической крапивницы монтелукаст позволяет купировать симптомы при комбинации с АГП и в случаях резистентности к ним.
Литература
1. Theron A.J., Steel H.C., Tintinger G.R., Gravett C.M., Anderson R., Feldman C. Cysteinyl leukotriene receptor-1 antagonists as modulators of innate immune cell function. J. Imm. Res. 2014;Article ID 608930:16.
2. Iversen L., Kristensen P., Gron B., Ziboh V.A., Kragballe K. Human epidermis transforms exogenous leukotriene A4 into peptide leukotrienes: possible role in transcellular metabolism. Arch. Dermatol. Res.1994;286(5):261–67.
3. Tintinger G.R., Feldman C., Theron A.J., Anderson R. Montelukast: more than a cysteinyl leukotriene receptor antagonist? Sci World J. 2010;10:2403–13.
4. Gobbato N.B., de Souza F.C., Fumagalli S.B., et al. Antileukotriene reverts the early effects of inflammatory response of distal parenchyma in experimental chronic allergic nflammation. Biomed. Res. Int. 2013;2013:523761.
5. Ogawa Y., CalhounW.J. The role of leukotrienes in airway inflammation. J. Allergy. Clin. Immunol. 2006;118(4):789–98; quiz 799–800.
6. Drazen J.M., Israel E., O’Byrne P.M. Treatment of asthma with drugs modifying the leukotriene pathway. N. Engl. J. Med. 1999;340:197–206.
7. Ducharme F.M. Anti-leukotrienes as add-on therapy to inhaled glucocorticoids in patients with asthma: systematic review of current evidence. BMJ. 2002;324;1545–53.
8. Ducharme F., Schwartz Z., Hicks G., Kakuma R. Addition of anti-leukotriene agents to inhaled corticosteroids for chronic asthma. Cochrane Database Syst. Rev. 2004;(2):CD003133.
9. Ducharme F.M., Lasserson T.J., Cates C.J. Addition to inhaled corticosteroids of long-acting beta2-agonists versus anti-leukotrienes for chronic asthma. Cochrane Database Syst. Rev. 2011;5:CD003137.
10. Reiss T.F., Sorkness C.A., Stricker W., Botto A., Busse W.N., Zhang J., Kundu S. Effects of montelukast (MK-0476); a potent cysteinyl leukotriene receptor antagonist, on bronchodilation in asthmatic subjects treated with and without inhaled corticosteroids. Thorax. 1997;52(1):45–8.
11. Noonan M.J., Chervinsky P., Brandon M., Zhang J., Kundu S., McBurney J., Reiss T.F. Montelukast, a potent leukotriene receptor antagonist, causes dose-related improvements in chronic asthma. Montelukast Asthma Study Group. Eur. Respir. J. 1998;11(6):1232–39.
12. Reiss T.F., Chervinsky P., Dockhorn R.J., Shingo S., Seidenberg B., Edwards T.B. Montelukast, a once-daily leukotriene receptor antagonist, in the treatment of chronic asthma: a multicenter, randomized, double-blind trial. Montelukast Clinical Research Study Group. Arch. Intern. Med. 1998;158(11):1213–20.
13. Schlick W., Pohl W., Pfeiffer K.P., Aigner K., Forche G., Kneussl M., Zwick H. Evaluation of 3–5 months’ add on therapy with montelukast in patients with non-controlled asthma in Austria: the STAR open-label, real-world, observational study. Curr. Med. Res. Opin. 2010;26(3):561–70.
14. Malmstrom K., Rodriguez-Gomez G., Guerra J., Villaran C., Piñeiro A., Wei L.X., Seidenberg B.C., Reiss T.F. Oral montelukast, inhaled beclomethasone, and placebo for chronic asthma. A randomized, controlled trial. Montelukast/Beclomethasone Study Group. Ann. Intern. Med. 1999;130(6):487–95.
15. Price D., Musgrave S.D., Shepstone L., et al. Leukotriene antagonists as first-line or add-on asthma-controller therapy. N. Engl. J. Med. 2011;364(18):1695–707.
16. Price D., Popov T.A., Bjermer L., Lu S., Petrovic R., Vandormael K., Mehta A., Strus J.D., Polos P.G., Philip G. Effect of montelukast for treatment of asthma in cigarette smokers. J. Allerg. Clin.Immunol. 2013;131(3):763–71.
17. Knorr B., Matz J., Bernstein J.A., Nguyen H., Seidenberg B.C., Reiss T.F., Becker A. Montelukast for chronic asthma in 6- to 14-year-old children: a randomized, double-blind trial. Pediatric Montelukast Study Group. JAMA. 1998;279(15):1181–86.
18. Knorr B., Franchi L.M., Bisgaard H., Vermeulen J.H., LeSouef P., Santanello N., Michele T.M., Reiss T.F., Nguyen H.H., Bratton D.L. Montelukast, a leukotriene receptor antagonist, for the treatment of persistent asthma in children aged 2 to 5 years. Pediatrics. 2001;108(3):E48.
19. Szefler S.J., Carlsson L.G., Uryniak T., Baker J.W. Budesonide inhalation suspension versus montelukast in children aged 2 to 4 years with mild persistent asthma. J. Allergy Clin. Immunol. Pract. 2013;1(1):58–64.
20. Amirav I. Real-life effectiveness of Singulair (montelukast) in 506 children with mild to moderate asthma. Isr. Med. Assoc. J. IMAJ. 2008;10(4):287–91.
21. Grzelewski T., Stelmach I. Exercise-induced bronchoconstriction in asthmatic children: a comparative systematic review of the available treatment options. Drugs. 2009;69(12):1533–53.
22. Zhang H.P., Jia C.E., Lv Y., Gibson P.G., Wang G. Montelukast for prevention and treatment of asthma exacerbations in adults: systematic review and meta-analysis. Allergy Asthma Proc. 2014;35(4):278–87.
23. Bourdin A, Gras D, Vachier I, Chanez P. Upper airway 1: Allergic rhinitis and asthma: united disease through epithelial cells. Thorax. 2009;64:999–1004.
24. Nayak A., Langdon R.B. Montelukast in the treatment of allergic rhinitis: an evidence-based review. Drugs. 2007;67(6):887–901.
25. Meltzer E.O., Malmstrom K., Lu S., Prenner B.M., Wei L.X., Weinstein S.F., Wolfe J.D., Reiss T.F. Concomitant montelukast and loratadine as treatment for seasonal allergic rhinitis: a randomized, placebo-controlled clinical trial. J. Allergy Clin. Immunol. 2000;105(5):917–22.
26. Wilson A.M., Orr L.C., Sims E.J., Lipworth B.J. Effects of monotherapy with intranasal corticosteroid or combined oral histamine and leukotriene receptor antagonists in seasonal allergic rhinitis. Clin. Exp. Allergy. 2001;31(1):61–8.
27. Grainger J., Drake-Lee A. Montelukast in allergic rhinitis: a systematic review and meta-analysis. Clin. Otolaryngol.2006;31:360–67.
28. Lu Y., Yin M., Cheng L. Meta-analysis of leukotriene receptor antagonist montelukast in the treatment of allergic rhinitis. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2014;49(8):659–67.
29. Xiao J., Wu W-X., Ye Y-Y., et al. A network meta-analysis of randomized controlled trials focusing on different allergic rhinitis medications. Am. J. Therapeut. 2015;0:1–11.
30. Valovirta E. Managing co-morbid asthma with allergic rhinitis: targeting the one-airway with leukotriene receptor antagonists. World Allergy Organization J. 2012;5(3):S210–S211.
31. Korn D., Van den Brande P., Potvin E., Dramaix M., Herbots E., Peché R. Efficacy of add-on montelukast in patients with non-controlled asthma: a Belgian open-label study. Curr. Med. Res. Opin. 2009;25(2):489–97.
32. Virchow J.C., Bachert C. Efficacy and safety ofmontelukast in adults with asthma and allergic rhinitis. Respir. Med. 2006;100(11):1952–59.
33. Nonaka M., Sakanushi A., Kusama K., Ogihara N., Yagi T. One-year evaluation of combined treatment with an intranasal corticosteroid and montelukast for chronic rhinosinusitis associated with asthma. J. Nippon Med. Sch. 2010;77(1):21–8.
34. Altman K., Chang C. Pathogenic intracellular and autoimmune mechanisms in urticaria and angioedema. Clin. Rev. Allergy Immunol. 2013;45(1):47–62.
35. Nettis E., D’Erasmo M., Di Leo E., Calogiuri G., Montinaro V., Ferrannini A., Vacca A. The employment of leukotriene antagonists in cutaneous diseases belonging to allergological field. Mediat. Inflamm. 2010; ID 628171:6.
36. Zuberbier T., Aberer W., Asero R., et al. The EAACI/GA2LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria: the 2013 revision and update. Allergy. 2014;69:868–87.
37. Pacor M.L., Di Lorenzo G., Corrocher R. Efficacy of leukotriene receptor antagonist in chronic urticaria. A doubleblind,placebo-controlled comparison of treatment with montelukast and cetirizine in patients with chronic urticaria with intolerance to food additive and/or acetylsalicylic acid. Clin. Exp. Allergy. 2001;31(10):1607–14.
38. Di Lorenzo G., D’Alcamo A., Rizzo M., Leto-Barone M.S., Bianco C.L., Ditta V., Politi D., Castello F., Pepe I., Di Fede G., Rini G. Leukotriene receptor antagonists in monotherapy or in combination with antihistamines in the treatment of chronic urticaria: a systematic review. J. Asthma and Allergy. 2009;2:9–16.
39. de Silva N.L., Damayanthi H., Rajapakse A.C., Rodrigo C., Rajapakse S. Leukotriene receptor antagonists for chronic urticaria: a systematic review. Allergy, Asthma & Clin. Immunol. 2014;10:24–30.
40. Sanada S., Tanaka T., Kameyoshi Y., Hide M. The effectiveness of montelukast for the treatment of antihistamine-resistant chronic urticaria. Arch. Dermatol. Res. 2005;297(3):134–38.
41. Di Lorenzo G., Pacor M.L., Mansueto P., Esposito Pellitteri M., Lo Bianco C., Ditta V., Martinelli N., Rini G.B. Randomized placebo-controlled trial comparing desloratadine and montelukast in monotherapy and desloratadine plus montelukast in combined therapy for chronic idiopathic urticaria. J. Allergy Clin. Immunol. 2004;114(3):619–25.
42. Nettis E., Colanardi M.C., Soccio A.L., Ferrannini A., Vacca A. Desloratadine in combination with montelukast suppresses the dermographometer challenge test papule, and is effective in the treatment of delayed pressure urticaria: a randomized, double-blind, placebo-controlled study. Brit. J. Dermatol. 2006;155(6):1279–82.
43. Wan K.S. Efficacy of leukotriene receptor antagonist with an anti-H1 receptor antagonist for treatment of chronic idiopathic urticaria. J. Dermatolog. Treat.2009;20(4):194–97.
44. Erbagci Z. The leukotriene receptor antagonist montelukast in the treatment of chronic idiopathic urticaria: a single-blind, placebo-controlled, crossover clinical study. J. Allergy Clin. Immunol. 2002, 110(3):484–88.
45. Agcaoili M.L., Sumpaico M.W., Aleta L.A., et al. Montelukast in the treatment of chronic urticaria: a randomized double blind, placebo controlled study. Ann. Allergy Asthma Immunol. 2011;107(5):Suppl. 1.
46. Nettis E., D’Erasmo M., Di Leo E., et al. The employment of leukotriene antagonists in cutaneous diseases belonging to allergological field. Mediat. Inflamm. 2010;Article ID 628171.