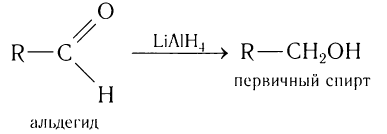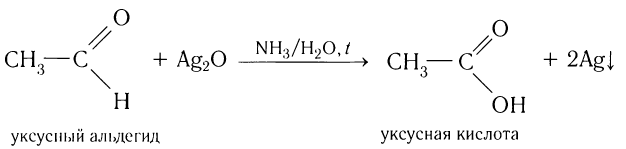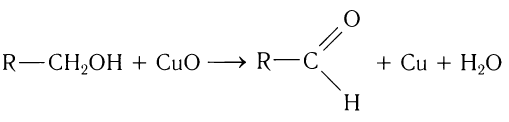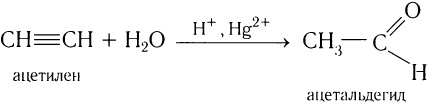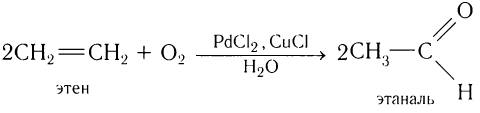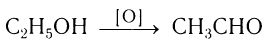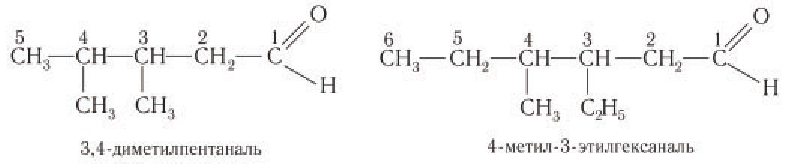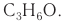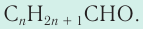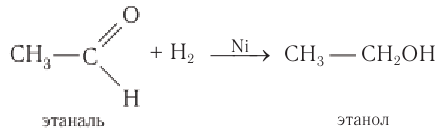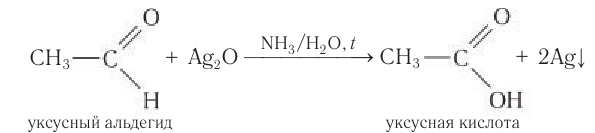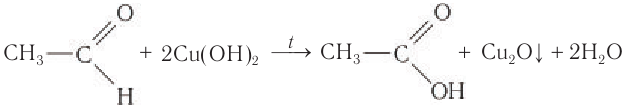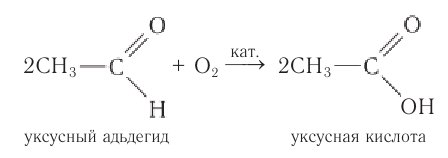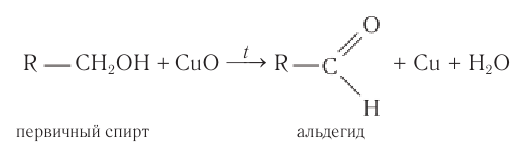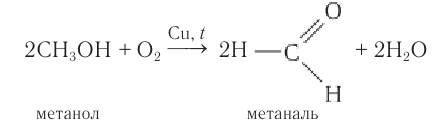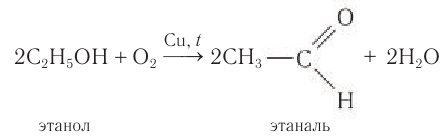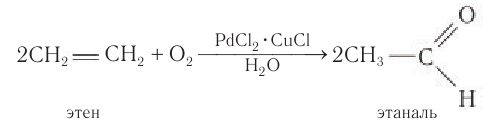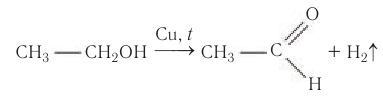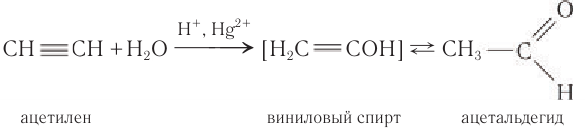что такое альдегиды в химии
Альдегиды
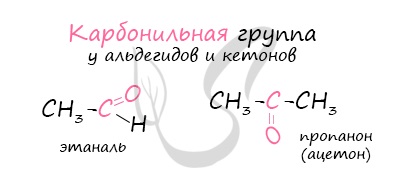
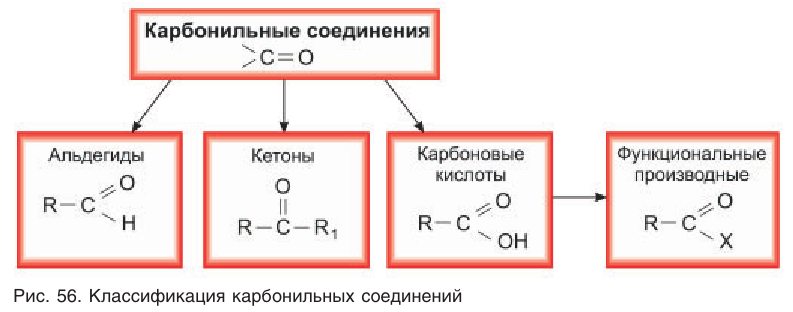
Альдегиды являются представителями карбонильных соединений.
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу С = О.
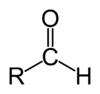
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
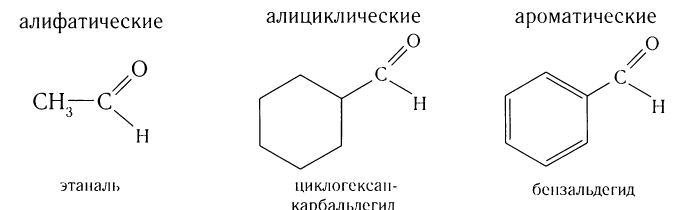
В зависимости от характера углеводородного радикала, связанного с альдегидной группой, альдегиды разделяются на предельные, непредельные и ароматические.
Предельные (насыщенные) альдегиды
Гомологический ряд
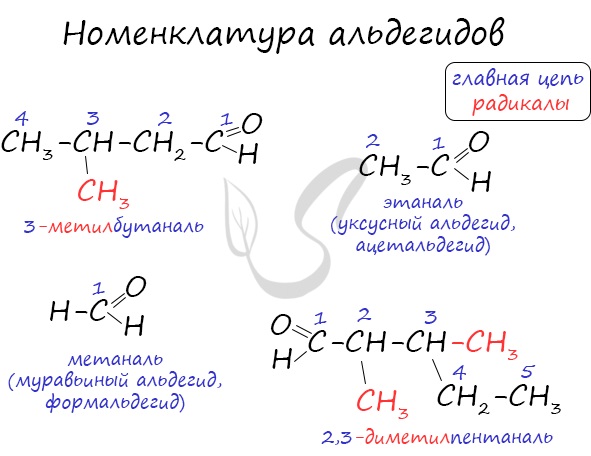
Номенклатура и изомерия
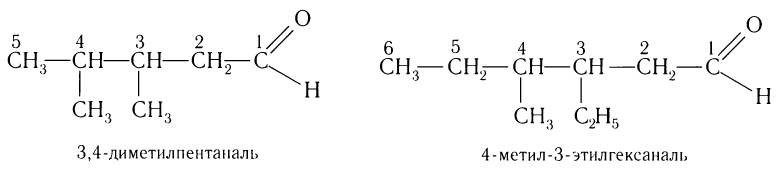
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
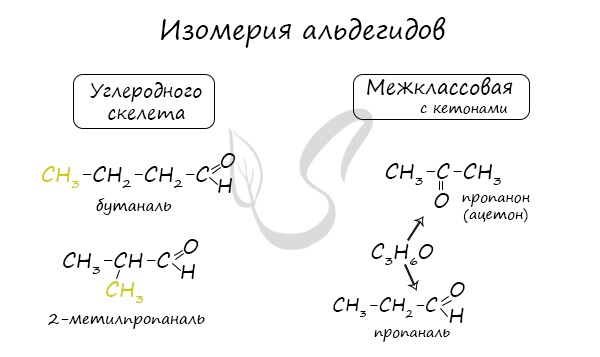
В пределах класса альдегидов возможен только один вид изомерии – изомерия углеродной цепи.
Физические свойства
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8—12 атомов «С», — душистые вещества. Альдегиды с 1—3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства
Альдегиды — один из наиболее реакционноспособных классов органических соединений, что связано с наличием в их молекулах высокополяризованной карбонильной группы >С=О.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
I. Реакции присоединения
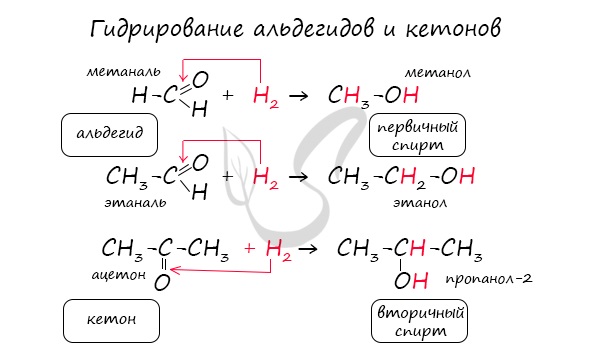
1.Гидрирование (восстановление) с образованием первичных спиртов RCH2ОH:
2.Присоединение спиртов с образованием полуацеталей:
Гидроксильная группа полуацеталей очень реакционноспособна.
В присутствии катализатора – хлороводорода и при избытке спирта образуются ацетали RCH(OR)2:
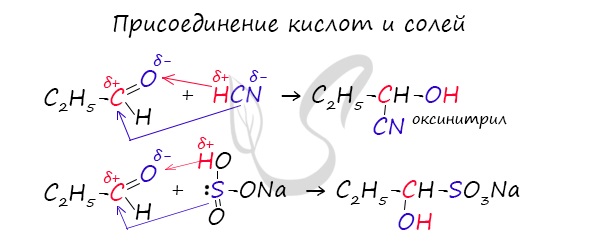
3.Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов:
Этой реакцией часто пользуются для выделения альдегидов из смесей или с целью их очистки.
II. Реакции окисления
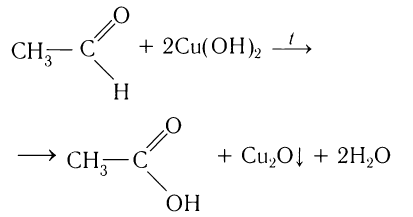
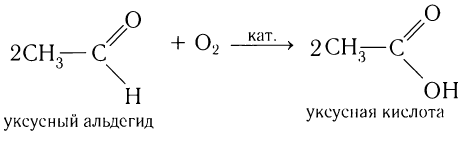
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: О2 воздуха, подкисленный раствор K2Cr2O7 или КМnО4, слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.):
Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
1.Взаимодействие с аммиачным раствором оксида серебра (I) — «реакция серебряного зеркала».
Оксид серебра (I) образуется в результате взаимодействия нитрата серебра(I) с NH4ОH:
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
2.Взаимодействие с гидроксидом меди (II)
Для реакции используют свежеприготовленный Cu(OH)2 образующийся при взаимодействии растворимой соли меди (II) со щелочью:
III. Реакции полимеризации (характерны для низших альдегидов)
1.Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида происходит образование полимера— параформальдегида:
Полимеризация безводного формальдегида в присутствии катализатора — пентакарбонила железа Fe(CO)5 — приводит к образованию высокомолекулярного соединения— полиформальдегида (полиоксиметилен, полиметиленоксид):
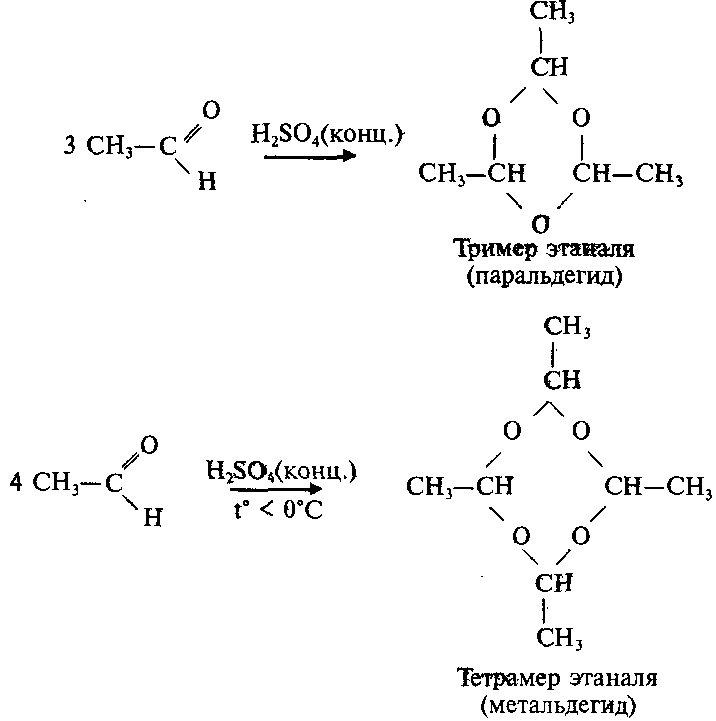
2.Циклическая полимеризация (тримеризация, тетрамеризация)
Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Уксусный альдегид образует циклические триммер и тетрамер:
IV. Реакции поликонденсации
Реакции поликонденсации — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О, НCl, NH3 и др.
В кислой или щелочной среде при нагревании формальдегид (образует с фенолом высокомолекулярные продукты — фенолформальдегидные смолы различного строения:
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта:
При нагревании фенолоспирты конденсируются с образованием фенолформальдегидных полимеров:
Фенолформальдегидные смолы используются для получения пластических масс (фенопластов).
Способы получения
I. Общие методы получения
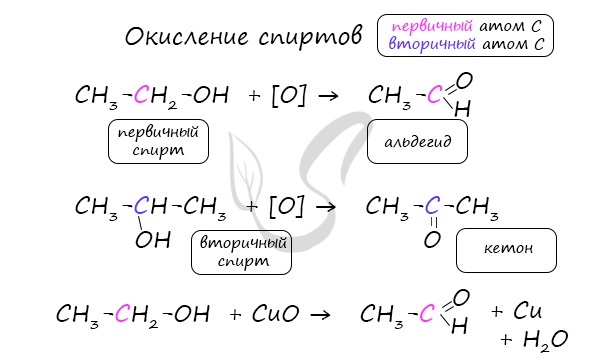
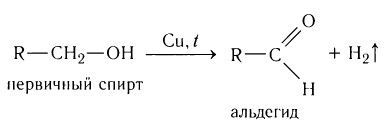
1.Окисление первичных спиртов:
б) под действием окислителей (K2Cr2O7 или KMnO4 в кислой среде)
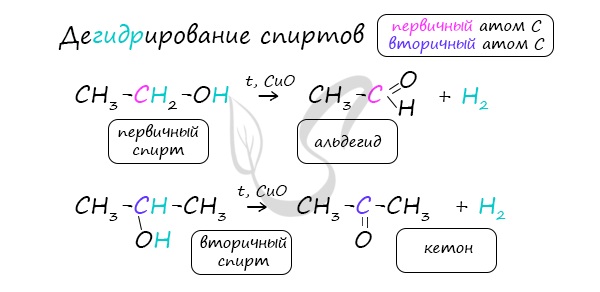
2.Каталитическое дегидрирование первичных спиртов:
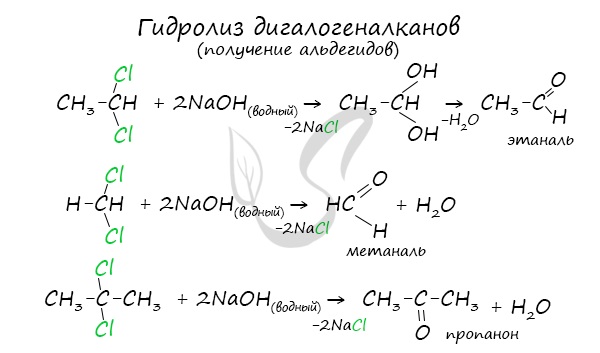
3.Гидролиз дигалогеналканов, содержащих 2 атома галогена у первого атома углеродного атома:
II. Специфические способы получения
Формальдегид можно получить при каталитическом окислении метана:
Ацетальдегид получают реакцией Кучерова:
или при каталитическом окислении этилена:
Данный способ в последнее время широко используется для промышленного получения ацетальдегида. Однако аналогично могут быть получены и другие альдегиды при окислении гомологов этилена, например:
Скачать бесплатно реферат на тему: «Альдегиды» Альдегиды.docx (232 Загрузки)
Скачать бесплатно реферат на тему: «Альдегиды и кетоны» Альдегиды-и-кетоны.docx (223 Загрузки)
Скачать рефераты по другим темам можно здесь
Альдегиды
Альдегиды и кетоны весьма схожи, различие заключается в том, что последние имеют при карбонильной группе два заместителя. Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:
Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов, как выраженных электрофилов. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная:
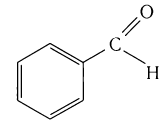
Простейшие альдегиды имеют резкий характерный запах (например, бензальдегид — запах миндаля).
Под действием гидроксиламина превращаются в оксимы:
| Название | Формула | Температура плавления | Температура кипения |
|---|---|---|---|
| Формальдегид | HCHO | −92 °C | −19 °C |
| Ацетальдегид | CH3CHO | −123 °C | 20,8 °C |
| Пропаналь | CH3CH2CHO | −81 °C | 48,8 °C |
| Бутаналь | CH3CH2CH2CHO | −97 °C | 75 °C |
| Акролеин | CH2=CH-CHO | −88 °C | 52,5 °C |
| Кротоновый альдегид | CH3-CH=CH-CHO | −76,5 °C | 104 °C |
| Бензальдегид | C6H5-CHO | −56 °C | 179 °C |
| Салициловый альдегид |  | 1,6 °C | 197 °C |
| Фурфурол | 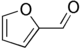 | −36,5 °C | 161,7 °C |
Химические свойства
Высокая реакционноспособность связана с наличием высокополярной связи С=О. Проявляют свойства органических оснований.
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
Присоединение гидросульфита натрия. Используется для выделения альдегидов из растворов.
Присоединение спиртов с образованием полуацеталей (при избытке спирта и хлороводороде образуются ацетали)
2 Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «медного зеркала». Окислителем здесь выступает свежеприготовленный гидроксид меди(II). Образуется кирпично-красный осадок оксида Cu(I)
3 Реакция полимеризации
Формальдегид образует параформальдегид (n=8-100) при длительном стоянии или испарении.
При циклизации образуются триоксан (n = 3) и тетраоксиметилен (n = 4).
4 Реакция поликонденсации При нагревании альдегида с фенолом в кислой или щелочной среде образуются фенолформальдегидные смолы.
Биологическое действие
См. также
Примечания
Ссылки
Полезное
Смотреть что такое «Альдегиды» в других словарях:
Альдегиды — представляют значительную и важную группу органических соединений, члены которой хотя и не часто встречаются в отдельном состоянии в природе, но без сомнения играют чрезвычайно существенную роль в различных физиологических процессах как животного … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АЛЬДЕГИДЫ — летучие жидкости органического состава, образуются из алкоголя, путем окисления его. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. АЛЬДЕГИДЫ летучие жидкости органического состава; имеют приятный запах… … Словарь иностранных слов русского языка
альдегиды — ов, м. aldéhyde m, f. 1845. Лексис. В химии органические соединения, являющиеся продуктом неполного окисления спирта. БАС 2. Профессор химии в Валь де Грасе открыл, что альдегид имеет те же анестезические свойства, как серный эфир и хлороформ. ОЗ … Исторический словарь галлицизмов русского языка
АЛЬДЕГИДЫ — АЛЬДЕГИДЫ, органические соединения, содержащие альдегидную группу CHO, например формальдегид, ванилин. Применяют в производстве полимеров, как душистые вещества и др … Современная энциклопедия
АЛЬДЕГИДЫ — органические соединения, содержащие альдегидную группу CHO. Примеры альдегидов формальдегид, ацетальдегид, бензальдегид, акролеин, ванилин. Получают окислением первичных спиртов и др. методами. Применяют в производстве полимеров, органическом… … Большой Энциклопедический словарь
Альдегиды — АЛЬДЕГИДЫ, органические соединения, содержащие альдегидную группу CHO, например формальдегид, ванилин. Применяют в производстве полимеров, как душистые вещества и др. … Иллюстрированный энциклопедический словарь
АЛЬДЕГИДЫ — класс органических соединений, содержащих в молекуле карбонильную группу >С=0, связанную с органическим радикалом (R) и атомом водорода. Общая формула A. RC(0)H. Благодаря присутствию карбонильной группы А. легко вступают в реакции замещения и… … Большая политехническая энциклопедия
альдегиды — ов; мн. (ед. альдегид, а; м.). [искаж. лат. al(cohol) dehyd(rogenatum) алкоголь, лишённый водорода]. Хим. Органические соединения, продукт дегидрирования первичных спиртов (применяются в производстве полимеров или органическом синтезе и т.п.).… … Энциклопедический словарь
Альдегиды — класс органических соединений, содержащих карбонильную группу связанную c органическим радикалом (R) и с атомом водорода, Свойства А. во многом сходны со свойствами кетонов, также содержащих карбонильную … Большая советская энциклопедия
Альдегиды
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
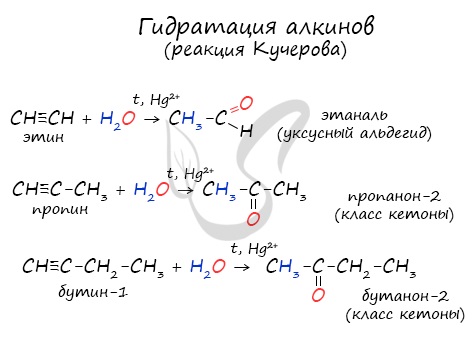
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
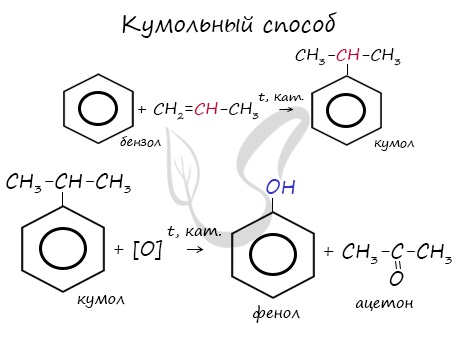
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
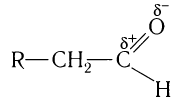
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание:
Альдегиды:
Органические соединения, в молекулах которых имеется карбонильная группа
Карбонильные соединения делятся на две большие группы — альдегиды и кетоны. Со строением и свойствами альдегидов вы познакомитесь в данном параграфе.
Альдегидами называют органические соединения, в которых карбонильная группа
Для альдегидов группа атомов 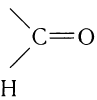
Простейшим представителем альдегидов является метаналь
(формальдегид, или муравьиный альдегид)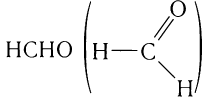
Это единственный альдегид, в молекуле которого карбонильная группа соединена с двумя атомами водорода.
В зависимости от строения углеводородного заместителя различают альдегиды:
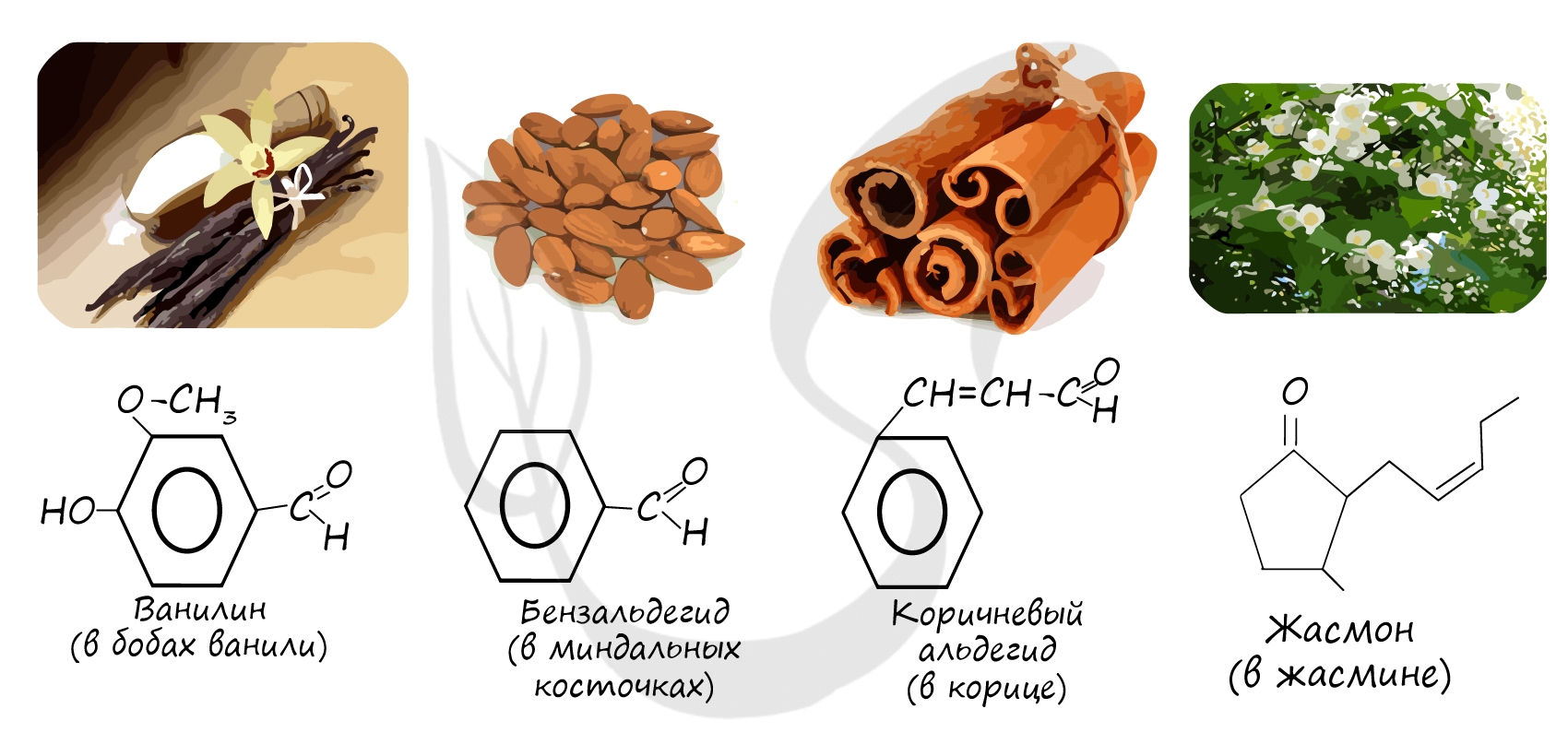
Многие альдегиды и их производные встречаются в живой природе. Например, в миндале обнаружены бензальдегид и его производные:
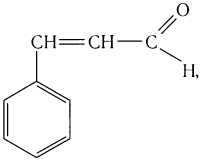
в корице — З-фенилпропеналь (коричный альдегид):
в стручках ванили — пахучее вещество ванилин:
В данном курсе химии вы познакомитесь с алифатическими альдегидами, производными алканов (насыщенных углеводородов).
Общая формула, отражающая химическое строение алифатических насыщенных альдегидов, 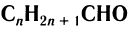
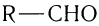
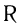
Общая формула насыщенных альдегидов
Общая формула насыщенных альдегидов 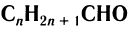
Общая формула, отражающая молекулярный состав насыщенных альдегидов, 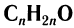
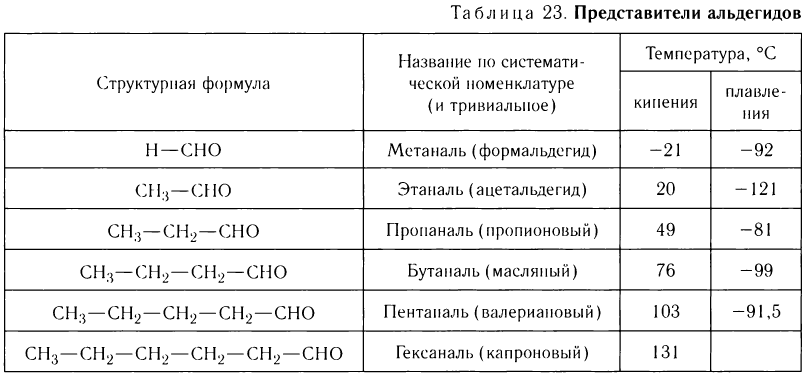
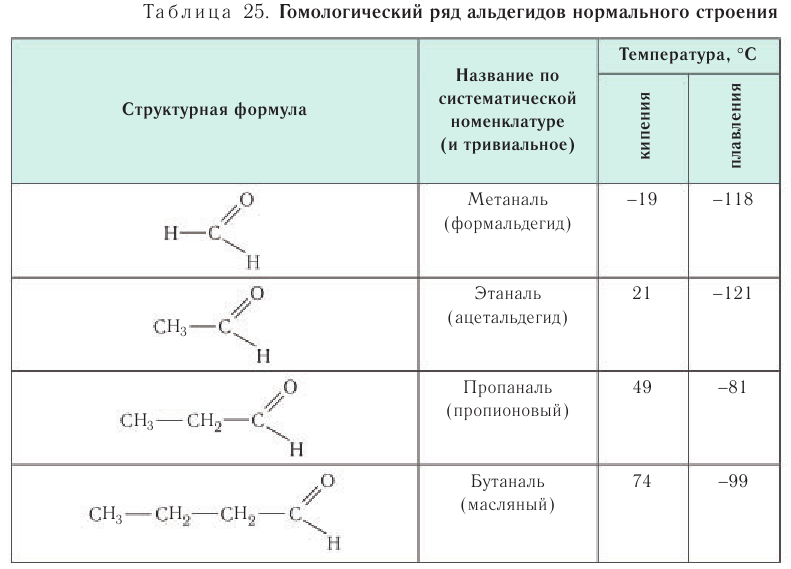
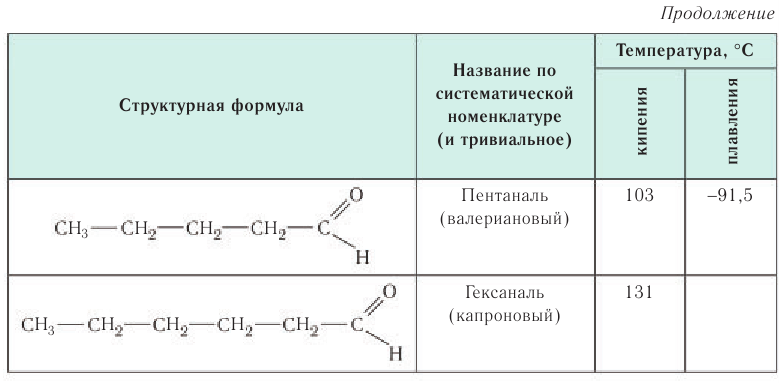
В таблице 23 приведены названия, сокращенные структурные формулы и некоторые физические свойства нескольких представителей насыщенных альдегидов.
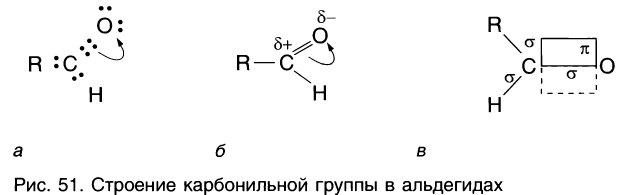
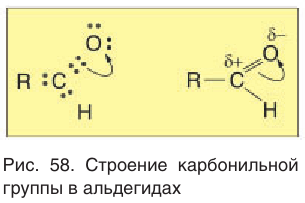
Рассмотрим электронное строение карбонильной группы (рис. 51).
В карбонильной группе связь между атомами углерода и кислорода двойная. Атом углерода образует три 
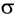
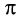
Связь С = О полярна.
Связь С = О короче и ее анергия больше, чем связи С = С.
Полярность связи С = О сказывается на физических и химических свойствах альдегидов, которые являются высоко реакционноспособными веществами.
Номенклатура альдегидов
При названии альдегидов с разветвленной углеродной цепью нумерация главной цепи начинается с атома углерода альдегидной группы.
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, СН3СНО — уксусный альдегид, СН3СН2СНО — пропионовый альдегид и т. д.
Изомерия альдегидов
Изомерия альдегидов обусловлена изомерией углеродной цепи.
Первые три члена гомологического ряда альдегидов — метаналь, этаналь, пропаналь — изомеров не имеют.
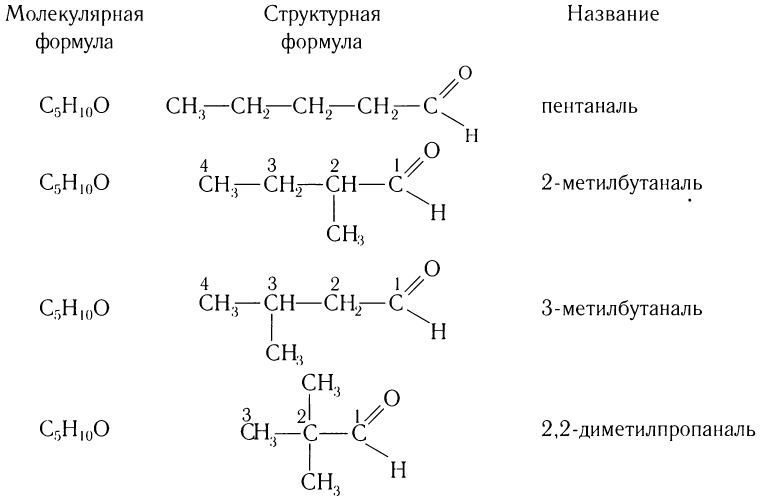
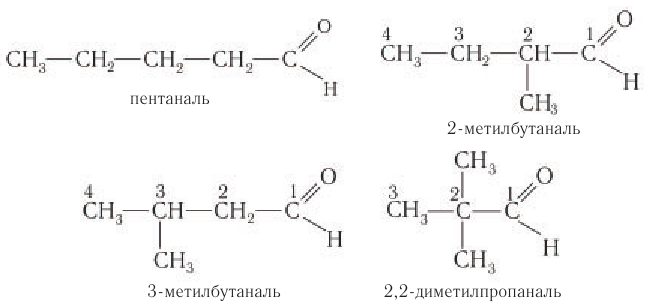
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле сильно возрастает. Например, для альдегидов состава С5Н10О существует четыре изомера альдегида (без учета стереоизомеров).
Составу С6Н12О соответствует семь изомерных альдегидов (без учета пространственных изомеров) и т. д.
Физические свойства альдегидов
В обычных условиях метаналь (формальдегид, или муравьиный альдегид) находится в газообразном состоянии, имеет резкий неприятный запах, ядовит. Остальные альдегиды — жидкости или твердые вещества. Низшие альдегиды имеют резкий неприятный запах, а высшие альдегиды обладают цветочными запахами и широко применяются в парфюмерии.
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например: фенилуксусный альдегид С6Н5СН2СНО имеет запах гиацинтов и потому его называют гиацинтовым.
Ознакомиться с характерными запахами некоторых альдегидов можно в домашних условиях. При выпечке широко используется ванилин, получающийся синтетически. Многим чистящим средствам, использующимся в домашнем хозяйстве, запах лимона придает синтетический альдегид строения 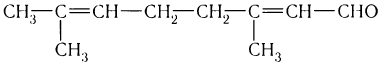
Температуры кипения альдегидов более низкие, чем соответствующих спиртов. Это объясняется тем, что в альдегидах в отличие от спиртов отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды легко растворяются в воде. Например, растворимость уксусного альдегида в воде неограниченная, формальдегида — хорошая (раствор альдегида с массовой долей 40 % называют формалином), растворимость пропионового альдегида:
44 г на 100 см 3 (25 °С).
Органические соединения, в которых карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем, называют альдегидами.
Общая формула насыщенных алифатических альдегидов 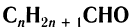
Структурная изомерия альдегидов обусловлена изомерией углеродной цепи.
Химические свойства альдегидов
Рассмотрим важнейшие химические свойства насыщенных алифатических альдегидов.
Реакции присоединения
По месту двойной связи С = О у альдегидов могут проходить реакции присоединения.
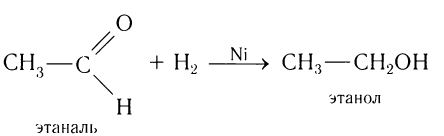
Альдегиды способны присоединять водород по связи С = О на никелевом или платиновом катализаторе с образованием первичных спиртов:
Гидрирование альдегидов относят к реакции восстановления. В промышленности реакцию гидрирования альдегидов используют для получения первичных спиртов.
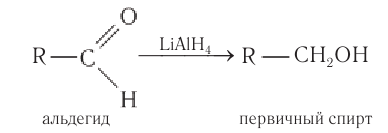
В качестве эффективных восстановителей альдегидов используется алюмогидрид лития. В этих реакция он является источником гидридных анионов:
Реакция окисления
Альдегиды легко окисляются (значительно легче, чем спирты) в соответствующие карбоно-вые кислоты. Их можно окислить даже такими мягкими окислителями, как оксид серебра(І) и гидроксид меди(ІІ).
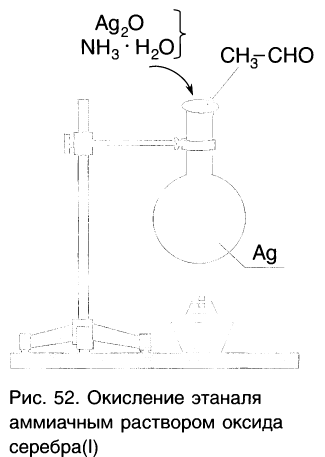
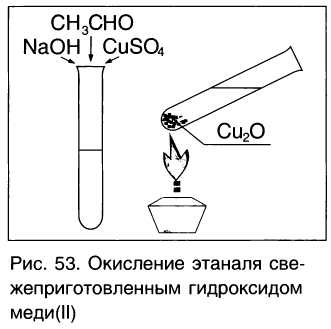
Так, если к аммиачному раствору оксида серебра(І) прилить раствор уксусного альдегида и смесь нагрет то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность колбы, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 52).
Эту реакцию называют реакцией серебряного зеркала. Она является одной из качественных реакций для обнаружения альдегидной группы:
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 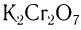
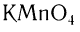
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по месту двойной связи С=О и окисления по месту связи С — Н в альдегидной группе.
Получение альдегидов. Применение альдегидов и их производных
Получение:
Многие альдегиды и их производные используются в различных областях производства органических соединений.
Природными источниками для их промышленного получения являются углеводороды крекинга нефти, галогенпроизводные, спирты.
Рассмотрим лабораторные, а затем промышленные способы получения альдегидов.
Лабораторные способы:
1.Окисление первичных спиртов оксидом металла (СuО) или подкисленным раствором бихромата калия:
2. Гидратация ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути идет с образованием ацетальдегида:
Промышленные способы:
1.Окисление алкенов в присутствии солей палладия:
Этот метод является одним из современных промышленных методов и относится к экологически чистым.
2.Окисление спиртов. Спирты могут быть превращены в карбонильные соединения в результате окислительных процессов. При окислении первичных спиртов образуются альдегиды:
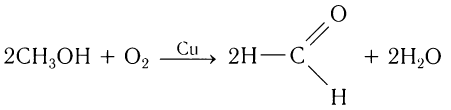
Метаналь (формальдегид) в промышленности получают окислением метанола кислородом воздуха в присутствии катализаторов (медь или серебро):
Получение альдегидов дегидрированием спиртов широко используется в современной промышленности. Само название класса органических соединений «альдегиды» возникло именно благодаря этому способу их получения (лат. alcohol dehydrogenates — спирт дегидрированный).
При пропускании паров спирта над катализатором при высоких температурах происходит дегидрирование первичных спиртов в альдегиды:
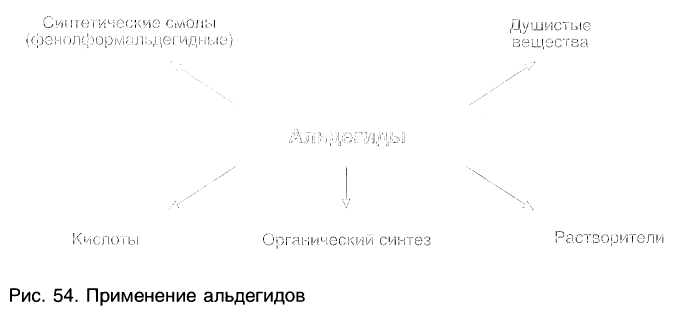
Применение альдегидов и их производных:
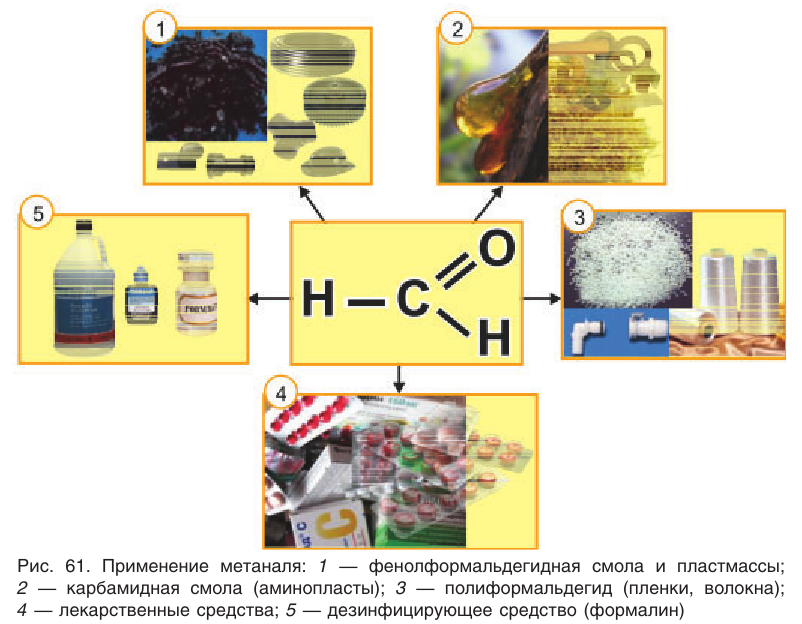
Альдегиды находят применение в различных областях промышленности. Формальдегид используется в качестве исходного сырья для получения фенолформальдегидных пластмасс, синтетического каучука и лекарственных средств.
А. М. Бутлеров н 1860 г. впервые синтезировал из формальдегида и аммиака органическое вещество гексаметилентетрамин, или уротропин, которое используется в медицине.
Ацетальдегид применяют для производства уксусной кислоты и уксусного ангидрида, этилацетата, хлораля.
Бензальдегид С6Н5СНО в природе встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале. Он используется для получения душистых и лекарственных веществ, некоторых красителей.
Пропеналь СН2 = СН — СНО применяют для получения пластмасс, отличающихся боль-шой твердостью, глицерина, акриловой кислоты, лекарственных средств.
На рисунке 54 показаны области использования альдегидов.
Существуют лабораторные и промышленные способы получения альдегидов. К основным промышленным способам относят: окисление алкенов, спиртов, дегидрирование спиртов.
Альдегиды
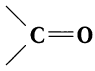
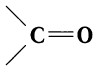
Агьдегиды и карбоновые кислоты относятся к карбонильным соединениям (рис. 56). Карбонильными называют вещества, в состав которых входит карбонильная (или оксо-) группа 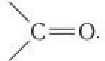
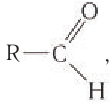
В молекулах альдегидов карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем (R), а в кетонах — с двумя углеводородными заместителями (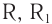
Карбонильные соединения в школьном курсе химии изучаются на примере альдегидов и карбоновых кислот. Рассматриваются также строение и свойства сложных эфиров — функциональных производных карбоновых кислот.
Строение: Альдегидами называют производные углеводородов, в молекулах которых атом водорода замещен на группу
Карбонильную группу 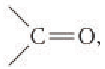
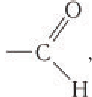
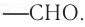
В молекуле простейшего альдегида метаналя 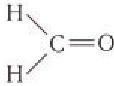
В зависимости от строения углеводородного заместителя, связанного с альдегидной группой, различают насыщенные, ненасыщенные, ароматические альдегиды и др. В данном курсе вы будете изучать строение и свойства альдегидов — производных насыщенных углеводородов (алканов).
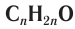
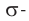
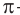
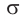

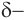
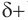

Номенклатура: По правилам номенклатуры ИЮПАК названия насыщенных альдегидов образуются из названий соответствующих алканов с добавлением суффикса -аль, например НСНО — метаналь, 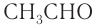
При названии альдегидов с разветвленной углеводородной цепью нумерация атомов углерода главной цени начинается с атома углерода альдегидной группы. Названия заместителей перечисляются в алфавитном порядке с указанием номера атома углерода, с которым они связаны. Например:
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, 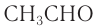
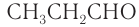
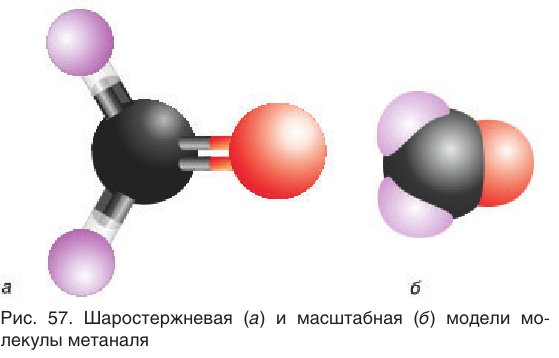
Масштабная модель молекулы уксусного альдегида приведена на рисунке 59.
Изомерия: Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Первые три представителя класса — метаналь, этаналь, пропаналь — изомеров альдегидов не имеют.
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле возрастает. Например, для альдегидов состава 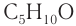
Составу 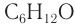
Для альдегидов характерна и межклассовая изомерия. Насыщенные альдегиды изомерны кетонам — карбонильным производным насыщенных углеводородов с тем же числом атомов углерода в молекуле, что и у альдегидов. К кетонам относятся производные углеводородов, молекулы которых содержат карбонильную группу 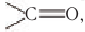
Например, простейший кетон ацетон 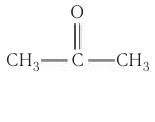
Ацетон — важнейший в промышленном отношении продукт, получаемый, как вам уже известно, кумольным методом как сопутствующий фенолу продукт.
Физические свойства: Метаналь (при и. у.) — бесцветный газ, альдегиды 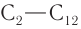
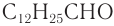
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например, фенилуксусный альдегид 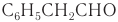
Низшие альдегиды хорошо растворяются в воде. Например, растворимость этаналя в воде неограниченная, метаналя (формальдегида) — хорошая (раствор с массовой долей альдегида 40% называют формалином). С увеличением молярной массы альдегидов их растворимость в воде уменьшается.
Температуры кипения и плавления альдегидов по мере увеличения молярной массы закономерно возрастают (см. табл. 25), но при этом они ниже, чем у соответствующих спиртов. Это явление связано с тем, что в молекулах альдегидов карбонильная группа не настолько полярна, чтобы образовывать водородные связи с другими молекулами этого же соединения, как это происходит у спиртов.
Альдегиды — производные углеводородов, у которых атом водорода замещен на группу —СНО.
Общая формула альдегидов — производных алканов —
Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Химические свойства альдегидов
Химические свойства альдегидов обусловлены наличием в составе молекул карбонильной группы с полярной 


Реакции присоединения: Альдегиды способны присоединять водород по связи 
Например, при пропускании паров этаналя вместе с водородом над нагретым никелевым катализатором происходит присоединение водорода и образуется спирт этанол:
Гидрирование альдегидов относят к реакции восстановления.
В промышленности реакцию гидрирования альдегидов используют для получения насыщенных первичных спиртов.
В качестве эффективных восстановителей альдегидов используется также алюмогидрид лития. В этих реакциях он является источником гидридных анионов:
Реакция окисления: Альдегиды способны не только восстанавливаться, но и окисляться значительно легче, чем спирты, при этом образуются соответствующие карбоновые кислоты. Альдегиды можно окислить даже такими мягкими окислителями, как оксид серебра(I) и гидроксид меди(II). Реакции окисления альдегидов протекают при расщеплении связи 
Так, если к аммиачному раствору оксида серебра(I) прилить раствор уксусного альдегида и смесь нагреть, то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность пробирки, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 60):
Это так называемая реакция серебряного зеркала, которая может служить качественной реакцией на альдегиды.
Если к свежеосажденному гидроксиду меди(II) прилить раствор уксусного альдегида и смесь нагреть, то также происходит окисление альдегида до уксусной кислоты. При этом гидроксид меди(II) светло-голубого цвета восстанавливается в гидроксид меди(I) желтого цвета, который при нагревании превращается в оксид меди(I) красного цвета:
Эта реакция так же, как реакция серебряного зеркала, используется для качественного обнаружения альдегидов.
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 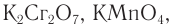
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по двойной связи 

Получение и применение альдегидов
Получение: Альдегиды получают окислением первичных насыщенных одноатомных спиртов. В лаборатории в качестве окислителей используют оксид меди(II) или пероксид водорода, в общем виде этот процесс можно записать так:
В промышленных условиях метаналь получают окислением метанола кислородом воздуха в присутствии медного или серебряного катализатора:
Этаналь получают аналогичным методом:
Уксусный альдегид был выделен в лаборатории немецким химиком Ю.Либихом в 1835 г., а первый представитель класса альдегидов — муравьиный альдегид — был получен в лаборатории также немецким химиком А. Гофманом в 1868 г.
Одним из современных промышленных методов получения низших альдегидов является окисление алкенов кислородом воздуха в присутствии хлоридов палладия и меди. Этаналь в промышленности получают преимущественно этим методом:
В современной промышленности широко используется такой способ получения альдегидов, как каталитическое дегидрирование первичных насыщенных спиртов. Так, например, при пропускании паров этанола при высокой температуре над поверхностью медного катализатора происходит дегидрирование этанола и образование этаналя:
Этот способ получения альдегидов объясняет само название класса — спирт дегидрированный (от лат. alcohol dehydrogenates).
Этаналь можно получить гидратацией ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути:
В реакции сначала к ацетилену идет присоединение воды по одной связи, и образуется ненасыщенный виниловый спирт, у которого гидроксильная группа связана с атомом углерода при двойной связи. Ненасыщенные спирты неустойчивы и легко изомеризуются. Поэтому виниловый спирт превращается в уксусный альдегид. Эта реакция впервые была открыта русским химиком М. Г. Кучеровым. Используемые в реакции в качестве катализатора соли ртути опасны для здоровья человека, поэтому эту реакцию для промышленного получения карбонильных соединений не используют.
Применение: Рассмотрим области применения важных в промышленном отношении альдегидов — метаналя и этаналя. Основное количество получаемого в промышленности метаналя (формальдегида) расходуется на производство фенолфор-мальдегидных смол, из которых получают фенолформальдегидные пластмассы (см. § 28). Полиформальдегид 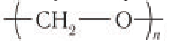
Метаналь используется обычно в виде водного раствора — формалина. Формалин обладает сильными дезинфицирующими свойствами. Его применяют для дезинфекции и дубления кож, хранения анатомических препаратов, в сельском хозяйстве — для протравливания семян.
На рисунке 61 показаны области применения метаналя.
Этаналь (уксусный альдегид) используют в промышленных масштабах для получения уксусной кислоты и ее производных.
В некоторых отраслях производства находят применение альдегиды, производные ненасыщенных и ароматических углеводородов. Например, ненасыщенный альдегид пропеналь 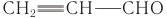
Ароматический альдегид бензальдегид 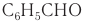
К основным промышленным способам получения альдегидов относят окисление алкенов и спиртов, дегидрирование спиртов.
Метаналь и этаналь используются во многих отраслях производства.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
- рестораны на цветном бульваре в москве с верандами
- что такое служебная информация ограниченного распространения