что такое актин и миозин их функции
Что такое актин и миозин их функции
• Усилия, развиваемые миозинами, и их внутриклеточная локализация регулируются
• Функция миозина регулируется его фосфорилированием и при взаимодействии с белками, связывающимися с актином и миозином
Усилия, развиваемые миозинами, и их внутриклеточная локализация регулируются их фосфорилированием, а также при взаимодействии с белками, связывающимися с актином и миозином. К числу наиболее полно охарактеризованных регуляторов активности миозина относятся белки, связывающиеся с актиновыми филаментами, тропомиозин и тропонин, которые экспрессируются в клетках поперечнополосатых мышц.
В статьях на сайте мы рассмотрим каким образом регулируются функции миозинов с участием регуляторных и хвостовых доменов.
Активность некоторых миозинов регулируется фосфорилированием их легких цепей, которые связаны с регуляторным доменом. Наиболее полно охарактеризованы цитоплазматический миозин II, а также миозин, содержащийся в клетках гладких мышц. В этих миозинах каждая тяжелая цепь связана с одной легкой, которая называется основной легкой цепью, и с другой, которая называется регуляторной легкой цепью. Как показано на рисунке ниже, фосфорилирование легкой регуляторной цепи соответствующей миозиновой киназой легкой цепи (MLCK) приводит к активации миозина, а дефосфорилирование легкой цепи фосфатазой (MLCP), к его ингибированию.
Если легкая регуляторная цепь находится в нефосфорилированной форме, то два моторных домена молекулы миозина взаимодействуют между собой таким образом, что нарушается их способность к гидролизу АТФ и к связыванию актина. Также in vitro было показано, что нефосфорилированная молекула миозина может принимать «свернутую» конформацию, при которой ингибируется образование миозиновых филаментов. Правда, неизвестно, существует ли такая конформация молекулы миозина в клетке. Фосфорилирование легкой регуляторной цепи миозина приводит к нарушению внутримолекулярных взаимодействий, в результате которых проявляется ингибирующий эффект. При этом индуцируется образование миозиновых филаментов и активируется миози-новая АТФаза.
Активность MLCK и MLCP регулируется с участием внутриклеточной системы передачи сигналов, включающей ионы кальция и белки семейства Rho, представляющие собой небольшие G-белки. При этом изменяется общее количество фосфорилированной и нефосфорилированной форм миозина-II. Фосфорилированный миозин II собирается в сократимые структуры, включающие стресс-фибриллы, цитокинетическое кольцо и сократимые фибриллы, обеспечивающие сокращение гладких мышц.
Активность некоторых представителей семейства миозинов регулируется связыванием ионов кальция с легкими цепями, однако значение этого пути регуляции изучено недостаточно. Известно, что ионы кальция вызывают конформационные изменения легких цепей, что влияет на АТФазную активность миозина и его подвижность.
Хвостовые домены некоторых миозинов связываются с карго, например с внутриклеточными мембранами и белками, которые транспортируются по актиновым филаментам с участием миозина. Взаимодействие миозина с транспортируемыми объектами может регулироваться за счет фосфорилировании миозинового хвостового домена или при связывании с другими белками. Как показано на рисунке ниже, хвост миозина V, содержащего две головки и способного транспортировать карго, может регулироваться по обоим механизмам. Фософорилирование хвоста миозина V ослабляет его связывание с траспортируемыми объектами и приводит к диссоциации комплекса.
Дефосфорилирование миозина приводит к связыванию с карго и к его транспорту по актиновым филаментам. Миозин V также взаимодействует с карго посредством ассоциации с семейством Rab малых G-белков. Этот миозин с высоким сродством связывается с ГТФ-связанным Rab, но имеет низкое сродство к комплексу ГДФ-Rab. Когда миозин V не связан с карго, он может принимать свернутую конфигурацию, которая вызывает ингибирование его АТФазной активности.
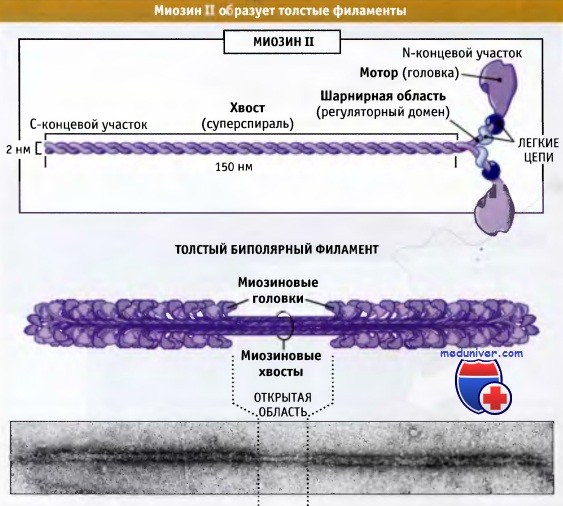
состоящий из двух тяжелых цепей и двух пар различных легких цепей.
Эти комплексы собираются в биполярные толстые филаменты.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое актин и миозин их функции
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
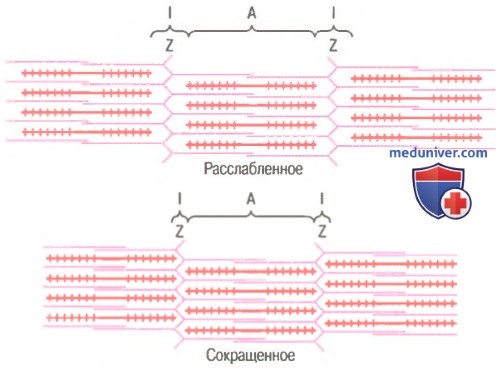
Молекулярные механизмы мышечного сокращения
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
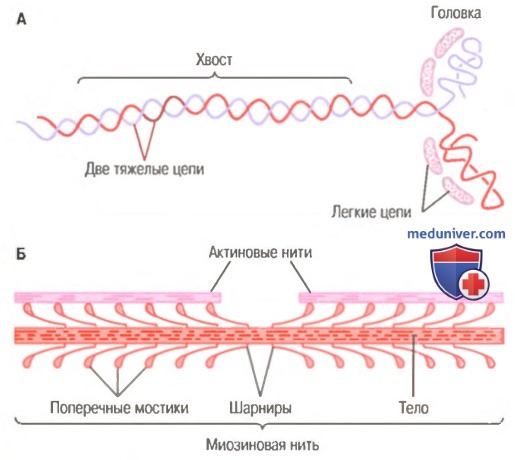
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
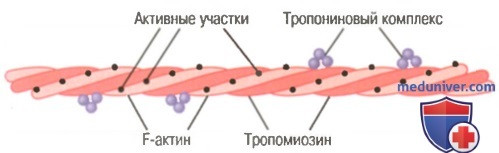
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
5. ФУНКЦИИ БЕЛКОВ
5.3. Энергозависимые взаимодействия белков: актин, миозин и молекулярные моторы
Живые организмы движутся. Клетки движутся. Органеллы и макромолекулы внутри клеток тоже движутся. Основная часть этих движений возможна благодаря активности удивительного класса белков — молекулярных моторов. С помощью химической энергии, источником которой обычно служит АТР, крупные агрегаты моторных белков претерпевают циклические конформационные изменения; эти изменения складываются в унифицированные, направленные воздействия — от крошечных, разводящих хромосомы в делящейся клетке, до невероятной силы, которую развивает в прыжке камышовый кот весом до двадцати килограммов.
Взаимодействия между моторными белками, как вы уже можете предсказать, являются результатом ионных, гидрофобных, ван-дер-ваальсовых взаимодействий и водородных связей в центрах связывания на молекулах белков. Однако в моторных белках эти взаимодействия достигают невероятно высокого уровня пространственной и временной организации.
Действие моторных белков лежит в основе сокращения мышц, перемещения органелл вдоль микротрубочек, вращения жгутиков бактерий и движения некоторых белков вдоль нити ДНК. Белки кинезины и динеины движутся вдоль микротрубочек в клетке и тянут за собой органеллы или перестраивают хромосомы в процессе деления клетки. Взаимодействие динеина с микротрубочками вызывает движение ресничек и жгутиков эукариотических клеток. Движение жгутиков бактерий связано с активностью сложного вращательного мотора в основании жгутика (рис. 19-39). На различных этапах метаболизма ДНК-хеликазы, полимеразы и другие белки должны перемещаться вдоль молекулы ДНК (гл. 25). В данной главе на примере хорошо известных сократительных белков скелетных мышц позвоночных мы рассмотрим, каким образом белки превращают химическую энергию в движение.
Миозин и актин — основные белки мышц
Движущей силой мышечных сокращений является взаимодействие двух белков — миозина и актина. Эти белки организованы в виде нитей, скольжение которых друг относительно друга приводит к сокращению мышц. Вместе актин и миозин составляют более 80% белковой массы мышц.
Миозин (Мr ≈ 540 000) состоит из шести полипептидных цепей — двух тяжелых (Мr ≈ 220 000) и четырех легких (Mr ≈ 20 000). Тяжелые цепи составляют основу структуры миозина. С-концы тяжелых цепей организованы в виде протяженных α-спиралей и переплетаются между собой, образуя левую суперскрученную спираль, напоминающую спираль α-кератина (рис. 5-27, а). На N-конце каждая тяжелая цепь содержит большой глобулярный домен с участком, на котором происходит гидролиз ATP. С глобулярными доменами связаны легкие цепи. При быстрой обработке протеазой трипсином длинный «хвост» молекулы миозина расщепляется, в результате чего образуются два фрагмента, называемые тяжелым и легким меромиозином (рис. 5-27, б). Содержащий глобулярную часть субфрагмент S1, или просто «головка» миозина, отделяется от тяжелого меромиозина при обработке папаином. «Головка» миозина представляет собой моторный участок, с помощью которого осуществляется сокращение мышц. Фрагмент S1 можно кристаллизовать, его структура определена Эйвеном Рэйментом и Хейзел Холден (рис. 5-27, в).
Рис. 5-27. Миозин, а) Миозин имеет две тяжелые цепи (изображены разными оттенками розового цвета), С-концы которых образуют протяженные суперскрученные «хвосты», а N-концы содержат глобулярные домены («головки»). С каждой «головкой» миозина связаны две легкие цепи (показаны синим цветом), б) Расщепление трипсином и папаином приводит к разделению «головки» (S1-фрагмента) и «хвоста» молекулы, е) Ленточная модель S1-фрагмента миозина. Тяжелая цепь изображена серым цветом, две легкие цепи — разными оттенками синего (координаты модели предоставлены Эйвеном Рэйментом).
В клетках мышц молекулы миозина агрегируют, образуя толстые нити, или филаменты (рис. 5-28, а). Эти палочковидные структуры служат стержнем сократительной единицы. В толстых нитях сотни молекул миозина организованы таким образом, что их «хвосты» образуют длинную биполярную структуру. Глобулярные домены выступают с каждой стороны нити в регулярном порядке.
Рис. 5-28. Основные элементы мышцы, а) Молекулы миозина агрегируют с образованием биполярных структур, называемых толстыми нитями, б) F-актин представляет собой нить мономерных звеньев G-актина; две нити F-актина навиваются друг на друга, образуя правозакрученную спираль, в) Пространственная модель нити актина (изображена с помощью разных оттенков красного цвета), одно из мономерных звеньев которой связано с «головкой» миозина (синий и серый цвет) (координаты предоставлены Эйвеном Рэйментом).
Вторым важным белком мышц является актин, которым богаты практически все эукариотические клетки. В мышцах молекулы мономерного актина — G-актина (глобулярный актин; Мr = 42 000) связаны в длинные полимерные цени F-актина (фибриллярный актин). Тонкие нити (филаменты) (рис. 5-28, в) образованы F-актином при участии белков тропонина и тропомиозииа. Формирование тонких нитей происходит по мере последовательного присоединения мономерных молекул актина к одному концу. Кроме того, каждая молекула актина связывает молекулу АТР и гидролизует ее до ADP, так что каждый мономер актина в составе нити находится в комплексе с ADP. Таким образом, гидролиз АТР под действием актина происходит только при сборке нитей; АТР не передаст энергию непосредственно в момент сокращения мышцы. Каждый мономер актина в составе тонкой нити может специфически и прочно связываться с одной головкой молекулы миозина (рис. 5-28, в).
Упорядоченные структуры тонких и толстых нитей образуются при участии других белков
Скелетные мышцы состоят из параллельных пучков мышечных волокон. Каждое волокно представляет собой одну очень большую многоядерную клетку с диаметром от 20 до 100 мкм. Эти клетки образуются в результате слияния многих клеток и часто распространяются на длину всей мышцы. Волокно состоит примерно из 1000 миофибрилл диаметром 2 мкм, каждая из которых содержит огромное количество регулярным образом упакованных тонких и толстых нитей в комплексе с другими белками (рис. 5-29). Каждую миофибриллу окружает система плоских мембранных везикул — саркоплазматический ретикулум. Под электронным микроскопом в мышечном волокне можно различить чередующиеся области высокой и низкой электронной плотности, называемые полосами А и I (рис. 5-29, б, в). Эти полосы возникают в результате специфической укладки тонких и толстых нитей, при которой они частично перекрываются. Полоса I представляет собой область пучка, который в поперечном сечении состоит только из тонких нитей. Более темная полоса А соответствует участку сосредоточения толстых нитей, а также включает в себя места перекрывания параллельно идущих тонких и толстых нитей. Полоса I в середине разделена Z-диском — тонкой структурой, расположенной перпендикулярно к оси тонкой нити и служащей в качестве якоря, к которому прикрепляются тонкие нити. Полоса А в свою очередь также разделена посередине линией М, или М-диском, — областью высокой электронной плотности в центре толстых нитей. Целиком вся сократительная единица, состоящая из пучков толстых нитей, перемежающихся на обоих концах с пучками тонких нитей, называется саркомером. Перемежающееся расположение пучков позволяет тонким и толстым нитям скользить друг относительно друга (механизм см. ниже), в результате чего происходит постепенное сокращение каждого саркомера (рис. 5-30).
Рис 5-29. Структура скелетных мышц. а) Мышечное волокно состоит из одной вытянутой многоядерной клетки, образующейся в результате слияния многих клеток-предшественников. Внутри волокна множество миофибрилл (на данном рисунке для простоты их изображено только шесть) окружены мембраной саркоплазматического ретикулума. Под электронным микроскопом видны полосы, образованные тонкими и толстыми нитями миофибрилл. При сокращении мышцы полоса I сужается, и соседние Z-диски сближаются друг с другом; б) расслабленная мышца; в) мышца в сокращенном состоянии.
Рис. 5-30. Сокращение мышцы. Толстые филаменты (нити) представляют собой биполярные структуры, образованные в результате ассоциации большого числа молекул миозина. а) Мышечное сокращение происходит в результате скольжения тонких и толстых нитей друг относительно друга, так что Z-диски соседних полос I сближаются. б) Тонкие и толстые нити перемежаются, так что каждая толстая нить окружена шестью тонкими.
Тонкие нити актина одним концом прикреплены к Z-диску. В образовании этого контакта участвуют также белки α-актинин, десмин и виментин. Тонкие нити, кроме того, содержат гигантский белок небулин (состоит примерно из 7000 аминокислотных остатков), который, как полагают, организован в виде α-спирали, перекрывающей длину всей нити. Аналогичным образом М-линия организует толстые филаменты. В этом участвуют такие белки, как парамиозин, С-белок и М-белок. Еще один класс белков — титины —наиболее крупные из известных на сегодняшний день белков, состоящих из единственной полипептидной цепи (титин сердечной мышцы человека состоит из 26 926 аминокислотных остатков). Титин связывает толстые филаменты с Z-диском, обеспечивая дополнительный уровень организации всей структуры. Считается, что небулин и титин служат своего рода «молекулярной линейкой», регулирующей длину и толщину соответственно тонких и толстых филаментов. Титин простирается от Z-диcкa до М-линии, регулируя длину самого саркомера и предотвращая перерастяжение мышцы. Длина саркомера в разных тканях различается, что, в частности, связано с наличием в организме позвоночных нескольких вариантов титина.
Толстые нити миозина скользят по тонким нитям актина
Взаимодействие между актином и миозином, как и всех белков с лигандами, основано на действии слабых сил. Если с миозином не связана молекула АТР, то головка миозина связывается с актином (рис. 5-31). Если миозин связывает молекулу АТР и гидролизует ее до ADP и фосфата, происходит циклическая серия конформационных изменений, при которых миозин высвобождает одну субъединицу F-актина и связывает следующую за ней.
Рис. 5-31. Молекулярный механизм мышечного сокращения. Конформационные изменения в «головке» миозина, сопряженные с циклом гидролиза АТР, приводят к диссоциации миозина из комплекса с одной субъединицей актина и его связыванию с другой, расположенной дальше вдоль тонкой нити. Так происходит скольжение толстых нитей вдоль тонких (см. рис. 5-30).
Этот цикл состоит из четырех основных стадий (рис. 5-31). На стадии 1 молекула АТР связывается с миозином, актомиозиновый комплекс распадается, и актин высвобождается. На стадии 2 молекула АТР гидролизуется, вызывая конформационные изменения в белке и его переход в состояние с более высоким уровнем энергии, в результате чего «головка» миозина поворачивается и меняет свою ориентацию относительно нити актина. Затем между «головкой» миозина и следующим мономерным звеном актина, расположенным ближе к Z-диску, возникает слабая связь. На стадии 3 от миозина отсоединяется фосфат, образовавшийся в процессе гидролиза АТР, что сопряжено с очередным конфирмационным изменением в молекуле миозина, приводящим к более прочному взаимодействию в актомиозиновом комплексе. Далее на стадии 4 «головка» миозина приходит в исходное состояние, так что в результате «хвост» миозина смещается относительно нити актина в сторону Z-диска. В завершение цикла молекула ADPвысвобождается. В результате каждого такого цикла совершается работа, эквивалентная 3-4 nН, и толстая нить смещается относительно тонкой нити на 5-10 нм.
На толстой нити находится множество «головок» миозина, и в каждый конкретный момент лишь немногие из них (вероятно, 1-3%) связаны с тонкими нитями. Это не позволяет толстой нити проскальзывать назад в тот момент, когда отдельная «головка» миозина высвобождает субъединицу актина, с которой была связана. Таким образом толстые нити активно сдвигаются относительно тонких нитей. Этот процесс, скоординированный во всех саркомерах мышечного волокна, приводит к сокращению мышцы.
Рис. 5-32. Регуляция мышечного сокращения тропомиозином и тропонином. Тропомиозин и тропонин связаны с F-актином в тонких мышечных волокнах. При расслаблении мышцы оба белка располагаются вокруг актинового волокна, блокируя участки связывания миозина. Тропомиозин представляет собой α-спиральный белок, состоящий из двух пептидов, образующих двойную спираль (тот же структурный мотив, что и в α-кератине; рис. 4-10). Он образует полимеры типа «голова-хвост», которые закручиваются вокруг двух цепей актина. Тропонин присоединяется к комплексу актин/тропомиозин через регулярные интервалы 38,5 нм. Тропонин состоит из трех различных субъединиц: I, С и Т. Тропонин I предотвращает связывание головки миозина с актином; тропонин С содержит центр связывания ионов кальция, а тропонин Т связывает весь тропониновый комплекс с тропомиозином. Когда мышца получает сигнал начать сокращение, из саркоплазматического ретикулума высвобождаются ионы кальция (рис. 5-29, а) и связываются с тропонином С. Это приводит к конформационным изменениям в тропонине С, который меняет положение тропонина I и тропомиозина таким образом, что ингибирование тропонином I снимается, и мышечное сокращение становится возможным.
При работе скелетных мышц белки выполняют две свои обычные функции — связывание и катализ. Взаимодействие актина с миозином и иммуноглобулинов с антигенами — это частные случаи взаимодействия белка с лигандом. Эти процессы обратимы, и после их завершения участники процессов остаются в неизменном виде. Однако связавшийся с миозином АТР подвергается гидролизу до ADP и неорганического фосфата. Таким образом, миозин — это не просто белок, связывающий актин, но еще и фермент (АТРаза). Каталитическая активность ферментов является предметом обсуждения в следующей главе.
Краткое содержание раздела 5.3 Энергозависимые взаимодействия белков: актин, миозин и молекулярные моторы
■ В моторных белках взаимодействие белка с лигандом достигает особенно высокой степени пространственной и временной организации. Мышечное сокращение является результатом тонкого взаимодействия между миозином и актином, сопряженного с гидролизом АТР под действием миозина.
■ Миозин состоит из двух тяжелых и четырех легких цепей, образующих длинный спиральный домен («хвост») и глобулярный домен («головку»). Молекулы миозина организованы в виде толстых нитей, способных скользить вдоль тонких нитей, основой которых является актин. Гидролиз АТР под действием миозина приводит к серии конформационных изменений в «головке» миозина, в результате чего миозин диссоциирует из комплекса с одной субъединицей актина и образует комплекс с другой, расположенной дальше вдоль тонкой нити. Таким образом, нити миозина скользят по тонким нитям актина.
■ Сокращение мышцы стимулируется высвобождением Са 2+ из саркоплазматического ретикулума. Ионы Са 2+ связываются с белком тропонином, приводя к конформационным изменениям в комплексе тропонина с тропомиозином и инициируя цикл взаимодействий актина с миозином.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2021 Все права на дизайн сайта принадлежат С.Є.А.





