что такое акинезия в кардиологии
Акинезия

Отдельно стоит младенческая акинезия, которая связана с развитием плода. Активные движения во внутриутробном состоянии положительно влияют на рост плода и его развитие. При отсутствии движения у младенца могут не сформироваться внутренние органы.
Общие данные
Возникать заболевание может в любом возрасте. Симптомы включают:
В зависимости от основного диагноза симптомы акинезии могут отличаться. Что касается распространенности этого проявления среди пациентов с болезнью Паркинсона, то она достигает почти 50% по данным исследования, проведенным путем опроса большого числа людей с установленным диагнозом.
В практике врачей есть немало случаев, когда акинезия является единственным симптомом, который беспокоит человека. При детальном обследовании других заболеваний не выявляется.
Примеры симптомов акинезии:
По данным исследований, около 35% младенцев, которым поставлен диагноз внутриутробная акинезия, умирают при рождении. Большая часть из остальных не способны к длительной жизни из-за патологий легких.
Акинезия и дискинезия: отличия
Ввиду схожести названий эти два симптома нередко путают. На самом деле у них общее только начало, а именно, патология передачи нервного импульса. Акинезией называют отсутствие и невозможность совершения движения. Пациент не сможет перемещаться, даже если очень к этому стремится.
В случае дискинезии присутствуют непроизвольные движения мышцами. Сюда относят тремор, рывки, дрожание. Большинство из этих симптомов характерны для болезни Паркинсона.
Причины и классификация
Основной причиной акинезии доказано считают нехватку гормона дофамина, в одну из функций которого входит контроль над способностью управлять мышцами.
Дофаминовый недостаток может возникнуть и на фоне приема некоторых медикаментов. Как правило, все симптомы прекращаются самостоятельно через некоторое время после отмены препарата.
Несбалансированный уровень других гормонов может спровоцировать приступы акинезии. Так, гипотериоз является пусковым механизмом для обратимой акинезии.
Некоторые заболевания мозга также могут вызывать симптомы отсутствия движения. Установлено, что у мужчин они встречаются чаще, чем у женщин. Полагается, что эстрогены оказывают определенное блокирующее влияние на развитие заболевания.

Гипоксия плода, связанная с тяжелыми нарушениями во время беременности, перенесенными заболеваниями у будущей матери или неправильным образом жизни также могут стать причиной временной компенсированной акинезии. В ряде случаев при такой ситуации рождается нежизнеспособный младенец.
Генетические причины стоят особняком. Им уделяется большое внимание в исследованиях. Ученые пытаются выяснить, какие их генных мутаций способны приводить к первичной акинезии. В данный момент установлено, что гены DOK7 и RAPsn напрямую оказывают влияние на развитие акинезии. Их мутации передаются по нисходящей линии, поэтому при планировании потомства людям, страдающим любыми стадиями акинезии, рекомендовано пройти тесты, выявляющие мутации этих генов.
Лечение акинезии
Специфического лечения акинезии не существует. В случае, если она вызвана факторами извне, рекомендуется прервать влияние этих факторов. Такое чаще всего происходит при реакции организма на медикаменты определенных групп. Хороший результат дает физиотерапия и рефлексотерапия. Их назначают пациентам с учетом стадии заболевания.
В ряде ситуаций, когда из-за акинезии могут случиться травмы (например, симптомы носят приступообразный характер), рекомендовано ограничение самостоятельной подвижности, вплоть до размещения пациента в инвалидной коляске.
Поражение коронарного русла и изменения фракции выброса левого желудочка сердца у больных с первичным инфарктом миокарда “без зубца q”
Опубликовано в журнале:
Крылов В.В., Филатов А.А., Лебедева А.Ю., Клыков Л.Л., Гордеев И.Г.
Городская клиническая больница №15 им. О.М. Филатова, 2-е кардиологическое отделение с блоком интенсивной терапии, Москва
Резюме
Проведен анализ результатов коронароангиографии, выполненной 90 больным с острым “не-Q” инфарктом миокарда” в возрасте от 32 до 78 лет – 68 мужчинам и 22 женщинам. Cредний возраст больных – 64,5±2,2 лет.
При проведении эндоваскулярных процедур использовалась транслюминарная ангиопластика и/или стентирование коронарных артерий, баллонные катетеры и стенты B x Sonic корпорации “Johnson and Johnson”. Всем больным проводилась стандартная терапия аспирином, бета-адреноблокаторами, ингибиторами АПФ, антикоагулянтами, клопидогрелем.
Проведено сопоставление характера поражения коронарного русла и изменения ФВ левого желудочка. Наиболее часто у пациентов с инфарктом миокарда “без зубца Q” встречается однососудистое поражение; частота встречаемости двух- и трехсосудистого поражения у этих пациентов приблизительно одинакова. В 8,9% случаев не выявлено гемодинамически значимого поражения коронарного русла.
Ключевые слова: инфаркт миокарда “без зубца Q”, коронароангиография, фракция выброса левого желудочка сердца, стеноз, коронарные артерии, вентрикулография левого желудочка сердца.
В ХХI веке во всем мире, включая Россию, наблюдается тенденция к увеличению числа больных молодого возраста с острым коронарным синдромом, который является одним из вариантов течения ИБС. Из всех больных, перенесших инфаркт миокарда, более 10% составляют лица молодого возраста и, в основном, мужчины. Нестабильная стенокардия и инфаркт миокарда “без зубца Q” составляет 54,3 на 100000 человек [5].
Несмотря на большое количество работ, посвященных инфаркту миокарда, ангиографическая картина инфаркта миокарда “без зубца Q” на ЭКГ, встречается в научных трудах крайне редко [4], поэтому актуальность данной темы не вызывает сомнения.
В настоящее время у врачей – кардиологов отсутствует единое мнение не только о роли эндоваскулярных методов лечения, но и о целесообразности раннего ангиографического обследования этой категории пациентов. Преимущество проведения коронароангиографии и проведения по показаниям эндоваскулярного лечения инфаркт – зависимой артерии в острый период ИМ без подъема сегмента ST и у больных с ранней постинфарктной стенокардией очевидно. В этих случаях выполнение КАГ рекомендуется через 6 месяцев после ИМ. Интенсивное развитие эндоваскулярных технологий и появление стентов с лекарственным покрытием существенно расширили возможности и показания к раннему эндоваскулярному лечению у больных, перенесших инфаркт миокарда без зубца Q на ЭКГ [1–4, 6].
Актуальным и недостаточно освященным в современной научной литературе является вопрос, каким образом выполненное в госпитальном периоде эндоваскулярное лечение влияет на частоту рецидивов стенокардии, частоту повторного инфаркта миокарда, динамику фракции выброса левого желудочка сердца, на показатель выживаемости в отдаленные сроки после вмешательства у этих пациентов [4].
Пациенты с перенесенным инфарктом миокарда “без зубца Q” остаются одной из наиболее сложных категорий для инвазивного лечения, что требует систематизации накопленного опыта и выработки алгоритма ведения таких больных. С одной стороны, перенесенный “не-Q инфаркт миокарда”, как правило, свидетельствует о наличии атеросклеротического коронарного поражения коронарных артерий, с другой стороны, наличие сохранного миокарда требует определения оптимальной тактики для предотвращения повторных инфарктов и улучшения отдаленного прогноза. Отсутствие зубца Q на ЭКГ после перенесенного острого коронарного синдрома свидетельствует об отсутствии трансмуральных изменений миокарда [4,6, 9,10,11]. Тем не менее, отдаленный прогноз пациентов с перенесенным инфарктом миокарда “без зубца Q” остается неудовлетворительным и связан с повышенным риском повторных коронарных осложнений [4]. У больных с достигнутой реперфузией остается морфологический субстрат поражения (стенозирующая атеросклеротическая бляшка) и жизнеспособный миокард в бассейне кровоснабжения инфаркт-связанной артерии. Как правило, наличие гемодинамического поражения в коронарном сосуде и сохранный миокард в бассейне его кровоснабжения – причина сохранения постинфарктной стенокардии. Инфаркт миокарда “без зубца Q” не настолько обширен и не столь часто вызывает летальный исход в раннем постинфарктном периоде, по сравнению с инфарктом миокарда “с зубцом Q”, но он чаще вызывает нестабильность миокарда, что ведет к повышению частоты повторных инфарктов и рекуррентной стенокардии [4, 9].
Материал и методы
В исследование были включены 90 больных острым “Q-необразующим” инфарктом миокарда в возрасте от 32 до 78 лет – 68 мужчин, 22 женщины. Cредний возраст больных составил 64,5±2,2 лет.
Анамнез ИБС в среднем составил от 0 до 8 лет. При поступлении оценивались клинические и биохимические показатели крови (креатинфосфокиназа и ее изоферменты, тропонин Т), динамика на ЭКГ. В течение 2-х – 30 дней после госпитализации всем больным была проведена коронароангиография. При рецидиве болевого синдрома проведение коронароангиографии осуществляли в течение суток. Все пациенты получали стандартную терапию: дезагреганты, антикоагулянты, бета-блокаторы, антагонисты Са, ингибиторы АПФ, нитраты, клопидогрель.
По критериям ВОЗ, при постановке диагноза острого инфаркта миокарда использовали наличие двух из трех следующих признаков: характерная клиническая картина боли за грудиной, динамика на серии ЭКГ и повышение – с последующим снижением – кардиальных ферментов в плазме (креатинфосфокиназа и ее изоферменты, тропонин Т).
Больных разделили на группы по срокам проведения эндоваскулярных процедур и характера поражения коронарного русла.
Коронароангиография и левая вентрикулография
Селективная коронароангиография и левая вентрикулография выполнялась всем больным в течение госпитализации по методике Judkiens (1967) на аппарате “Bicor-TOP” фирмы Siemens. Профилактика возможных осложнений достигалась следующими обязательными мероприятиями:
Исследование проводилось в присутствии врачей – анестезиолога, реаниматолога и кардиолога.
Введение катетера осуществлялось путем чрескожной пункции бедренной артерии по модифицированной методике Сельдингера. Пункция бедренной артерии осуществлялась в асептических условиях под местной анестезией 0,5% раствором новокаина, односекционной остроконечной иглой размером 18 inch под углом 45є к длинной оси сосуда. Чаще всего проводили пункцию правой бедренной артерии. Использовались интрадьюсеры размером 6 – 7 F.
Для проведения селективной коронароангиографии использовались катетеры Джадкинса. В качестве контрастного вещества использовался 76% урографин (Shering) или Омнипак 350 мг/мл (Nykomed).
Оценка степени восстановления коронарного кровотока по данным коронарографии, предложенная в исследовании TIMI (Thrombolysis in Myocardial Infarction)
| Степень | Данные коронарографии |
|---|---|
| 0 | Отсутствие кровотока: контрастное вещество не проходит ниже места окклюзии |
| 1-я | Минимальный кровоток: контрастное вещество просачивается ниже места окклюзии коронарного сосуда, но не заполняет сосудистое русло |
| 2-я | Частичный кровоток: контрастное вещество проходит через место окклюзии и заполняет сосудистое русло, однако это происходит медленнее, чем в нормальных сосудах |
| 3-я | Полное восстановление кровотока: контрастное вещество заполняет сосуд ниже места закупорки так же быстро, как это происходит выше места окклюзии; контрастное вещество быстро покидает сосуд |
При анализе стенотического поражения коронарных артерий использовалась классификацию Петросяна Ю.С. – Зингермана Л.С. (1973г).
Анализ сократимости левого желудочка проводился автоматически при помощи системы HICOR. Оценивался конечный диастолический, конечный систолический объемы, рассчитывалась фракция выброса.
Результаты и обсуждение
В табл.1 приведены половозрастные характеристики групп больных. Средний возраст больных в первой группе составил 53,7±4,6 лет, во второй – 58,7±6,3 лет, в третьей – 62,4±5,4 лет, в четвертой – 59,5±4,7.
Группы были сопоставимы по возрасту (для критерия Крускалла-Уоллиса р>0,05) и полу (для критерия χ 2 р>0,05 при парном сравнении групп).
Передний инфаркт наблюдался у 57 больных (63,3%), нижний – у 22 (24,4%), нижний боковой – у 11 (12,2%). Полученные данные согласуются с данными литературы о локализации “не Q” – инфаркта миокарда [4,8,11,14]. Статистически значимые различия групп по локализации поражения отсутствовали (для критерия χ 2 р>0,05 при парном сравнении групп).
Таблица 1
Характеристика групп больных по возрасту и полу
| Показатель | Группа 1 (n-25) | Группа 2 (n-38) | Группа 3(n-19) | Группа 4 (n-8) | ||||
|---|---|---|---|---|---|---|---|---|
| Пол | 19 мужчин | 6 женщин | 27 мужчин | 11 женщин | 16 мужчин | 3 Женщины | 4 мужчин | 2 женщины |
| Возраст, лет | 53,7 | 58,7 | 62,4 | 59,5 | ||||
| Отклонение | 53,7±4,6 | 58,7±6,3 | 62,4±5,4 | 59,5±4,7 | ||||
Табл.2 иллюстрирует локализацию инфаркта миокарда в различных группах лечения: в первой группе больных преобладал передний инфаркт. Он был отмечен у 56% больных. Нижний инфаркт выявлен у 32%, нижний боковой – у 12% больных. Сопоставимые данные получены для второй, третьей и четвертой групп. Во всех группах больных преобладал передний инфаркт миокарда.
Таблица 2
Локализация инфаркта миокарда в группах больных
| Группа 1(n-25) | Группа 2(n-38) | Группа 3(n-19) | Группа 4 (n-8) | |||||
|---|---|---|---|---|---|---|---|---|
| Локализация инфаркта микарда | Число случаев | % | Число случаев | % | Число случаев | % | Число случаев | % |
| Нижний | 8 | 32,0% | 10 | 26,3% | 2 | 10,5% | 2 | 25,0% |
| Передний | 14 | 56,0% | 24 | 63,2% | 15 | 78,9% | 4 | 50,0% |
| Нижний боковой | 3 | 12,0% | 4 | 10,5% | 2 | 10,6% | 2 | 25,0% |
| Всего | 25 | 100% | 38 | 100% | 19 | 100% | 8 | 100% |
Табл. 3 свидетельствует о том, что по частоте поражения различных коронарных артерий у обследованных больных сохраняются те же закономерности, что и в целом по ИБС: в преобладающем большинстве случае сосудистая катастрофа происходила в передней межжелудочковой (54,9%) и правой коронарной (19,9%) артериях; в огибающей артерии – в 8,5% случаев, в общем стволе левой коронарной артерии – также в 8,5% случаев. Поражение ветвей второго порядка мы наблюдали относительно редко: ветвь тупого края – 4,9% случаев, диагональная ветвь – 3,7% случаев.
Таблица 3
Инфаркт-зависимые артерии в группах больных
Таблица 4
Локализация поражения в инфаркт-зависимой артерии
| Группа 1 (n=25) | Группа 2 (n=38) | Сумма | ||||
|---|---|---|---|---|---|---|
| Локализация в артерии | Число случаев | % | Число случаев | % | Число случаев | % |
| Проксимальное | 11 | 44,0% | 17 | 44,7% | 28 | 44,4% |
| Среднее | 13 | 52,0% | 20 | 52,6% | 33 | 52,4% |
| Дистальное | 1 | 4,0% | 1 | 2,6% | 2 | 3,2% |
В четвертой группе больных после проведения коронароангиографии не выявлено гемодинамически значимого поражения инфаркт-зависимой артерии. В этой группе инфаркт-зависимые артерии распределились следующим образом: передняя межжелудочковая артерия – 50,0% случаев, огибающая артерия – 12,5% случаев, правая коронарная артерия – 37,5% случаев. Следует отметить, что в 91,4% случаев поражены магистральные артерии и только в 8,6% случаев локализация поражения – ветви второго порядка.
Преобладающее поражение инфаркт-зависимых артерий у больных 1-й группы – в проксимальной и средней частях с высокой степенью стеноза (≥90%).
Среднее количество пораженных артерий у больных 1-й группы составило 1,12±0,25. Сочетанное поражение коронарных артерий отмечалось у 3-х (12%) пациентов: в 2-х случаях это было сочетание передней межжелудочковой и правой коронарной артерии, в одном случае – правой коронарной и огибающей артерий.
В первые сутки инфаркта миокарда “без зубца Q” было проведено 9 (36,0%) эндоваскулярных процедур, во вторые сутки – 16 (64,0%).
Наиболее часто в первой группе пациентов (48%) встречалось изолированное поражение передней межжелудочковой артерии. Особо следует отметить, что при оценке кровотока по TIMI, у 8 (32%) больных определяется снижение кровотока, наличие спазма инфаркт – зависимой артерии, который купируется после введения внутрикоронарно 0,1% спиртового раствора нитроглицерина – 11 (44%) больных.
Характер поражения инфаркт – зависимой артерии у пациентов в 2-й группы отличался практически равным поражением как проксимального отдела артерии, так и среднего ее отдела (44,7% и 52,4% соответственно). Частота встречаемости стенозов – более 75% и более 90% – была примерно одинаковая.
Среднее количество пораженных артерий составило 1,57±0,27. Во второй группе пациентов большее разнообразие видов сочетанного поражения инфаркт – зависимых артерий по сравнению с больными первой группы. Во второй группе сочетанное поражение артерий отмечалось у 21 больного (55,3% против 12% в первой группе). В 4-х случаях, это было сочетание передней межжелудочковой артерии и правой коронарной артерии. В 5-ти случаях – передней межжелудочковой артерии и огибающей артерии. В 2-х случаях – передней межжелудочковой артерии, огибающей артерии и правой коронарной артерии. В 3-х случаях – передней межжелудочковой артерии и диагональной ветви ПМЖВ. В одном случае сочетание поражения ствола левой коронарной артерии, передней межжелудочковой ветви и огибающей артерии. В 2х случаях – сочетание поражения огибающей артерии и ветви тупого края. В 4-х случаях – сочетание поражения правой коронарной артерии и огибающей артерии. Во второй группе больных чаще встречается сочетанное поражение коронарных артерий (для критерия χ 2 р=0,012, p 2 р=0,033, p 2 р=0,026, p 2 p=0,044, р 2 p=0,026, р 2 p=0,006, р 2 p=0,038, p 0,05).
Согласно данным таблицы 8, фракция выброса левого желудочка сердца не зависит от количества пораженных артерий (для критерия Спирмена r=0,00014, р>0,05).
Таблица 8
Показатели фракции выброса левого желудочка сердца и число пораженных артерий
| Показатель | Однососудистое поражение | Двухсосудистое поражение | Трехсосудистое поражение |
|---|---|---|---|
| Средний возраст больных | 55,78 | 58,23 | 62,36 |
| Фракция выброса левого желудочка сердца | 58,44% | 57,18% | 56,34% |
Мы также рассмотрели влияние на изменение ФВ ЛЖ степени обструкции инфаркт-зависимой артерии (табл.9). Статистически подтвердить наличие коррелятивной связи не удалось (для критерия Спирмена r=0,024, р>0,05). Оказалось, что у больных со стенозом II степени и субтотальным стенозом, показатели ФВ ЛЖ статистически не различаются (для критерия Крускалла-Уоллиса p=0,446, p>0,05).
Таблица 9
Фракции выброса левого желудочка сердца в зависимости от степени обструкции инфаркт – зависимой артерии
| Показатель | Стеноз 2-й степени | Субокклюзия | Окклюзия | Без поражения |
|---|---|---|---|---|
| Фракция выброса левого желудочка сердца | 55,83% | 54,84% | 52,80% | 58,24% |
В то же время, наличие развитого коллатерального кровотока благотворно влияет на сократительную функцию миокарда, о чем свидетельствуют более высокие в данном случае значения ФВ ЛЖ, что отражается в более высоком значении последнего у больных второй группы, в которой коллатеральный кровоток более развит (табл.10).
Таблица 10
Изменения фракции выброса левого желудочка сердца в зависимости от наличия коллатералей
| Показатель | С коллатералями | Без коллатералей |
|---|---|---|
| Фракция выброса левого желудочка сердца | 57,30% | 52,10% |
Выводы
Литература
Abstract
Coronary angiography was performed in 90 patients with acute non-Q wave myocardial infarction (non-Q MI) – 68 men and 22 women aged 32–78 years (mean age 64,5±2,2 years).
Endovascular intervention included transluminal angioplasty and/or coronary artery stenting, with balloon catheters and B x Sonic stents (Johnson and Johnson Corp.). All patients received standard therapy of aspirin, beta-blockers, ACE inhibitors, anticoagulants, and clopidogrel.
For patients with non-Q MI, one-vessel coronary artery pathology was most typical; two- and three-vessel pathology prevalence was similar. In 8,9% of the cases, no hemodynamically significant coronary artery pathology was observed.
Keywords: Non-Q myocardial infarction, coronary angiography, left ventricular ejection fraction, stenosis, coronary arteries, left ventricular ventriculography.
Что такое акинезия в кардиологии
а) Региональная сократимость. Так как в различных слоях миокарда волокна ориентированы по-разному, то движение стенки, видимое при ЭхоКГ, является суммой различно ориентированных сокращений в миокарде. При этом внутренняя (субэндокардиальная) половина стенки утолщается значительно сильнее, чем внешняя, субэпикардиальная. В итоге нормальные сегменты стенки желудочка выполняют в систолу движение, направленное внутрь желудочка, а сама стенка утолщается. При этом утолщение стенки является более надежным параметром, который можно использовать и, например, в случае асинхронного сокращения при блокаде ножки пучка Риса.
Утолщение стенки и направленное внутрь движение наименее выражены в области базальных сегментов. Особое место занимает базальная часть базального переднеперегородочного сегмента, которая во время систолы не совершает направленного внутрь движения или даже немного смещается наружу (прежде всего, это хорошо видно на парастернальном базальном сечении по короткой оси), что, предположительно, обусловлено «пульсовой волной» ударного объема в области выносящего тракта левого желудочка.
1. Качественная оценка. В первую очередь происходит качественная оценка региональной сократимости:
— нормокинезия: нормальное движение и утолщение стенки,
— гипокинезия: сниженное, но определяемое движение и утолщение стенки (это наиболее субъективно вариабельная категория),
— акинезия: отсутствие движения и утолщения стенки,
— дискинезия: систолическое движение стенки наружу,
— аневризма: выпячивание левого желудочка, отмечающееся и во время диастолы, с аномально тонким, не сокращающимся миокардом,
— гиперкинезия: движение и утолщение стенки превышают нормальные показатели, что встречается при клапанной регургитации, в качестве компенсации нарушения локальной сократимости в другой зоне (например, после инфаркта), во время нагрузки или при стимуляции катехоламинами. При этом в конце систолы почти вся полость может быть замещена сокращающимся миокардом (систолическая облитерация полости желудочка). Сама по себе гиперкинезия не имеет патологического значения, однако является указанием на одно из вышеназванных состояний.
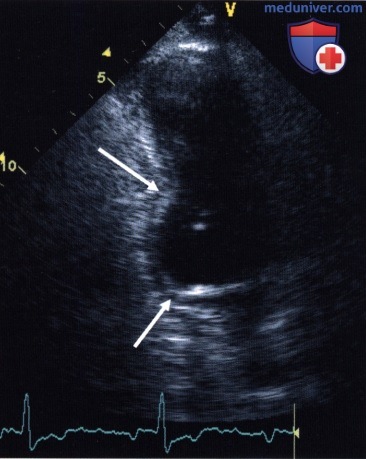

2. Количественный анализ. Многочисленные попытки количественного анализа локальной сократимости, в особенности автоматизации оценки, до сих пор не привели к созданию надежной методики, хотя бы приблизительно равнозначной визуальному заключению опытного исследователя. Поэтому сохраняется проблема субъективной вариабельности оценки локальной сократимости, которая лишь в ограниченной мере решается улучшением качества изображения, параллельным просмотром различных видеофрагментов, введением контрастных средств для левых отделов сердца и другими усовершенствованиями.
Недавно опубликованный систематический обзор различных методических подходов показал степень соответствия между различными визуализирующими методиками и определяемой при помощи согласованного клинического мнения «истиной» (степень соответствия выражалась в виде доверительного интервала значений каппы Кохена). Значение каппы, равное 1, означает полное соответствие бинарного события (нарушение локальной сократимости присутствует/отсутствует). Доверительные интервалы каппы с точки зрения выявления нарушений локальной сократимости составили:
— 0,5-0,7 для нативной ЭхоКГ,
— 0,6-0,8 для ЭхоКГ с контрастированием левых отделов,
— 0,5-0,8 для МРТ.
В рамках каждой из методик вариабельность между двумя исследователями составила:
— 0,3-0,5 для ЭхоКГ,
— 0,7-0,9 для ЭхоКГ с контрастированием левых отделов и
— 0,3-0,6 для МРТ.
Особенное значение эта проблема имеет в стресс-ЭхоКГ и при диагностике жизнеспособного миокарда в зонах с нарушенной сократимостью (см. соответствующие главы).
3. Анализ региональной деформации. В настоящее время наиболее перспективным подходом к количественной оценке локальной сократимости является анализ региональной деформации (strain/strain rate) при помощи тканевой допплерографии. Здесь можно локально и количественно оценить степень выраженности и временную динамику систолической и диастолической деформации (например, продольное укорочение и удлинение на апикальных сечениях). Но до сих пор получаемые данные чувствительны к артефактам, обременены шумовым сигналом, и их часто бывает трудно интерпретировать. Методика двумерного отображения деформации (20-strain), находящаяся ныне в начальной стадии апробации, должна существенно улучшить данный методический подход.
б) Причины нарушения сократимости:
1. Коронарная болезнь сердца. Чаще всего локальные нарушения сократимости развиваются на фоне коронарной болезни сердца:
— После инфаркта развивается необратимое, сохраняющееся в покое нарушение локальной сократимости. При этом большой постинфарктный рубец проявляется в виде акинезии или аневризмы, а после мелких инфарктов остается лишь гипокинезия или существенное нарушение локальной сократимости не определяется. Большие постинфарктные рубцы характеризуются уменьшением толщины стенки примерно на 30% и иногда несколько более высокой эхогенностью, чем окружающий миокард, что объясняется более высоким содержанием коллагена в рубце.
Надежное соотнесение нарушения локальной сократимости с гистологической зоной инфаркта осложняется связностью всех сегментов миокарда: как соседние, нормально сокращающиеся области миокарда могут «увлекать» акинетическую зону инфаркта, так и, наоборот, нарушения локальной сократимости в инфарктной зоне могут снижать амплитуду сокращений соседних здоровых сегментов («теттеринг-эффект»),
— В случае острой ишемии в покое или на фоне нагрузки (обратимые нарушения сократимости, диагностическое использование в стресс-ЭхоКГ).
— В покое в связи с оглушенным (станнинг) или гибернирующим миокардом, т.е. отсутствием (или снижением) сократимости в еще жизнеспособном миокарде.
2. Другие заболевания. Кроме КБС, нарушения локальной сократимости могут развиваться при следующих заболеваниях:
— ДКМП: хотя поражение часто имеет диффузный характер, но нередко обнаруживаются зоны гипокинезии различной степени выраженности. Однако аневризмы при этом заболевании не встречаются.
— Миокардиты: здесь изредка встречаются и более выраженные нарушения локальной сократимости, например, апикальная аневризма при болезни Чагаса (Trypanosoma cruzii).
— Нарушения локальной сократимости, поражающие только межжелудочковую перегородку, без вовлечения остальной перфузионной территории ПМЖВ, т.е. передней стенки: они встречаются относительно часто. С одной стороны, возможно развитие аномального временного паттерна сократимости с сохраненным утолщением перегородки в результате локального замедления механической систолы (например, при блокаде левой ножки пучка Гиса, правожелудочковом кардиостимуляторе, синдроме WPW, после кардиохирургического вмешательства), а также в результате взаимодействия левого и правого желудочков или наложения движения всего сердца в грудной клетке на процессы сокращения, например, после операции на сердце, при повышении нагрузки давлением или объемом на правый желудочек или в случае значительного перикардиального выпота.
Если в начале систолы происходит движение перегородки, направленное наружу, то такая ситуация обозначается термином «парадоксальная перегородка», что, будучи неспецифическим изменением, может встречаться при всех вышеназванных клинических ситуациях. С другой стороны, может развиваться истинное снижение амплитуды сокращений, как, например, при КБС (закупорка септальной ветви) или кардиомиопатии.
Редактор: Искандер Милевски. Дата публикации: 26.12.2019