что такое аем в физике
Атомная единица массы
А́томная едини́ца ма́ссы (обозначение а. е. м.), она же дальто́н (обозначение Da), — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12 C и равна 1/12 массы этого нуклида.
Рекомендована к применению ИЮПАП в 1960 и ИЮПАК в 1961 годах. Официально рекомендованными являются англоязычные термины atomic mass unit (a.m.u.) и более точный — unified atomic mass unit (u.a.m.u.) (универсальная атомная единица массы, но в русскоязычных научных и технических источниках он употребляется реже).
В 1997 году во 2-ом издании справочника терминов ИЮПАК установлено численное значение а. е. м.:
1 а. е. м. ≈ 1,660 540 2(10)·10 −27 кг = 1,660 540 2(10)·10 −24 г
1 а. е. м. ≈ 0,931 494 028(23) ГэВ/c²; 1 ГэВ/c² ≈ 1,073 544 188(27) а. е. м.
1 а. е. м. 
История
Понятие атомной массы ввёл Джон Дальтон в 1803 году, единицей измерения атомной массы сначала служила масса атома водорода (так называемая водородная шкала). В 1818 Берцелиус опубликовал таблицу атомных масс, отнесённых к атомной массе кислорода, принятой равной 103. Система атомных масс Берцелиуса господствовала до 1860-х годов, когда химики опять приняли водородную шкалу. Но в 1906 они перешли на кислородную шкалу, по которой за единицу атомной массы принимали 1/16 часть атомной массы кислорода. После открытия изотопов кислорода ( 16 O, 17 O, 18 O) атомные массы стали указывать по двум шкалам: химической, в основе которой лежала 1/16 часть средней массы атома природного кислорода, и физической с единицей массы, равной 1/16 массы атома нуклида 16 O. Использование двух шкал имело ряд недостатков, вследствие чего с 1961 перешли к единой, углеродной шкале.
Ссылки
Примечания
Полезное
Смотреть что такое «Атомная единица массы» в других словарях:
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. 1,6605655(86).10 27 кг … Большой Энциклопедический словарь
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы (см.), (см.) и элементарных частиц, равная 1/ массы изотопа углерода с массовым числом 12 … Большая политехническая энциклопедия
АТОМНАЯ ЕДИНИЦА МАССЫ — значение массы атома, принятое за единицу. До 1961 г. были приняты два значения величины А. е. м.: химическая для выражения атомных масс хим. элементов и их соединений, равная 1,66022•10 24 г, составляющая 1/16 атомной массы элемента кислорода, и … Геологическая энциклопедия
атомная единица массы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN atomic mass unitatomic weight unitamu … Справочник технического переводчика
атомная единица массы — (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (так называемая углеродная шкала). 1 а. е. м. = 1,6605655(86)·10 27кг. * * * АТОМНАЯ ЕДИНИЦА МАССЫ … Энциклопедический словарь
атомная единица массы — atominės masės vienetas statusas T sritis fizika atitikmenys: angl. amu; atomic mass unit vok. atomare Masseneinheit, f; Atommasseneinheit, f rus. атомная единица массы, f; единица атомной массы, f pranc. unité de masse atomique, f … Fizikos terminų žodynas
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. = = 1,6605655(86) х 10 27 кг … Естествознание. Энциклопедический словарь
Атомная единица массы — (a. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 a. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 a. е. м. = 1,6605655(86).10 27 кг … Концепции современного естествознания. Словарь основных терминов
АТОМНАЯ ЕДИНИЦА МАССЫ — ед. массы, применяемая в атомной физике и равная 1/12 массы изотопа углерода с массовым числом 12. Обозначение а. е. м. 1 а. е. м. 1,6605402 10 27 кг … Большой энциклопедический политехнический словарь
атомная единица массы
Полезное
Смотреть что такое «атомная единица массы» в других словарях:
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. 1,6605655(86).10 27 кг … Большой Энциклопедический словарь
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы (см.), (см.) и элементарных частиц, равная 1/ массы изотопа углерода с массовым числом 12 … Большая политехническая энциклопедия
АТОМНАЯ ЕДИНИЦА МАССЫ — значение массы атома, принятое за единицу. До 1961 г. были приняты два значения величины А. е. м.: химическая для выражения атомных масс хим. элементов и их соединений, равная 1,66022•10 24 г, составляющая 1/16 атомной массы элемента кислорода, и … Геологическая энциклопедия
атомная единица массы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN atomic mass unitatomic weight unitamu … Справочник технического переводчика
Атомная единица массы — У этого термина существуют и другие значения, см. Дальтон. Атомная единица массы (обозначение а. е. м.), она же дальтон (обозначение Da), внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц.… … Википедия
атомная единица массы — atominės masės vienetas statusas T sritis fizika atitikmenys: angl. amu; atomic mass unit vok. atomare Masseneinheit, f; Atommasseneinheit, f rus. атомная единица массы, f; единица атомной массы, f pranc. unité de masse atomique, f … Fizikos terminų žodynas
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. = = 1,6605655(86) х 10 27 кг … Естествознание. Энциклопедический словарь
Атомная единица массы — (a. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 a. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 a. е. м. = 1,6605655(86).10 27 кг … Концепции современного естествознания. Словарь основных терминов
АТОМНАЯ ЕДИНИЦА МАССЫ — ед. массы, применяемая в атомной физике и равная 1/12 массы изотопа углерода с массовым числом 12. Обозначение а. е. м. 1 а. е. м. 1,6605402 10 27 кг … Большой энциклопедический политехнический словарь
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Атомная единица массы (дальтон, углеродная единица)
Атомная единица массы (дальтон, углеродная единица).
Атомная единица массы (дальтон, углеродная единица) – единица измерения массы атомов и молекул. Имеет русское обозначение – а.е.м. и международное обозначение – u.
Другие единицы измерения
Атомная единица массы (дальтон, углеродная единица), как единица измерения:
Атомная единица массы она же дальтон (русское обозначение – Да, международное – Da), она же углеродная единица – внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц.
Атомная единица массы имеет русское обозначение – а.е.м. и международное обозначение – u.
Атомная единица массы определяется как 1⁄12 массы свободного покоящегося атома углерода 12 C, находящегося в основном состоянии.
Атомная единица массы не является единицей Международной системы единиц (СИ), но Международный комитет мер и весов относит её к единицам, допустимым к применению наравне с единицами СИ.
В Российской Федерации в соответствии с Постановлением Правительства РФ от 31 октября 2009 г. N 879 “Об утверждении Положения о единицах величин, допускаемых к применению в Российской Федерации” атомная единица массы допущена для использования в качестве внесистемной единицы без ограничения срока действия допуска с областью применения «атомная физика».
Применение атомной единицы:
Атомная единица массы (дальтон, углеродная единица) применяется для масс молекул, атомов, атомных ядер и элементарных частиц.
Перевод в другие единицы измерения:
1 а.е.м. = 1,660 539 066 60(50)⋅10 −27 кг.
Молярная масса определённого вещества, выраженная в граммах на моль (г/моль), численно совпадает с массой молекулы этого вещества, выраженной в а. е. м.
1 а.е.м. = 0,931 494 102 42(28) ГэВ/c 2 ;
1 ГэВ/c 2 = 1,073 544 102 33(32) а.е.м.
где а. е. м. – атомная единица массы, кг – килограмм, ГэВ – гигаэлектронвольт, c – скорость света.
Кратные и дольные единицы:
В соответствии с ГОСТ 8.417-2002 и «Положением о единицах величин, допускаемых к применению в Российской Федерации», наименование и обозначение единицы «атомная единица массы» не допускается применять с дольными и кратными приставками СИ. Однако дольные и кратные единицы допустимы для использования с синонимичным названием единицы «дальтон»; например, массы биологических макромолекул часто выражаются в килодальтонах (кДа) и мегадальтонах (МДа), а чувствительность масс-спектрометрической аппаратуры может выражаться в миллидальтонах (мДа) и микродальтонах (мкДа).
| Кратные | Дольные | ||||||
| величина | название | обозначение | величина | название | обозначение | ||
| 10 1 Да | декадальтон | даДа | daDa | 10 −1 Да | децидальтон | дДа | dDa |
| 10 2 Да | гектодальтон | гДа | hDa | 10 −2 Да | сантидальтон | сДа | cDa |
| 10 3 Да | килодальтон | кДа | kDa | 10 −3 Да | миллидальтон | мДа | mDa |
| 10 6 Да | мегадальтон | МДа | MDa | 10 −6 Да | микродальтон | мкДа | µDa |
| 10 9 Да | гигадальтон | ГДа | GDa | 10 −9 Да | нанодальтон | нДа | nDa |
| 10 12 Да | терадальтон | ТДа | TDa | 10 −12 Да | пикодальтон | пДа | pDa |
| 10 15 Да | петадальтон | ПДа | PDa | 10 −15 Да | фемтодальтон | фДа | fDa |
| 10 18 Да | эксадальтон | ЭДа | EDa | 10 −18 Да | аттодальтон | аДа | aDa |
| 10 21 Да | зеттадальтон | ЗДа | ZDa | 10 −21 Да | зептодальтон | зДа | zDa |
| 10 24 Да | иоттадальтон | ИДа | YDa | 10 −24 Да | иоктодальтон | иДа | yDa |
Интересные факты:
Понятие атомной массы ввёл Джон Дальтон в 1803 году, единицей измерения атомной массы сначала служила масса атома водорода (так называемая водородная шкала).
В 1818 году Берцелиус опубликовал таблицу атомных масс, отнесённых к атомной массе кислорода, принятой равной 103. Система атомных масс Берцелиуса господствовала до 1860-х годов, когда химики опять приняли водородную шкалу. Но в 1906 году они перешли на кислородную шкалу, по которой за единицу атомной массы принимали 1⁄16 часть атомной массы кислорода.
После открытия изотопов кислорода ( 16 O, 17 O, 18 O) атомные массы стали указывать по двум шкалам: химической, в основе которой лежала 1⁄16 часть средней массы атома природного кислорода, и физической с единицей массы, равной 1⁄16 массы атома нуклида 16 O. Использование двух шкал имело ряд недостатков, поэтому в 1960 году сначала X Генеральная ассамблея Международного союза теоретической и прикладной физики (ИЮПАП), а в 1961 году и конгресс Международного союза теоретической и прикладной химии (ИЮПАК) приняли углеродную шкалу.
Атомная единица массы (а.е.м.)



НЕКОТОРЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Массы отдельных атомов и молекул удобно измерять не в килограммах, а в относительных единицах – в атомных единицах массы.
С точностью до 0,7% за 1 а.е.м. можно принять массу протона:
Относительные атомные массы элементов, т.е. массы атомом, выраженные в а.е.м., указаны в таблице Менделеева.
2. Моль. Число Авогадро.
В системе СИ количество вещества (не масса) измеряется в молях.
Определение. Количество вещества, содержащее столько его структурных единиц (молекул), сколько атомов С 12 в 12 г углерода, называется молем этого вещества (1кмоль=1000 моль).
А интересно, − сколько же атомов С 12 содержится в 12 г углерода? Это число называется числом Авогадро, NA. Опытным путём найдено, что
Таким образом, по определению, число NА есть количество структурных единиц (молекул) вещества в одном его моле. Например, 1 моль меди содержит NA атомов Сu, 1 моль углерода − NA атомов С, 1 моль молекулярного кислорода содержит NA молекул О2.
3. Молярная масса.
Определение. Масса (в килограммах) одного моля вещества называется его молярной массой (М):
где m – масса молекулы данного вещества в килограммах.
Так например, МCu=64 г/моль=0,064 кг/моль, 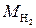
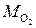
4. Оценка размеров молекул.
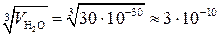
Молекулы других веществ имеют размеры того же порядка.













