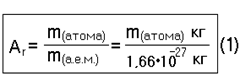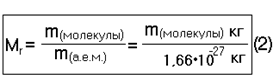что такое абсолютная масса молекулы
Масса атомов и молекул
Атомная единица массы
| Атомная единица массы (а.е.м.) = 1/12 части массы атома углерода |
Относительная атомная масса кислорода будет равна:
Это значит, что масса одного атома кислорода примерно в 16 раз больше 1/12 части массы атома углерода 12 C.
| Относительная атомная масса = отношению массы атома элемента к а.е.м. |
Относительная молекулярная масса
Поскольку молекулы вещества состоят из отдельных атомов, все вышесказанное будет справедливо и для молекулярных масс (абсолютных и относительных).
Абсолютная масса молекулы (mмолекулы) будет равна сумме абсолютных масс атомов, входящих в нее. На практике же, как правило, пользуются относительной молекулярной массой (Мr), которая складывается из относительных атомных масс всех атомов, входящих в молекулу:
Абсолютная масса молекулы воды mмолекулы (H2O) будет равна:
Относительная масса молекулы воды Мr:
| Относительная молекулярная масса = отношению абсолютной массы одной молекулы вещества к а.е.м. |
Относительная молекулярная масса показывает во сколько раз масса 1 молекулы вещества больше 1/12 части массы атома углерода 12 C.
В приведённом выше примере показано, что масса одной молекулы воды в 18 раз больше 1/12 части массы атома углерода или 1 а.е.м.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Определение абсолютной и относительной массы вещества
Абсолютная и относительная масса атомов и молекул
Массу относят к фундаментальным характеристикам атома. Поскольку ее абсолютное значение очень мало, в химии вводится понятие относительной, т.е. условной, атомной массы.
Ничтожный размер атома не исключает наличия у него атомной массы. Вся масса атома сосредоточена в ядре (протон и нейтрон практически в 2000 раз тяжелее, чем электрон). В результате почти вся масса атома приходится на общую массу нейтронов и протонов. К примеру, атомная масса кислорода равняется 2,667·10-23 г. Это его абсолютная атомная масса. Работать с таким числом неудобно. Поэтому было предложено ввести еще одну величину – относительную атомную массу.
В начале XIX века Дж. Дальтон предложил, вычисляя атомную массу, использовать в качестве эталона массу атома водорода, поскольку он является самым легким элементом. Именно по отношению к нему выражались массы атомов прочих элементов.
Однако с учетом того, что на практике чаще использовались кислородные соединения для вычисления атомных масс многих элементов, в качестве эталона удобнее стало использовать атомную массу кислорода. При этом известно, что соотношение атомных масс кислорода и водорода равно 16:1. Так возникло понятие кислородной единицы – 1/16 части его атомной массы.
Таким образом, относительная атомная масса показывает, во сколько раз масса атома конкретного элемента больше массы атома, который принимается за единицу. Сегодня это 1/12 часть массы атома углерода. Это и есть атомная единица массы, которую иногда обозначают как «дальтон».
Относительная атомная масса – отношение массы атома определенного элемента к 1/12 массы атома изотопа углерода-12. По сути относительная атомная масса является безразмерной величиной (при ее расчете единицы измерения сокращаются), но иногда ее значение выражают в атомных единицах массы (а.е.м.).
Абсолютная масса атома углерода составляет 1,993·10-23 г, согласно Периодической таблице Д.И. Менделеева. Его относительная атомная масса равна 12. Следовательно, 1/12 часть массы атома углерода составляет:
Масса одного кислородного атома приблизительно в 16 раз превышает 1/12-ю массы углеродного атома 12С.
Чтобы вычислить относительную молекулярную массу вещества, нужно сложить суммы относительных атомных масс элементов, входящих в состав молекулы, с учетом индексов, которые показывают количество атомов элемента в молекуле. Абсолютная масса одной молекулы равна относительной, умноженной на одну атомную единицу массы (1 а.е.м.).
Относительная атомная масса химического элемента
Например, определение относительной массы атома водорода выглядит так:
Элемент кислород имеет следующую относительную атомную массу:
Из формул следует, что относительная атомная масса является величиной, равной отношению абсолютной атомной массы к единице массы u (или 1 а.е.м.).
Относительная молекулярная масса вещества
Если молекула состоит из атомов нескольких химических элементов, то ее относительная молекулярная масса равна сумме их относительных атомных масс с учетом индексов в формуле вещества.
Рассмотрим пример. Молекула воды имеет в своем составе два атома водорода и один – кислорода. Чтобы определить относительную молекулярную массу, нужно сложить произведения относительной атомной массы каждого элемента на соответствующее количество атомов:
Знание относительной молекулярной массы веществ в газообразном состоянии помогает в решении задач по сравнению их плотности. Для этого высчитывается относительная плотность газов друг по другу, которая равна соотношению их относительных молекулярных масс:
Поскольку закон Авогадро применим исключительно к газообразным веществам, а ученым-химикам часто необходимо знать, сколько молекул, атомов или ионов заключено в определенных порциях твердых веществ или жидкостей, введено понятие молярной массы. Ее значение численно равно относительной молекулярной массе.
Как вычислить абсолютную массу, формулы, примеры
Найти молекулярную массу серной кислоты, используя таблицу Менделеева.
Известно, что молекулярная масса вещества равна сумме атомных масс веществ, входящих в состав молекулы. Поэтому:
M r ( H 2 S O 4 ) = 1 · 2 + 32 + 16 · 4 = 98 г / м о л ь
Решение химических задач по нахождению абсолютной массы может сводиться к использованию следующих методов:
При этом молярную массу можно найти путем сложения атомных масс элементов, входящих в состав соединения. Молярная масса находится также как отношение массы вещества к его соответствующему количеству:
Физика. 10 класс
§ 2. Масса и размеры молекул. Количество вещества
В 1,0 см 3 любого газа, находящегося при нормальных условиях (температура t0 = 0,0 °С, давление р0 = 1,0 · 10 5 Па), содержится 2,7 · 10 19 молекул. Чтобы представить, насколько велико это число, предположим, что из отверстия в ампуле вместимостью V = 1,0 см 3 ежесекундно вылетает 100 молекул. Тогда, для того чтобы все молекулы вылетели из ампулы, потребуется 8,6 млрд лет, т. е. промежуток времени, сравнимый с возрастом Вселенной (12–15 млрд лет). Такое огромное число молекул в веществе свидетельствует о том, что их размеры очень малы. Каковы же размеры и масса частиц вещества? Как определить число атомов в любом макроскопическом теле?
Молекулярно-кинетическая теория предоставляет возможность оценить массу и размеры частиц, образующих макроскопические тела. Молекулы, как и атомы, не имеют чётких границ. Если представить молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм. При таких размерах число частиц в веществе очень велико. Например, в одном грамме воды содержится 3,3 · 10 22 молекул.
Размеры и масса молекулы возрастают с увеличением числа атомов, которые входят в её состав. Атомы и молекулы (кроме многоатомных молекул органических веществ) имеют массу порядка 10 –26 кг. Из-за малых значений выражать массы атомов и молекул в килограммах (кг) неудобно. Поэтому для измерения масс атомов и молекул в химии и физике используют атомную единицу массы (а. е. м.). Атомную единицу массы выражают через массу изотопа углерода :
Массу молекулы (или атома), выраженную в атомных единицах массы, называют относительной молекулярной массой Mr (или относительной атомной массой Ar). Относительная молекулярная (или атомная) масса Mr показывает, во сколько раз масса m0 молекулы (или атома) больше атомной единицы массы:
В периодической системе химических элементов Д. И. Менделеева (см. форзац 2) возле символов элементов указаны и их относительные атомные массы. В большинстве случаев при проведении расчётов значение относительной атомной массы округляют до целого числа, используя правила приближённых вычислений. Так, например, относительная атомная масса водорода равна 1, кислорода — 16, азота — 14.
Количество вещества, содержащегося в макроскопическом теле, определяют числом частиц в нём. Приведённые выше примеры показывают, насколько велико это число. Поэтому при расчётах принято использовать не абсолютное число частиц вещества, а относительное:
т. е. количество вещества ν определяют отношением числа частиц N этого вещества к постоянной Авогадро NA.
В молекулярно-кинетической теории наряду с относительной молекулярной (или атомной) массой используют м олярную массу M — массу вещества, взятого в количестве ν = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству ν:
Молярную массу вещества также можно вычислить по формуле
1. Во сколько раз число молекул водорода, взятого в количестве νв = 8 моль, больше числа молекул азота, количество вещества которого νа = 4 моль?
| Формула | Физические величины, входящие в формулу | Единицы физических величин |
| ν — количество вещества N — число частиц вещества NA — постоянная Авогадро | моль — моль –1 | |
| М — молярная масса | ||
| m — масса вещества m0 — масса молекулы вещества | кг кг | |
| NA = 6,022·10 23 моль –1 |
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?
Абсолютная и относительная масса атомов и молекул
Масса атомов и молекул, выраженная в граммах или килограммах (г, кг), называется абсолютной (обозначается m).
Абсолютная масса атомной единицы массы:
Значение Аr приведены в таблице химических элементов Д.И.Менделеева.
Относительной молекулярной массой (Мr) вещества называется число, показывающее во сколько раз данная молекула тяжелее 1 /12 атома 12 С.
Из формул (1) и (2) следует, что Аr и Mr величины безразмерные.
Из формул (1) и (2) вытекает также связь между абсолютной и относительной массами атома и молекулы:
Масса молекулы равна сумме масс атомов, из которых молекула состоит
При определении Мr ионных соединений (солей, кислот и щелочей) структурной единицей вещества условно считается молекула.
Относительная молекулярная масса кристаллогидрата:
При определении Мr кристаллогидратов структурной единицей вещества условно считается ассоциация, состоящая из одной молекулы соли и n молекул воды, связанных с ней.
Допускается также выражение относительной атомной и молекулярной масс в а.е.м.
Дата добавления: 2016-11-26 ; просмотров: 9448 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Молекулы. Химические формулы. Молекулярные массы
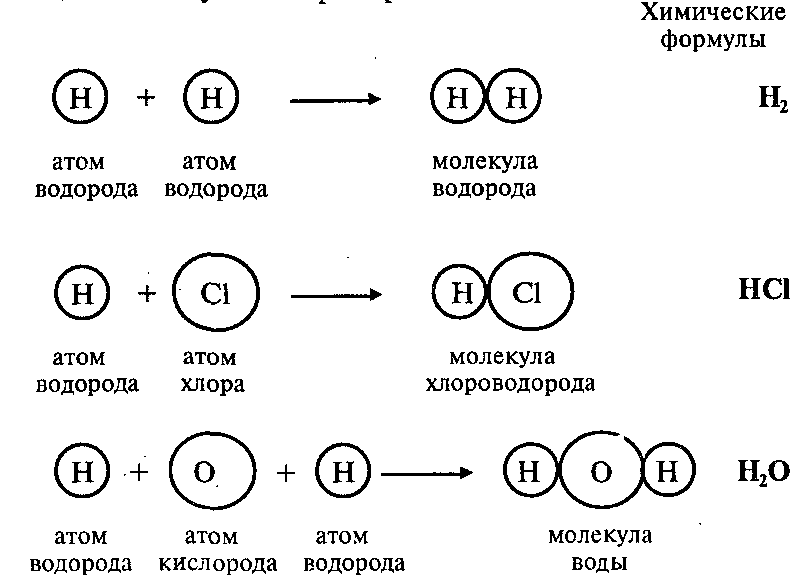
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.