что лучше тербинафин или нафтодерил
Антимикотические средства для лечения онихомикозов
В последнее время отмечается значительный рост грибковых заболеваний среди населения планеты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Наиболее часто встречают кератомикозы, которые поражают только роговой слой кожи; дерматомикозызатрагивают гладкую кожу, эпидермис и ее придатки: волосы, ногти.
В зависимости от вида патогенного гриба и локализации патологического процесса различают:
При заболеваниях, вызванных различными видами патогенных или условно-патогенных грибов, применяютпротивогрибковые лекарственные средства. В зависимости от локализации патогенных грибов противогрибковые лекарственные средства классифицируют на средства для лечения:
Химическая классификация подразделяет противогрибковые лекарственные средства на:
¤ антибиотики:
¤ синтетические ЛС:
Вероятность восприимчивости инфекции увеличивается с возрастом, особенно у пожилых людей старше 65 лет, что обусловлено наличием таких хронических заболеваний, как вегетососудистая патология, сахарный диабет, нарушения периферического кровообращения, остеоартропатии стоп и др. Рост распространенности онихомикоза может быть связан также с нарушениями иммунитета или с изменениями в ногтевых пластинках.
Лечение онихомикозов осуществляется строго по определенной схеме длительный период времени — от 2 до 4 месяцев. В терапии применяются антимикотики, которые обладают фунгистатическим и фунгицидным действием и оказывают влияние на различные этапы жизнедеятельности и метаболизма возбудителей. Различают три основных механизма антимикотического действия противогрибковых препаратов, которые проявляют свою активность в результате:
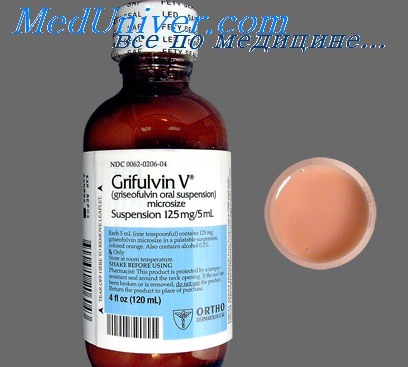
Гризеофульвин (Griseofulvinum) табл. 125 мг — антибиотик, продуцируемый плесневым грибом Penicillium nigricans (griseofulvum), был выделен в 1939 г. и по своей структуре является спиропроизводным бензофурана. Препаратобладает фунгистатическими свойствами в отношении всех видов грибов — трихофитов и эпидермофитов. Механизм фунгистатического действия основан на способности препарата ингибировать клеточное деление нитчатых грибов в метафазе, вызывая характерные морфологические изменения (скручивание, усиление ветвления и искривление гифов), нарушая структуру митотического веретена и синтез клеточной стенки. В незначительной степени препарат тормозит синтез и полимеризацию нуклеиновых кислот. Антибактериальной активностью препарат не обладает.
Для создания достаточной концентрации препарата в коже необходимо длительное лечение — 2–3 месяца min. Только на новых, отросших ногтях будут заметны первые симптомы эффективности лечения.
Важно! К побочным явлениям при приеме препарата относятся: диспепсические расстройства, головокружение, иногда бессонница, аллергические реакции, лейкопения. Гризеофульвин противопоказан при угнетении кроветворения, недостаточности печени, почек, а также грудным детям и беременным женщинам. Не следует назначать препарат водителям транспорта, лицам, занятых на высотных работах или требующих повышенного внимания, быстрых психических и двигательных реакций. Следует предупредить больных о развитии возможной перекрестной чувствительности к пенициллину и об усилении действия алкоголя.
Кетоконазол (Ketoconazole) — ТН «Низорал», «Ливарол», «Микозорал» — активный препарат широкого спектра действия из группы имидазола, обладающий фунгицидной и фунгистатической активностью; эффективен при приеме внутрь при системных и поверхностных микозах, дерматомикозах и кандидамикозах. Назначается врачом для лечения и профилактики грибковых инфекций кожи, волос, ногтей, половых органов, вызванных чувствительными к препарату возбудителями.
При введении внутрь препарат хорошо всасывается, растворяется и абсорбируется в кислой среде.
Важно! Препарат неплохо переносится пациентами, но может вызывать диспепсические явления (тошнота, рвота, диарея), очень редко возникают аллергические реакции в виде крапивницы и кожной сыпи, головная боль, головокружение, гинекомастия, импотенция. При одновременном применении препарата с другими лекарственными средствами (фентанил, тамсулозин, карбомазепин, сальметерол и др.) может происходить увеличение концентрации последних с увеличением побочных эффектов.
Противопоказан при тяжелых нарушениях печени, почек, беременности, во время грудного вскармливания и повышенной чувствительности к препарату.
Кетоконазол выпускается в табл. 200 мг, суппозит. 400 мг; 2% мазь, 15 мг; крем 20 мг/г — 15 г. Применяется в виде шампуней: «Кетоназол» 2% (75 и 150 мл), «Низорал» (25 и 60 мл), «Перхотал», «Себозол». Продолжительность лечения определяют индивидуально.
Итраконазол (Itraconazolum) капс. 100 мг; р-р 10 мг/мл — фл. 150 мл, — ТН «Орунгал», «Румикоз» — препарат обладает широким спектром действия, селективно и специфически ингибируют фермент, который катализирует синтез грибковых стеролов. Область применения: различные инфекции, вызванные дерматофитами и/или дрожжевыми и плесневыми грибами, такими как кандидозы слизистых оболочек (в т.ч. влагалища), микозы кожи, онихомикозы, эпидермомикозы, грибковые поражения глаз (кератит), брюшины и др. локализаций. Прием Итраконазола в капсулах сразу после еды увеличивает его биодоступность; максимальная концентрация в плазме крови достигается в течение 3–4 час. после приема внутрь. Препарат хорошо распределяется в тканях, которые подвержены грибковым поражениям.
Важно! При применении препарата могут наблюдаться побочные эффекты со стороны пищеварительной системы: диспепсия (тошнота, рвота, диарея, запор, снижение аппетита), боль в животе, нарушение вкусового восприятия; головная боль, головокружение, аллергические реакции, алопеция, со стороны органов кроветворения (нечасто) — лейкопения, тромбоцитопения. Применение противопоказано при повышенной чувствительности к итраконазолу и любому из компонентов препарата, детский возраст до 3 лет, беременность и период лактации.
Для оптимальной абсорбции препарата необходимо принимать капсулы не разжевывая, сразу после еды, глотать целиком. Один курс пульс–терапии онихомикозов заключается в ежедневном приеме по 2 капс. препарата два раза в сутки в течение одной недели. Для лечения грибковых поражений ногтевых пластинок кистей рекомендуется два курса. Для лечения грибковых поражений ногтевых пластинок стоп рекомендуется три курса. Промежуток между курсами, в течение которого не нужно принимать препарат, составляет 3 недели.
Тербинафин (Terbinafine) — ТН «Ламизил», «Экзифин», «Фунготербин», «Тербизил» — выпускается в форме: табл. 250 мг; 1% мазь 15,0 г; 1% крем — 10, 15, 30 г туба; 1% спрей, 20 мл. Препарат относят к аллиламинам и назначают для системного и наружного применения. Механизм действия Тербинафина связан с торможением начального этапа биосинтеза эргостерина (основного клеточного стерина мембраны грибов) путем ингибирования специфического фермента сквален-2,3-эпоксидазы на мембране грибов. Эффективен препарат в отношении многих грибов, патогенных для человека. При местном лечении Тербинафин более эффективен, чем азольные препараты производные имидазола, но сопоставим с итраконазолом, а при применении внутрь более эффективен, чем гризеофульвин и итраконазол. Тербинафин характеризуется липоидофильностью, быстро диффундирует в роговой слой эпидермиса, дерму, подкожную клетчатку, накапливается в сальных железах, волосяных фолликулах и ногтевых пластинах в концентрациях, обеспечивающих фунгицидный эффект. 1 табл. тербинафина один раз в день приводит к более высокой степени излечения и к лучшим результатам по каждому критерию эффективности (в т.ч. микологическое излечение), нежели прерывистая терапия интраконазолом.
Нафтифин (Naftifine) крем 1% — 15, 30 г; 1% р-р 10, 20, 30 мл, — ТН «Экзодерил», «Микодерил» — производное аллиламинов. Механизм действия связан с угнетением активности фермента сквален-2,3-эпоксидазы, ингибированием биосинтеза эргостеролов, что приводит к нарушению синтеза клеточной стенки. Нафтифин обладает широким спектром действия, действуя фунгицидно по отношению к дерматофитам (таких как Trichophyton, Epidermophyton, Microsporum), плесени (Aspergillus spp.), дрожжеподобным грибам (Candida spp., Pityrosporum) и другим грибам, например, возбудителям споротрихоза (Sporothrix schenckii). Препарат оказывает противовоспалительное действие, уменьшает зуд. При наружном применении хорошо проникает в кожу, создавая устойчивые противогрибковые концентрации в различных ее слоях.
Длительность лечения Нафтифином варьируется от 2 недель до 6 месяцев. При применении препарата может наблюдаться сухость и покраснение кожи, чувство жжения, все эти побочные эффекты носят обратимый характер и не требуют отмены.
Аморолфин (Amorolfine) лак д/ногтей 5% — 2,5 и 5 мл, — ТН «Лоцерил», «Онихелп», «Офломил» — препарат для наружного применения, обладает широким спектром действия, оказывая фунгистатическое и фунгицидное действие, обусловленное повреждением цитоплазматической мембраны гриба путем нарушения биосинтеза стеролов, за счет ингибирования ферментов 14–гамма–деметилазы и 7–гамма–изомеразы. Препарат активен в отношении как наиболее распространенных, так и редких возбудителей грибковых поражений ногтей дерматофитов: Trichophyton spp., Microsporum spp., Epidermophyton spp.; плесневых грибов: Alternaria spp., Scopulariopsis spp., Нendersonula sppi.; грибов из семейства Dematiaceae: Cladopsorium spp., Fonsecaea spp., Wangiella spp.; диморфных грибов Coccidioides spp., Histoplasma spp., Sporothrix spp.
При нанесении на ногти препарат проникает в ногтевую пластинку и далее в ногтевое ложе, практически полностью в течение первых 24 час. Эффективная концентрация сохраняется в пораженной ногтевой пластинке в течение 7–10 дн. уже после первой аппликации. Системная абсорбция незначительна. Применяется наружно. Препарат наносят на поврежденные ногти пальцев рук или ног 1–2 раза в неделю. Длительность лечения определяется индивидуально и зависит от показаний к применению. Побочные эффекты возникают редко и проявляются в виде зуда, жжения в месте нанесения. Не назначается детям младшего и грудного возраста.
Ундециленовая кислота и ее соли —противогрибковые препараты для наружного применения, которые обладают фунгистатическим и фунгицидным действием в отношении дерматофитов, при сочетании с цинковой или медными солями — ундециленат цинка или ундециленат меди — активность действия повышается. Цинк, входящий в состав препарата, оказывает вяжущее действие, снижает проявления признаков раздражения кожных покровов и способствует более быстрому заживлению.
Препараты наносят на чистую, сухую поверхность пораженной кожи 2 раза в сутки (утром и вечером). Продолжительность курса лечения — 4–6 недель и зависит от характера, эффективности и течения заболевания. После исчезновения клинических признаков заболевания продолжают применять 1 раз в день. В профилактических целях — 2 раза в неделю.
Важно! Противопоказанием к применению препарата служит повышенная чувствительность к ундециленовой кислоте и ее производным.
Циклопирокс (Ciclopirox) лак д/ногтей 8%, фл. 3 г, — ТН «Батрафен» — противогрибковый препарат широкого спектра действия, ингибирует захват прекурсоров синтеза макромолекул в клеточной мембране. Применяют наружно для лечения и профилактики грибковых инфекций кожи, слизистых оболочек, ногтей, грибковых вагинитов и вульвовагинитов.
Препарат наносят 1–2 раза в день на пораженный ноготь, длительность применения зависит от тяжести поражения, но не должна превышать 6 месяцев.
Лечение онихомикозов должно проходить под строгим наблюдением врача–дерматолога. Как правило, применяют рациональную этиотропную комплексную терапию. Уменьшение или исчезновение клинических симптомов обычно наблюдается через несколько дней после приема антимикотика. Однако во избежание рецидивов заболевания курс лечения следует провести полностью. На фоне клинического излечения нередко проводят противорецидивную терапию, направленную на предупреждение повторного заражения.
Что лучше тербинафин или нафтодерил
Нафтифин представляет собой аллиламиновое производное нафталина. Нафтифин применяют местно. Он ингибирует фермент скваленэпоксидазу и снижает синтез эргостерола.
Тербинафин — первый аллиламин, активный при пероральном применении. Он предотвращает синтез эргостерола, ингибируя скваленэпоксидазу, вследствие чего происходит накопление сквалена, приводящее к разрыву мембраны и гибели клеток.
Тербинафин хорошо абсорбируется и накапливается в дермисе, эпидермисе и жировой ткани благодаря своей липофильности. Он секретируется в кожное сало и обнаруживается в роговом слое через несколько часов после перорального приема. Тербинафин диффундирует также из ногтевого ложа, проникая в дистальную часть ногтей в течение 4 нед. Лекарство метаболизируется в печени, а его неактивные метаболиты экскретируются с мочой. Антибиотик эффективен главным образом против дерматофитов. При клинических испытаниях обнаружены впечатляющие клинический и микологический эффекты, а также снижение частоты рецидивов.
Тербинафин пациенты переносят хорошо. Но могут появиться тошнота, боли в животе и кожные аллергические реакции, однако они выражены умеренно. Есть сообщения об утрате вкусовых ощущений. Концентрация тербинафина повышается при одновременном применении циметидина и снижается в случае комбинации с рифампицином.
Гризеофульвин
Абсорбция варьирует в зависимости от используемого препарата, но лучше абсорбируются препараты, состоящие из микрочастиц. Пик наблюдается через 1-3 час после приема внутрь. Концентрация в сыворотке снижается через 30 час. Лекарство накапливается в активно метаболизирующих клетках кожи и быстро поступает в полностью кератинизированные клетки, достигая самых наружных клеток в течение 8 час, однако предполагается, что с кератином оно прочно не связывается. Поскольку гризеофульвин транспортируется в роговой слой вместе с потом, избыточное потоотделение может послужить причиной быстрого выведения антибиотика из кожи. Гризеофульвин метаболизируется в печени, превращаясь в 6-диметилгризеофульвин, который экскретируется почками, возможно, с желчью.
Гризеофульвин в значительной степени вытеснен азолами из практики лечения взрослых лиц, но он остается средством выбора для терапии инфекций, вызванных дерматофитами, у детей (10 мг/кг, разделенных на 2 дозы). Схемы лечения рассчитаны на длительный срок, поскольку антибиотик оказывает фунгистатический, а не фунгицидный эффект. Высока частота продолжительных рецидивов (40-70% при инфекциях ногтей пальцев ног).
Побочные эффекты возникают нечасто, однако хорошо известны лихорадка, кожная сыпь, лейкопения и явления, сходные с сывороточной болезнью. Обычным побочным эффектом является головная боль, а раздражительность и ночные кошмары могут стать серьезной проблемой, однако такое состояние, как правило, улучшается при продолжении приема препарата. Если же этого не происходит, дозу уменьшают на несколько дней, а затем постепенно увеличивают, перенося лечение главным образом на ночные часы. Гризеофульвин может повысить светочувствительность кожи, проявляющуюся петехиальными высыпаниями и уртикарией; со временем состояние улучшается, несмотря на продолжающееся лечение. У детей описаны гепатотоксичность, периферический неврит, супрессия костного мозга, протеинурия и эстрогеноподобные эффекты. Гризеофульвин тератогенен. В ходе лечения может возникнуть резистентность к антибиотику.
Гризеофульвин взаимодействует с другими лекарствами:
• варфарином, усиливая его метаболизм и снижая таким образом антикоагулирующий эффект;
• фенобарбиталом — при одновременном пероральном применении концентрация гризеофульвина в крови снижается.
Гризеофульвин усиливает порфирию, и есть сообщения, что он вызывает или усиливает системную красную волчанку.
Сравнение непрерывного лечения тербинафином с пульс-терапией итраконазолом при онихомикозах стоп
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Для системной терапии онихомикозов в настоящее время используют тербинафин (Ламизил) из группы аллиламинов, обладающий фунгицидным действием, и итраконазол (Орунгал), относящийся к триазолам и оказывающий фунгистатический эффект. Лечение тербинафином обычно проводят непрерывно в течение 12 нед, итраконазол применяют непрерывно (в те же сроки) или в течение 1 нед каждого месяца на протяжении 3–4 мес (пульс-терапия), причем пульс-терапию ряд авторов считают столь же эффективной, как и непрерывное лечение итраконазолом или тербинафином. В проспективном многоцентровом двойном слепом рандомизированном исследовании изучена эффективность и безопасность непрерывного лечения тербинафином в сравнении с пульс-терапией итраконазолом у больных онихомикозами стоп. В исследовании, проводившемся в течение 72 нед, принимали участие 35 центров 6 стран Европы. Группу изучения составили 496 больных в возрасте от 18 до 75 лет с наличием клинически и микологически подтвержденного онихомикоза стоп, вызванного дерматофитами. Больные были рандомизированы в 4 параллельные группы и получали лечение тербинафином 250 мг/сут в течение 12 (группа Т12) или 16 нед (Т16) или итраконазолом 400 мг/сут (4 капсулы по 100 мг) в течение 1 нед каждого месяца на протяжении 3 или 4 месяцев (группы И3 и И4).
Первичным критерием эффективности являлась частота микологического излечения, определяемого на основании отрицательных результатов микроскопических и культуральных исследований материала, взятого из целевых пораженных ногтей (ногтя большого пальца стопы). Частота микологического излечения оценивалась через 72 нед наблюдения. Вторичными критериями эффективности служили частота клинического излечения (100% очищение ногтя), частота полного излечения (микологического и клинического), клиническая эффективность (микологическое излечение, отрастание не менее 5 мм нового ногтя, не пораженного микозом) и общая оценка, которую давали врач и больной.
Возбудителями являлись: Trychophyton rubrum (89,3%), Т.mentagrophytes (8,5%), T.rubrum + недерматофитные плесени (1,6%), T.rubrum + Т.mentagrophytes (0,6%).
Частота микологического излечения через 72 недели составила: 75,7% и 80,8% в группах Т12 и Т16, 38,3% и 49,1% в группах И3 и И4 (см. рис.). Частота клинического излечения при любом из режимов лечения тербинафином была достоверно выше по сравнению с пульс-терапией итраконазолом (р Рис. Частота микологического излечения (в %)
Дженерики тербинафина в России: взгляд практического миколога
Ключевые слова: оригинальные лекарственные средства, дженерики, тербинафин, Экзифин.
TERBINAFINE GENERICS IN RUSSIA: A PRACTICAL MYCOLOGIST’S OPINION
E.I. Kasikhina, N.V. Savchenko
Russian Medical Academy of Postgraduate Education, Ministry of Health and Social Development of the Russian Federation, Medico-C Medical Center, Moscow
Key words: original drugs, generics, terbinafine, Exifine.
В настоящее время фармацевтический рынок предлагает большой выбор антимикотиков. В этом изобилии нелегко разобраться даже специалисту-микологу при условии, что вся информация достойна доверия и действительно имела место в практике. Одной из частых и нередко болезненных задач, стоящих перед врачом, является выбор между оригинальным лекарственным средством и воспроизведенным препаратом (дженериком). Дженерик — лекарственный продукт, обладающий доказанной терапевтической взаимозаменяемостью с оригинальным инновационным лекарственным средством аналогичного состава, выпускаемый не разработчиком оригинального препарата и без лицензии разработчика. Облегченные правила регистрации и более низкая цена способствуют распространению дженериков на фармацевтическом рынке. В России объем продаж достигает 80%, в Канаде — 64%, в Японии — 30% [1]. В Испании более 20% препаратов, выписанных врачами разных специальностей, являются дженериками [2]. Список дженериков системных антимикотиков в России ежегодно пополняется и насчитывает десятки наименований. Фактически на отечественном фармакологическом рынке представлены аналоги каждого оригинального системного антимикотика, а перечень наименований наружных форм антимикотиков еще более широк. Сложившаяся ситуация с дженериками характерна не только для России. В странах Центральной и Восточной Европы, Юго-Восточной Азии, Индии и Китае дженерики известных противогрибковых средств — довольно распространенное явление. В США и ряде стран Западной Европы еще сохраняется господствующее положение оригинальных препаратов, но и оно сдает свои позиции [3].
Как правило, регистрация дженериков допускается на основании оценки регистрационного досье сокращенного объема и данных биоэквивалентности Воспроизведенный аналог содержит то же действующее вещество, что и оригинальный препарат, но, как правило, отличается от него вспомогательными веществами. Лекарственные препараты считаются фармацевтически эквивалентными, если содержат одни и те же активные субстанции в одинаковом количестве (допустимое отличие — не более 5%) и в одинаковой лекарственной форме, а также отвечают требованиям одних и тех же сходных стандартов. Согласно положению Всемирноорганизациздравоохранения, «два препарата считают эквивалентными, если они фармацевтически эквивалентны, имеют одинаковую биодоступность и при назначении в одинаковой дозе обеспечивают должную эффективность и безопасность». По определению FDA, фармацевтически эквивалентные лекарственные препараты содержат одинаковые ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и являются идентичными по силе действия или концентрации активных веществ [3, 4].
В микологии данное положение должно относиться к препаратам, используемым как системно, так и наружно, так как не все пациенты микологического профиля могут получать системное лечение. Отсутствие подтверждения терапевтической эквивалентности порождает сомнения в качестве воспроизведенного препарата и может ограничить использование дженериков в ситуациях, когда врач рассчитывает на максимальную надежность и безопасность лекарственного средства. К таким ситуациям относится терапия микозов у детей и пожилых людей с отягощенным соматическим анамнезом (прежде всего эндокринной патологией). Именно в этих возрастных группах вопросы безопасности наиболее значимы, и используемый препарат должен подтвердить свою состоятельность не только в фармакологическом, но и в клиническом аспекте.
Безусловно, на окончательный выбор препарата влияют разные факторы [5]. Во-первых, оценка врачом-микологом клинической ситуации и его клинический опыт. Во-вторых, пациент имеет право на выбор оригинального препарата или дженерика, при этом выбор должен быть информированным. Поскольку информацию должен предоставлять врач, то и он должен ориентироваться на качественные сведения о препаратах. К сожалению, для большинства дженериков противогрибковых препаратов не проводилось всего комплекса исследований, которые легли в основу современных схем используемых оригинальных препаратов. Сведения о результатах исследований, которые производители указывают в информационных материалах, в подавляющем большинстве случаев относятся к оригинальному препарату. Финансовые затруднения пациента или недоступность оригинала по тем или иным причинам служат основанием для назначения дженерика. При этом следует ориентироваться на воспроизведенные аналоги, которые давно существуют на рынке или имеют свою доказательную базу эффективности и безопасности. Например, среди известных дерматологам дженериков тербинафина такой базой владеют Экзифин, термикон, фунготербин. Информация о доказанной фармацевтической эквивалентности препаратов упоминается в немногочисленных отечественных публикациях, посвященных клинической эффективности таких дженериков флуконазола, как микофлюкан и флюкостат. В-третьих, велика роль аптечного звена, нередко выступающего в качестве «первичного звена» дерматологической помощи населению, или «корректора» врачебных назначений.
Итак, фармакокинетическая эквивалентность является главным условием регистрации препарата-дженерика. Биоэквивалентные препараты имеют сходные показатели биодоступности при исследовании в одинаковых экспериментальных условиях. Исследования биоэквивалентности проводят на ограниченном контингенте здоровых добровольцев с помощью рандомизированного перекрестного метода. Данные о биоэквивалентности используемых в других странах дженериков тербинафина оригинальному препарату можно без труда получить из зарубежных научных публикаций [6—8]. В нашей стране мы сталкиваемся в основном с данными сравнительных исследований, оценивающих терапевтическую эквивалентность системных препаратов или дающих фармакоэкономическую оценку антимикотикам [9].
Для определения биоэквивалентности сравнивают так называемую площадь под фармакокинетической кривой (AUC) «концентрация—время». Препарат-дженерик считается биоэквивалентным оригинальному, если 90% средней AUC вещества входит в диапазон от 80 до 125% от средней AUC оригинального препарата [6].
Примером может служить характер фармакокинетических кривых, полученных после приема препаратов Экзифин и ламизил, который в целом сходен, причем индивидуальная вариабельность концентраций тербинафина в обоих случаях примерно одинаковая. Усредненные фармакокинетические профили тербинафина в сыворотке крови больных, принимавших препараты Экзифин и ламизил (рисунок) характеризовались сходными кривыми, причем во всех временных точках различия между соответствующими значениями концентрации не были статистически достоверными. Среднее значение максимальной концентрации тербинафина после приема испытуемого препарата и скорость ее достижения достоверно не отличались от этих параметров препарата сравнения. Площадь под кривой «концентрация-время» (AUC24h) для Экзифина была незначительно меньше, чем для ламизила. Разница в значениях среднего времени удерживания также была незначительной (в среднем 11,6 и 12,2 ч соответственно). Данное исследование биоэквивалентности препаратов Экзифин (дженерик) и ламизил (оригинальный тербинафин) выполнено открытым методом по перекрестной и рандомизированной схеме у больных с онихомикозами, обусловленными T. rubrum. Испытания препаратов проводили в соответствии с программой изучения биоэквивалентности, утвержденной Фармакологическим государственным комитетом МЗ РФ на базе Уральского научно-исследовательского института дерматовенерологии и иммунопатологии Минздрава России [10].
Пример «соответствия» фармакокинетических профилей тербинафина в сыворотке в крови больных, принимавших Экзифин (1) и ламизил (2; нг/мл).
Параметры биодоступности тербинафина после приема препаратов Экзифин и ламизил
Одной из важнейших фармацевтических характеристик препарата является точность его дозирования. Для обеспечения точности (однородности) дозирования и кинетики высвобождения активной субстанции из оральных таблетированных форм желательно применять современные технологии, которые требуют материальных затрат и делают производство экономически невыгодным. Регламентирующие нормы предписывают содержание действующих веществ по однородности дозирования в пределах 85—115% от номинала. Отличия процентного содержания антимикотика и примесей могут отражаться на переносимости препаратов, а также на их клинической эффективности. Как правило, остаются неизвестными показатели распределения дженериков в органах-мишенях, в частности конкретной концентрации дженериков в ногте и продолжительности их сохранения в нем [11]. Не учитываются также сравнительные статистические данные по побочным эффектам и осложнениям при применении оригинальных антимикотиков и их воспроизведенных аналогов. Нельзя сказать, что это способствует исключительно распространению дженериков. Напротив, отсутствие подтверждения терапевтической эквивалентности порождает сомнения в качестве воспроизведенного препарата и может ограничить использование дженериков, когда врач рассчитывает на максимальную надежность и безопасность лекарственного средства. Конечно, требовать от производителей дженериков того же комплекса фармакологических и клинических исследований, который необходим для регистрации оригинального препарата, нельзя. С другой стороны, это обычное явление в странах Европы и Юго-Восточной Азии [6—8, 12]. Во Франции предложен метод спектроскопии для определения терапевтической эквивалентности дженериков топических антимикотиков с целью оценки не только проникающей способности препарата, но и контроля повреждения барьерных слоев эпидермиса [13]. Внедрение дженериков в клиническую практику не может осуществляться без проведения исследований, подтверждающих их реальное, а не номинальное соответствие эффективности и безопасности оргинальному препарату.
В «досье» старейшего в России дженерика тербинафина Экзифина (на отечественном фармакологическом рынке с 1999 г.), практический миколог может найти ответы на многие вопросы. Так, применение Экзифина у пациентов с аллергодерматозами изучали на базе ГНЦ Институт иммунологии ФМБА России, а также на кафедре кожных и венерических болезней Московского государственного медико-стоматологического университета [14, 15]. Полученные данные клинико-лабораторного исследований свидетельствуют об эффективности и безопасности Экзифина в комплексной терапии больных атопическим дерматитом с гиперчувствительностью к грибам рода Malassezia, что выражалось в быстром купировании зуда и положительной динамике индекса SCORAD. Клинические исследования по применению Экзифина при микроспории волосистой части головы проводились на базе Уральского НИИ дерматовенерологии и иммунопатологии, при этом этиологическая эффективность препарата составила 92,9%, побочные эффекты отмечались в 5,4% случаев [16]. На базе НИИ медицинской микологии им. П.Н. Кашкина ГОУ ДПО СПб МАПО изучали эффективность и безопасность Экзифина у больных онихомикозом стоп на фоне соматических заболеваний с нарушением кровообращения в нижних конечностях [17].
Таким образом, клиническая практика расставляет все препараты по своим местам. Это расширяет врачебный выбор, что в значительной степени является «шагом вперед на пути к совершенствованию противогрибковой терапии». Безусловно, воспроизведенные препараты позволяют врачам стремиться лечить всех и хорошо даже в экономически слабых странах, при этом используя самые современные дженерики дорогих оригинальных препаратов. С другой стороны, давление дженериков на рынке является одним из факторов, заставляющих компании производить оригинальные препараты и активнее внедрять новые перспективные разработки.