что лучше сотагексал или бисопролол при аритмии сердца
Что лучше: СотаГЕКСАЛ или Бисопролол
СотаГЕКСАЛ
Бисопролол
Исходя из данных исследований, Сотагексал лучше, чем Бисопролол. Поэтому мы советуем выбрать его.
Но не забывайте, что у данных препаратов в составе разные активные вещества. Поэтому обязательно проконсультируйтесь с врачом. Возможно, какой-то из них может не подойти для вашей терапии.
Сравнение эффективности Сотагексала и Бисопролола
У Сотагексала эффективность больше Бисопролола – это означает, что способность лекарственного вещества оказывать максимально возможное действие разное.
Например, если терапевтический эффект у Сотагексала более выраженный, то у Бисопролола даже в больших дозах добиться данного эффекта невозможно.
Также скорость терапии – показатель быстроты терапевтического действия у Сотагексала и Бисопролола тоже разное, как и биодоступность – количество лекарственного вещества, доходящее до места его действия в организме. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Сотагексала и Бисопролола
Безопасность препарата включает множество факторов.
При этом у Сотагексала она достаточно схожа с Бисопрололом. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Сотагексала, также как и у Бисопролола мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Сотагексала нет никаих рисков при применении, также как и у Бисопролола.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Сотагексала и Бисопролола.
Сравнение противопоказаний Сотагексала и Бисопролола
Исходя из инструкции. Количество противопоказаний у Сотагексала достаточно схоже с Бисопрололом и составляет удовлетворительное количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Сотагексала и Бисопролола может быть нежелательным или недопустимым.
Сравнение привыкания у Сотагексала и Бисопролола
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Сотагексала достаточно схоже со аналогичными значения у Бисопролола. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Сотагексала значения «синдрома отмены» и «резистентности» достотачно малое, впрочем также как и у Бисопролола.
Сравнение побочек Сотагексала и Бисопролола
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Сотагексала состояния нежелательных явлений почти такое же, как и у Бисопролола. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Сотагексала схоже с Бисопрололом: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Сотагексала и Бисопролола
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Сотагексала примерно одинаковое с Бисопрололом. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-13 10:32:36
Эффективность терапии бисопрололом и соталолом у пациентов с пароксизмальной суправентрикулярной тахикардией с учетом регуляторно-адаптивного статуса
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цель исследования: сравнить эффективность терапии бисопрололом или соталолом у пациентов с пароксизмальной суправентрикулярной тахикардией (СВТ) на фоне гипертонической болезни (ГБ) и/или ишемической болезни сердца (ИБС), учитывая их влияние на регуляторно-адаптивный статус (РАС).
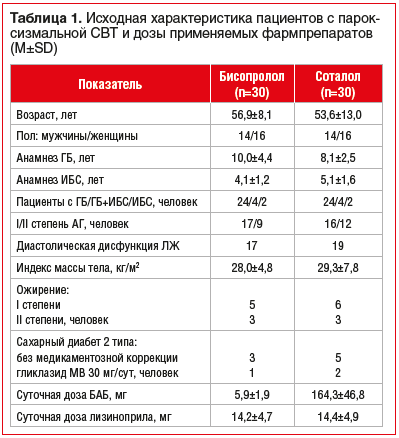
Материал и методы: в исследовании участвовали 60 пациентов с пароксизмальной СВТ на фоне ГБ II–III стадии и/или ИБС, рандомизированных в 2 группы для лечения бисопрололом (5,9±1,9 мг/сут, n=30) или соталолом (164,3±46,8 мг/сут, n=30). В составе комбинированной терапии назначали лизиноприл (14,2±4,7 мг/сут, n=30, и 14,4±4,9 мг/сут, n=30), а при наличии показаний аторвастатин (15,6±5,1 мг/сут, n=16, и 14,2±4,6 мг/сут, n=15) и ацетилсалициловую кислоту (92,3±18,8 мг/сут, n=15, и 94,8±15,8 мг/сут, n=18) или ривароксабан (20 мг/сут, n=3 и n=2) соответственно. Исходно и через 6 мес. терапии проводились: количественная оценка РАС (посредством пробы сердечно-дыхательного синхронизма), эхокардиография, тредмил-тест, тест с шестиминутной ходьбой, суточное мониторирование артериального давления и электрокардиограммы (ЭКГ), субъективная оценка качества жизни (КЖ).
Результаты исследования: обе схемы комбинированной фармакотерапии сопоставимо улучшали структурное и функциональное состояния сердца, повышали толерантность к физической нагрузке, позволяли контролировать артериальную гипертензию, эффективно подавлять пароксизмы СВТ. При этом соталол в меньшей степени снижал РАС и в большей степени улучшал КЖ в сравнении с бисопрололом.
Заключение: у пациентов с пароксизмальной СВТ на фоне ГБ II–III стадии и/или ИБС применение соталола в составе комбинированной терапии может быть предпочтительней ввиду меньшего негативного влияния на РАС в сравнении с бисопрололом.
Ключевые слова: регуляторно-адаптивный статус, пароксизмальная суправентрикулярная тахикардия, бисопролол, соталол, сердечно-дыхательный синхронизм.
Для цитирования: Трегубов В.Г., Нажалкина Н.М., Покровский В.М. Эффективность терапии бисопрололом и соталолом у пациентов с пароксизмальной суправентрикулярной тахикардией с учетом регуляторно-адаптивного статуса. РМЖ. Медицинское обозрение. 2019;3(6):36-40.
1 Kuban State Medical University, Krasnodar
2 Novosibirsk State Regional Clinical Hospital
Aim: to compare a therapy effectiveness with bisoprolol or sotalol in patients with paroxysmal supraventricular tachycardia (SVT) in the setting of hypertensive disease (HD) and/or coronary heart disease (CHD), given their effect on the regulatory adaptive status (RAS).
Patients and Methods: the study involved 60 patients with paroxysmal SVT in the setting of II-III stages HD and/or CHD, randomized into two groups for treatment with bisoprolol (5.9±1.9 mg/day, n=30) or sotalol (164.3±46.8 mg/day, n=30). In the comprehensive therapy, lisinopril was prescribed (14.2±4.7 mg/day, n=30, and 14.4±4.9 mg/day, n=30), and, if indicated, atorvastatin (15.6±5.1 mg/day, n=16 and 14,2±4.6 mg/day, n=15) and acetylsalicylic acid (92.3±18.8 mg/day, n=15 and 94.8±15.8 mg/day, n=18) or rivaroxaban (20 mg/day, n=3 and n=2), respectively. Initially and after 6 months of treatment the following measures were carried out: RAS quantitative eva luation (by means of the cardio-respiratory synchronism test), echocardiography, treadmill test, six-minute walk test, daily blood pressure and electrocardiogram monitoring, life quality subjective measurement.
Results: both comprehensive pharmacotherapy schemes consistently improved the structural and functional heart conditions, increased exercise tolerance, allowed to control arterial hypertension and effectively suppress the SVT paroxysms. At the same time, sotalol reduced RAS to a lesser extent and improved life quality to a greater extent in comparison with bisoprolol.
Conclusion: in patients with paroxysmal SVT in the setting of II–III stages HD and/or CHD, sotalol administration as part of comprehensive therapy may be preferable due to the smaller negative effect on RAS in comparison with bisoprolol.
Keywords: regulatory adaptive status, paroxysmal supraventricular tachycardia, bisoprolol, sotalol, cardiac-respiratory synchronism.
For citation: Tregubov V.G., Nazhalkina N.M., Pokrovsky V.M. Therapy effectiveness with bisoprolol and sotalol in patients with paroxysmal supraventricular tachycardia, taking into account the regulatory adaptive status. RMJ. Medical Review. 2019;6:36–40.
В статье представлены результаты оригинального исследования, посвященного сравнению эффективности терапии бисопрололом или соталолом у пациентов с пароксизмальной суправентрикулярной тахикардией на фоне гипертонической болезни и/или ишемической болезни сердца, учитывая их влияние на регуляторно-адаптивный статус.
Введение
Одной из наиболее частых форм нарушений ритма сердца является пароксизмальная суправентрикулярная тахикардия (СВТ). В общей популяции ее встречаемость достигает 20%, а среди пациентов с гипертонической болезнью (ГБ) и ишемической болезнью сердца (ИБС) значительно более того. Ввиду выраженности клинических проявлений пароксизмальная СВТ занимает ведущее место среди всех сердечных аритмий по частоте обращений за экстренной медицинской помощью. Частые и продолжительные пароксизмы СВТ индуцируют аритмогенную дилатацию миокарда и систолическую хроническую сердечную недостаточность (ХСН) [1], способствуют формированию более сложных нарушений ритма сердца [2], коррелируют с риском развития фибрилляции предсердий, ишемического инсульта и сердечно-сосудистой смерти [3].
Для медикаментозной терапии пароксизмальной СВТ наиболее часто используются β-адреноблокаторы (БАБ) [4]. Обоснованием для их назначения служит блокада симпатоадреналовой системы, часто находящейся в состоянии патологической гиперактивации [5]. Однако у значительной доли пациентов применение БАБ может ограничиваться их побочными эффектами: повышением тонуса бронхов и периферических артерий, снижением физической и умственной работоспособности, эректильной дисфункцией.
Терапия некоторыми БАБ иногда может сопровождаться усугублением уже имеющейся аритмии. Отрицательное хроно-, дромо- и инотропное действие лимитирует назначение БАБ при брадикардиях, атриовентрикулярных блокадах, артериальной гипотензии, тяжелой систолической дисфункции левого желудочка (ЛЖ) [6]. Эти обстоятельства обосновывают выбор препаратов, избирательно устраняющих аритмию и не ухудшающих функциональное состояние организма.
Предполагая возможное разнонаправленное действие БАБ, контроль эффективности медикаментозной терапии следует осуществлять чувствительными методами диагностики, определяющими не только антиаритмические и органопротективные эффекты, но и функциональное состояние организма в целом, его способность к регуляции и адаптации. Для объективной количественной оценки регуляторно-адаптивного статуса (РАС) применяется проба сердечно-дыхательного синхронизма (СДС), отражающая взаимодействие двух важнейших функций вегетативного обеспечения — сердечной и дыхательной. Проба основана на тесной функциональной связи центральных механизмов ритмогенеза сердца и дыхания, возможности произвольного управления ритмом дыхания, участии многоуровневых афферентных и эфферентных структур центральной нервной системы [7].
В литературе нет сведений о контроле влияния БАБ на РАС пациентов с пароксизмальной СВТ. Не исключено, что их внутригрупповая гетерогенность, опосредуя различные клинические и гемодинамические эффекты, оказывает и различное влияние на РАС. Следовательно, выбор оптимальных БАБ, эффективно подавляющих пароксизмы СВТ, положительно действующих как на органы-мишени, так и на РАС, представляется актуальным.
Цель исследования — сравнить эффективность применения бисопролола и соталола у пациентов с пароксизмальной СВТ на фоне ГБ и/или ИБС, учитывая их влияние на РАС.
Материал и методы
В исследовании участвовали 60 пациентов с пароксизмальной СВТ на фоне ГБ II–III стадии и/или ИБС. После рандомизации (методом случайной выборки) пациентов первой группе (n=30) был назначен бисопролол, второй группе (n=30) — соталол. Начальная доза бисопролола составляла 2,5 мг/сут в 1 прием, соталола — 80 мг/сут в 2 приема. Принимая во внимание показатели гемодинамики и индивидуальную переносимость, дозы препаратов титровали с интервалом 2–4 нед. до 10 и 320 мг/сут соответственно (табл. 1).
В составе комбинированной терапии все пациенты получали лизиноприл, а при наличии показаний — аторвастатин 15,6±5,1 мг/сут, n=14, и 14,2±4,6 мг/сут, n=15, и ацетилсалициловую кислоту 92,3±18,8 мг/сут, n=15, и 94,8±15,8 мг/сут, n=18, или ривароксабан 20 мг/сут, n=3 и n=2, соответственно. Приверженность лечению оценивали во время ежемесячных визитов к врачу.
Критерии включения в исследование: возраст пациентов 30–70 лет, наличие пароксизмальной СВТ на фоне ГБ II–III стадии и/или ИБС с сохранной систолической функцией ЛЖ (фракция выброса (ФВ) ЛЖ ≥50%), неупотребление тестируемых препаратов в течение предшествующих 10 дней, ознакомление с протоколом исследования и письменное согласие на участие в нем.
Критерии исключения: зависимость от алкоголя и наркотических веществ, острые сосудистые события (церебральные и коронарные) в течение последнего года, артериальная гипертензия III степени, стенокардия напряжения 3–4 функционального класса (ФК), нарушения сердечного ритма и проводимости, ХСН 3–4 ФК по классификации Нью-Йоркской ассоциации сердца, систолическая дисфункция ЛЖ, кардио- и нейрохирургические вмешательства в анамнезе, дыхательная, почечная и печеночная недостаточность, обострение аутоиммунных заболеваний, злокачественные новообразования, эндокринные расстройства в стадии декомпенсации.
Исследование одобрено этическим комитетом ГБОУ ВО «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (протокол № 34 от 27.02.2015).
В начале исследования и через 6 мес. лекарственной терапии проводились:
количественная оценка РАС с помощью пробы СДС с определением индекса РАС (индекс РАС представляет собой отношение диапазона синхронизации (ДС) к длительности развития СДС на минимальной границе ДС×100) [8]. Оценка индекса РАС: 100 и более — высокий, 99–50 — хороший, 49–25 — удовлетворительный, 24–10 — низкий, 9 и менее — неудовлетворительный [9];
ЭКГ в В- и М-режимах;
тредмил-тест на аппарате SHILLER CARDIOVIT CS 200 (Швейцария) для определения толерантности к физическим нагрузкам и выявления скрытой коронарной недостаточности;
тест с шестиминутной ходьбой (ТШМХ);
суточное мониторирование (СМ) артериального давления (АД) с целью определения суточного профиля АД, а также адекватного контроля эффективности фармакологической терапии;
СМ ЭКГ для выявления пароксизмов СВТ и контроля эффективности проводимой терапии;
оценка качества жизни (КЖ) с использованием опросника «Качество жизни больного с аритмией» [10].
Статистическую обработку проводили методами вариационной статистики при помощи пакета STATISTICA (версия 6.0). Различия считались статистически достоверными при p Литература
Только для зарегистрированных пользователей
Спорные вопросы антиаритмической терапии больных с фибрилляцией предсердий
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Мы движемся дальше. Профессор Дощицин Владимир Леонидович расскажет о спорных вопросах антиаритмической терапии больных с фибрилляцией предсердий.
Владимир Леонидович Дощицин, профессор, доктор медицинских наук:
– Уважаемые коллеги, вопрос лечения, именно антиаритмической терапии фибрилляции предсердий имеет довольно много противоречий.
Начнем с того, что среди всех аритмий фибрилляция предсердий является одной из самых важных. Мало того, что это одна из частых аритмий, и ее распространенность среди лиц пожилого возраста и старческого достигает 10%. Но плюс к этому, это еще и клинически очень значимая аритмия, ухудшающая как правило качество жизни больных и ухудшающая прогноз, то есть относится к потенциально злокачественным аритмиям. Прежде всего, наибольшая ее опасность заключается в том, что способствует развитию тромбоэмболий различных. В основном, это мозговые эмболии, но это могут быть эмболии и почечных, и кишечных сосудов, сосудов нижних конечностей, и даже легочных. Известно, что мерцательная аритмия увеличивает риск тромбоэмболий в 5 раз при неревматических заболеваниях, а при ревматических пороках – в 20 раз.
Очень важный вопрос о классификации этой аритмии. Причем он имеет свои весьма дискутабельные стороны, и в то же время это важный вопрос, потому что классификация, определение формы аритмии влияет на тактику ведения этих больных.
На слайде представлена существующая с 2010-го года классификация Европейского общества кардиологов, которая менялась на протяжении ряда лет из года в год. Один из спорных моментов: как отличить две транзиторные формы аритмии, персистирующую, и пароксизмальную? Сейчас в последние годы по инициативе Европейского кардиологического общества признается основной критерий – это длительность эпизода аритмии: менее 7 суток – это пароксизмальная. Более 7 суток – это персистирующая. В прежние годы, да и сейчас остается вопрос: имеет ли значение возможность спонтанного купирования эпизода? Если эпизод аритмии проходит самостоятельно, то это как бы свойственно пароксизмальной форме. Если он самостоятельно не проходит, то это форма персистирующая (напоминаю, лечатся они по-разному). Согласно последнего варианта классификации, с которым, к сожалению, не все согласны сейчас, не везде, все-таки основной критерий – это временной. Пароксизмальная форма – менее 7 суток. Важно, что в большинстве случаев это менее 48 часов, то есть двух суток, потому что там тактика ведения несколько отличается от более длительных эпизодов. А персистирующая форма – более недели, и неважно, прошла ли она сама или она купирована каким-то способом.
С 2010-го года предложено выделение такой формы – длительно персистирующая форма, которая может длиться много месяцев и даже больше года, но однако допускает тактику устранения аритмии, если удалось повлиять на причину – обычно это тогда бывает. Так вот тогда, если, например, удалось скоррегировать хирургически клапанный порок, то тогда возникает вопрос о возможности восстановления синусового ритма даже при длительных аритмиях, более года. Так вот, такая аритмия все еще может называться персистирующей, а не перманентной. А вот перманентная форма – это такая, когда мы уже не говорим о возможности восстановления ритма и не пытаемся этого сделать, даже если она меньше года длится. То есть практически даже полгода или до одного года, но мы не говорим о возможности восстановления ритма, то мы эту форму аритмии называем перманентной, постоянной.
В принципе, когда мы говорим о возможности воздействия на ритм сердца у больных с аритмией, мы имеем в виду возможность двух подходов, двух стратегий или тактик ведения больных. Первая тактика называется ритм-контроль – восстановление и удержание синусового ритма. Вторая тактика не направлена на восстановление и удержание синусового ритма, а направлена главным образом, на улучшение качества жизни, для чего необходимо, прежде всего, поддержание нормальной частоты сердечных сокращений при наличии аритмии, и, естественно, борьба с тромбоэмболиями при обеих тактиках.
Большое число рандомизированных исследований не дали убедительных доказательств преимущества одной из этих тактик перед другой. Тут очень важный момент, потому что когда мы говорим о необходимости, например, проведении абляции – радиочастотной абляции предсердий, то есть эта тактика непременного удержания синусового ритма. То есть мы должны помнить, что сегодня пока еще нет убедительных доказательств того, что применив эту тактику мы увеличим количество жизней. То есть основная конечная точка – это улучшение прогнозов больных. Вот таких доказательств пока нет, хотя всем совершенно очевидно, что синусовый ритм – это лучше, чем фибрилляция предсердий, что существенно улучшается качество жизни, если удается удержать синусовый ритм, и уже только поэтому это стоит делать, и тем не менее, мы тактику выбираем.
Вашему вниманию предлагаются основные моменты, от которых зависит выбор тактики ведения. Я бы хотел начать с конца, потому что они расположены по возрастающей значимости:
Субъективная переносимость аритмии пациентом. Хочет ли больной восстанавливать синусовый ритм, как он себя чувствует? Ведь в одном случае пациент, грубо говоря, берет врача за горло и требует, чтобы ритм восстановили. А в другом случае, он говорит, что ничего этого не хочет и хочет, чтобы его оставили в покое и не предпринимали никаких активных вмешательств. И этот момент оказывает очень существенное влияние на выбор тактики.
Возможность воздействия на причину аритмии. Например, активный тиреотоксикоз. Если мы не можем воздействовать на этот фактор, то очень маловероятно, что нам удастся эффективно нормализовать и удержать ритм сердца.
Третий момент – риск «нормализационных» тромбоэмболий. То есть возможность тромбоэмболических осложнений при восстановлении синусового ритма. Проще говоря, есть, например, тромбы в предсердии. Если они есть, то мы просто не имеем права пытаться восстановить синусовый ритм, потому что при восстановлении синусового ритма увеличивается риск «нормализационных» тромбоэмболий. То есть мы сначала должны растворить эти тромбы, а потом уже думать о восстановлении синусового ритма.
Следующий момент – какой ценой можно восстановить и удержать ритм. В одном случае, для этого достаточно таблетки в кармане. В другом случае – приходится делать электроимпульсную терапию, давать длительную и больших дозах медикаментозную терапию, и так далее. То есть приходится решать вопрос, что хуже: аритмия или ее лечение.
Выраженность органических изменений сердца, выраженность явлений сердечной недостаточности, и так далее.
Все эти моменты, которые мы оцениваем, выбирая тактику ведения больного с аритмией. Но тем не менее мы помним, что синусовый ритм – это лучше, чем аритмия. И если есть возможность, то надо восстанавливать синусовый ритм. Какие есть возможности?
Современные рекомендации Европейского общества кардиологов, какие препараты рекомендуются в первую очередь для восстановления синусового ритма. Обратите внимание, это европейские рекомендации – тут из пяти названных препаратов, трех у нас нет, они не зарегистрированы в нашей стране, хотя они названы и переведены, и даны эти рекомендации. Но вот Вернакалант – да, эффективный препарат, хорошо купирует аритмию, но пока еще у нас не зарегистрирован, будет или нет и когда будет – неизвестно. Ибутилид – тоже давно существует, но мы им не располагаем в широкой практике, так же как и Флекаинид. Из названных в рекомендациях препаратов значатся только два – это Амиодарон, (Кордарон) и Пропафенон (Пропанорм). Причем, Амиодарон, в основном, применяется внутривенно. Пероральный Амиодарон менее удобен, скажем так, и менее эффективен, чем внутривенный. А Пропафенон пока еще внутривенная форма не доступна, и, в основном, применяется внутрь.
Вот реально, что мы имеем у нас в стране. Доказана эффективность, так сказать, препаратов первого ряда – это Пропанорм и Кордарон. Существуют еще более старые препараты, но они менее эффективны и более токсичны – это Новокаинамид и Хинидин. И третьи – это те препараты, которые доказаны, что они малоэффективны. Они используются, но не для этой цели, не для купирования – это Дигоксин и Соталол.
Надо сказать, что если сравнивать препараты III класса ( Кордарон) и I класса (Флекаинид, Амиодарон), то согласно данным рандомизированных исследований (здесь представлен метаанализ 9 исследований) по сравнительной эффективности Кордарона и Пропанорма, и Пропафенон, Флекаинид. (Пропафенон, Флекаинид красным обозначен). Оказывается, что согласно данным этих исследований препараты IС класса оказываются более эффективны, чем препарат III класса Кордарон.
За рубежом очень широко распространена эта тактика, «таблетка в кармане». У нас врачи менее охотно ее используют, может быть потому, что об этом как-то меньше говорят. И врачу, например, по скорой помощи неудобно давать пероральную таблетку – некогда ждать. Также как и между прочим врачу скорой помощи некогда ждать, пока подействует таблетка в течение нескольких часов – гораздо проще ввести препарат, имеющийся в наличии внутривенно. А из имеющихся в наличии у нас есть только Новокаинамид и Кордарон. Но тем не менее если в стационаре подобран Пропанорм, например, или другой препарат, который купирует пароксизм перорально, то больному, это, конечно, выгоднее, если его научат купировать пароксизмы в домашних условиях. Для этого существует основная схема. Справа: однократный прием трех или четырех таблеток Пропанорма. Эффективность этого способа применения, которая оценивается в течение 4-6 часов, составляет более 80% по данным итальянских авторов.
Но есть еще такая ситуация, когда мы по какой-то причине опасаемся сразу давать такую большую дозу: 450-600 миллиграмм и даем сначала маленькую дозу. Здесь написано: первый прием 300 миллиграмм, то есть 2 таблетки. И если это не поможет, то через час еще одна таблетка. Я должен здесь заметить, что безопаснее сначала дать пробную дозу: не две таблетки, а одну. То есть поменять местами – первый прием 150, это как бы пробный прием. Эта доза редко купирует ритм, но это проверка на переносимость. И если больной хорошо переносит, то тогда через час и можно дать 300 миллиграмм. А уже подействует (в сумме будет 450 миллиграмм), и если не поможет, то следующий прием через несколько часов может быть еще 150 миллиграмм, то есть будет 600 миллиграмм. Эффективность такой схемы достигает 60%.
Спорные вопросы тактики профилактической терапии. Профилактика рецидивов фибрилляции предсердий – тоже очень больной вопрос. Вот европейские рекомендации, которые, собственно, в настоящее время действуют. 5 препаратов названы: Амиодарон, Пропафенон, Соталол – это то, что имеется у нас; и Флекаинид, которого у нас пока нет. Также Дронедарон, который был, но сейчас по ряду причин его применение свернуто, заторможено, не рекомендовано, то есть по меньшей мере требует дальнейшего изучения, можно его применять или нет. У нас реально есть три: Кордарон, Пропафенон (Пропанорм) и Соталекс. Слева показаны три препарата, которые доказаны многочисленными международными рандомизированными исследованиями. Но есть еще менее изученные препараты, которые у нас достаточно широко применяются – это Этацизин, Аллапинин. Дизопирамид раньше применялся, сейчас из-за его токсических свойств он применяется очень мало.
Как ни странно более всего применяется на сегодняшний день Кордарон, так как он относится все-таки к наиболее эффективным препаратам. Но тем не менее он является и наиболее токсичным. То есть у него наибольшая частота нежелательных эффектов. Причем, в основном, нас беспокоят органотосичные эффекты: поражение щитовидной железы, поражение легких, печени, а кроме того – это фотодерматоз, кератопатия, расстройства со стороны желудочно-кишечного тракта, удлинение интервала QT и проаритмогенное действие, связанное с этим. То есть общая частота побочных действий при длительном приеме Кордарона превышает 33%, то есть у каждого третьего.
В связи с этим надо отметить, что препараты I класса меньше дают частоту побочных эффектов, но их использовать опасаются, основываясь на результатах CAST-1 и CAST-2, согласно которым острый период инфаркта миокарда и наличие сердечной недостаточности являются противопоказаниями для применения препаратов этого класса. Эти исследования вызывали большую озабоченность и опасение применять эффективные и малотоксичные препараты I класса для лечения больных, профилактики фибрилляции предсердий у больных с органическими изменениями сердца.
Надо сказать, что ретроспективный метаанализ этих же, и других исследований показал, что если, например, к препаратам первого класса добавляются бета-блокаторы, то вероятность побочных эффектов существенно уменьшается, то есть вероятность проаритмогенного эффекта. Если желудочковые аритмии и фибрилляция предсердий подавляются малыми дозами препаратов первого класса, то это тоже улучшает прогноз, увеличивает шансы больного на выживание. В связи с этим возникает вопрос. Существует такое положение, что антиаритмики IС класса рекомендуются, в основном, больным без выраженной органики, но при этом важно подчеркнуть, что понимается под этой «выраженной органикой»? Прежде всего, это наличие клинически выраженных признаков сердечной недостаточности со сниженной фракцией выброса, острая форма ишемической болезни сердца, в первую очередь, острый инфаркт, и выраженная гипертрофия левого желудочка.
Если ничего этого нет, то мы имеем право назначить больному для профилактики, например, рецидивов аритмии препарат IС класса. И в качестве доказательства этого положения мне хотелось бы представить результаты крупного научного исследования ПРОСТОР, которое у нас в стране было сделано с несколькими большими центрами: в Москве, Московской области, Новосибирске, Иркутске, Рязани, Нижнем Новгороде, и других. В настоящее время более 300 больных включено в это исследование и продолжительность исследования, общая, превышает один год. Согласно результатам этого исследования эффективность препарата Пропанорм по сравнению с Кордароном оказывается вполне сопоставимой, то есть статистически не значимая разница. А вот переносимость у Пропафенона значительно лучше, чем у Кордарона: число вынужденной отмены 2 против 25 – существенная очень разница.
Выводы поэтому исследованию: токсичность Пропанорма значительно меньше, чем у Амиодарона, эффективность примерно сопоставима. И препарат IС класса Пропафенон вполне может быть использован для профилактики аритмии у больных с артериальной гипертонией, и с ишемической болезнью сердца в хронической форме вместе с бета-блокаторами, если нет прямых явных противопоказаний к назначению препаратов этого класса.
Надо сказать, что среди препаратов I класса, если сравнивать Пропафенон, Пропанорм, Аллапинин, Этацизин, то Пропанорм имеет значительно более высокий уровень доказательств, а также имеет преимущество и по переносимости, и по частоте побочных эффектов, и по стоимости, и по доказательной базе.
Наконец, для профилактики рецидивов важно применение так называемой, «upstream»-терапии, то есть терапии, направленной на истоки заболевания, на патогенез: на лечение артериальной гипертонии, ишемической болезни сердца, сердечной недостаточности, атеросклероза. Здесь доказано, что использование бета-адреноблокаторов, блокаторов кальциевых каналов (в основном, группы варипомела) и ингибиторов ангиотензин превращающего фермента оказывают сами по себе антиаритмическое действие, существенно усиливая антиаритмическую терапию основными препаратами.
Вот эта правая группа, менее изученная – антагонисты рецепторов ангиотензина, статины и Омега 3, полиненасыщенные жирные кислоты тоже имеют определенную базу как дополнение к существующей антиаритмической терапии.