что лучше немозол или вермокс при аскаридозе
Аскаридоз: чужие внутри
Жизнь аскарид в теле человека напоминает фильм ужасов — Марина Поздеева детально разобрала патогенез, диагностику и лечение этого распространенного гельминтоза
Ежегодно в РФ регистрируется свыше 40 тысяч больных аскаридозом. В сельских и городских районах уровень заболеваемости различен. На долю городских жителей приходится 68 % случаев заражения аскаридами, а сельских — 32 % (письмо Роспотребнадзора 2014 года [1]). Согласно мировой статистике, около 0,8 миллиарда человек каждый год заболевают аскаридозом, подавляющее число инфицированных составляют дети [2].
Биология аскарид
Основной возбудитель аскаридоза, аскарида человеческая (Ascaris lumbricoides), — крупная нематода. Белые или желтые взрослые черви достигают в длину 15–35 см. В организме человека они живут 10–24 месяца в тощей и подвздошной кишке. Ежедневно самка откладывает около 240 000 яиц, которые оплодотворяют близлежащие самцы. Среди зараженных 45 % людей — носители оплодотворенных яиц, у 40 % оплодотворяется только часть яиц и у 20 % все яйца остаются неоплодотворенными [3].
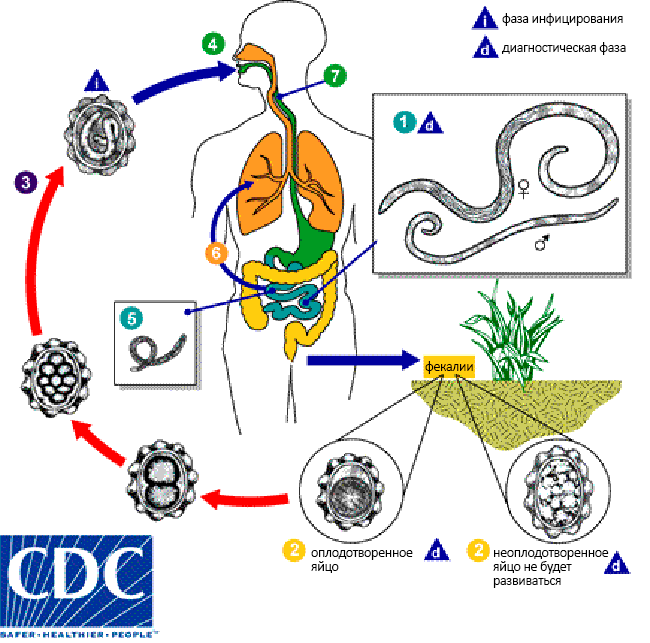
Оплодотворенные яйца вместе с калом попадают в почву, и уже спустя 5–10 дней становятся заразными. Примерно через месяц после оплодотворения в яйцах аскарид образуются личинки. Яйца аскарид в почве могут сохранять жизнеспособность на протяжении 10 лет и более [4]. Такая устойчивость объясняется наличием вокруг яиц липидного слоя, который защищает от неблагоприятных условий окружающей среды и действия химических веществ, в том числе кислот и щелочей.
Патогенез аскаридоза
Классические симптомы синдрома Леффлера — лихорадка, свистящее дыхание, одышка, непродуктивный кашель и кровохарканье, при повторном рентгенологическом исследовании органов грудной клетки — характерные мигрирующие инфильтраты в легких.
В альвеолах личинки аскарид развиваются в течение трех недель. За это время они проникают в бронхолегочный секрет, а после откашливания и последующего проглатывания в конечном счете попадают в тонкий кишечник. Там они созревают и примерно через 65 дней становятся половозрелыми.
Человеческие аскариды склонны к миграции и поиску небольших отверстий. При тяжелой инвазии нематоды достигают двенадцатиперстной кишки, а оттуда могут проникнуть в желчные протоки и даже желчный пузырь или протоки поджелудочной железы.
Взрослые аскариды питаются продуктами пищеварения хозяина. Из-за солидного аппетита аскарид инфицированные дети часто испытывают недостаточность в белках, калориях и витамине А, вследствие чего могут отставать в росте и иметь повышенную восприимчивость к инфекционным заболеваниям.
Еще один представитель рода аскарид, свиная аскарида (Ascaris lumbricoides suum), несет ответственность за зоонозные инфекции. Внешне дифференцировать гельминта человеческой и свиной аскариды трудно — отличие между ними состоит лишь в последовательности генома. Аскаридоз, вызванный инвазией свиной аскариды, в большинстве случаев встречается в развитых странах с высоким уровнем санитарии (Германии, США, Великобритании [5]), в то время как инфицирование человеческими аскаридами чаще регистрируется в районах с неблагоприятной санитарной обстановкой. Заражение Ascaris lumbricoides suum, как правило, сопровождается кашлем, острой эозинофилией и/или эозинофильными инфильтратами в печени, визуализируемыми на КТ.
Вероятность развития перекрестной инфекции Ascaris lumbricoides suum невысока [6].
Симптомы аскаридоза
Дальнейшая клиническая картина зависит от многих факторов, в том числе возраста больного, локализации червей, диаметра просвета кишечника и других.
Обструкция кишечника
У детей аскариды чаще всего локализуются в кишечнике. Эту тенденцию связывают с небольшими размерами билиарной системы в детском возрасте [8]. Вздутие живота — неспецифический признак аскаридоза — регулярно встречается у детей. Наиболее тяжелое осложнение аскаридоза у детей — кишечная непроходимость, чаще всего на уровне подвздошной кишки. Частичная или полная кишечная непроходимость, вызванная обструкцией кишечника взрослыми аскаридами, сопровождается тошнотой, рвотой, лихорадкой, болью в животе. По статистике, в год у двух из 1000 инфицированных аскаридами детей развивается обструкция кишечника [9]. В тяжелых случаях возможен летальный исход.
Другие серьезные осложнения аскаридоза — воспаление кишечника, ишемия и фиброз тканей вследствие действия токсинов, выделяемых живыми или погибающими аскаридами.
При тяжелом аскаридозе масса паразитов может перфорировать стенку кишечника, что приводит к внутреннему кровотечению и перитониту, или заполнять аппендикс, способствуя развитию аппендицита.
Обструкция билиарного тракта
При обструкции желчных путей могут развиваться холангит, желтуха, острый панкреатит и даже абсцесс печени. Однако исследования свидетельствуют, что при билиарной локализации аскарид, как правило, наблюдается спонтанное и бессимптомное прохождение червей через желчные протоки (в 72,1 % случаев) [7].
Чувствительность брюшной стенки, особенно в правом верхнем, правом нижнем квадранте и эпигастрии, может свидетельствовать об осложнениях аскаридоза, в частности обструкции желчевыводящих путей, кишечника, аппендиците и др.
Лабораторные исследования
Анализ кала в подавляющем большинстве случаев позволяет выявить яйца аскарид. Если со дня инфицирования прошло менее 40 дней, анализ кала может дать ложноотрицательные результаты.
Во время фазы миграции личинки аскарид можно наблюдать при микроскопии мокроты. Кроме того, в этот период резко повышается число эозинофилов в крови, что легко позволяет определить аскаридоз по общему анализу крови (ОАК).
Инструментальная диагностика аскаридоза
Во время фазы миграции на рентгенограмме легких визуализируются очаги незначительного помутнения. Рентгенография органов ЖКТ позволяет четко увидеть локализацию взрослых аскарид в кишечнике и определить степень обструкции.
Выявить аскарид в желчных протоках или желчном пузыре помогают УЗИ или КТ. В последние годы в западной практике для диагностики аскаридоза и удаления червей из желчных путей используют эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ).
Серологические исследования
У больных аскаридозом вырабатываются антитела к антигенам Ascaris lumbricoides, однако выявление антител не представляет диагностической ценности из‑за обширной перекрестной реактивности с антигенами других гельминтов. Поэтому серологические исследования не применяют для диагностики аскаридоза.
Дифференциальный диагноз проводят с:
Памятка: профилактика аскаридоза
Простые и вместе с тем крайне эффективные меры — мытье рук теплой водой с мылом перед едой и после посещения туалета, тщательное мытье свежих фруктов и овощей, отказ от питья неочищенной воды — позволяют избежать заражения аскаридами.
Лечение аскаридоза: лекарства и терапия
Как лечить аскаридоз? Медикаментозная терапия, как правило, не начинается во время активной легочной фазы заболевания. Это связано с высоким риском развития тяжелого пневмонита вследствие массовой гибели личинок аскарид. При необходимости легочные симптомы облегчают с помощью бронходилататоров или ингаляционных кортикостероидов.
Антигельминтные препараты, оказывающие на аскарид парализующее действие (пирантел, пиперазин, левамизол), не следует применять у пациентов с полной или частичной кишечной непроходимостью. Вследствие паралича гельминтов обструкция может усугубиться. Поэтому в таких случаях предпочтение следует отдавать альбендазолу и мебендазолу, которые рекомендует ВОЗ для лечения глистной инвазии [11]. Они нарушают биохимические процессы в гельминтах и вызывают их гибель. Схема лечения аскаридоза определяется индивидуально и составляет от 1 до 3 дней.
Некоторые специалисты отдают предпочтение альбендазолу, определяя его как препарат выбора для лечения аскаридоза, так как он имеет более широкий спектр антигельминтной активности, чем мебендазол [12]. В частности, альбендазол эффективен при трихоцефалезе, который может сопутствовать аскаридозу, в то время как мебендазол не действует на возбудителя заболевания (власоглава).
Медикаментозная антигельминтная терапия эффективна только в отношении взрослых аскарид. В связи с этим детей из группы риска следует обследовать повторно через 3 месяца после курса лечения. В эндемичных районах вероятность реинфекции в течение полугода после антигельминтной терапии достигает 80 % [13].
Педиатрические дозировки антигельминтных препаратов от аскаридоза
до 1 года: 0,2 г 2 раза/сутки;
1–3 года: 0,3 г 2 раза/сутки;
4–5 лет: 0,5 г 2 раза/сутки;
6–8 лет: 0,75 г 2 раза/сутки;
9–12 лет: 1 г 2 раза/сутки;
13–15 лет: 1,5 г 2 раза/сутки;
старше 15 лет: 1,5–2 г 2 раза/сутки
детям 1–6 лет: 25–50 мг;
детям 7–14 лет: 50–125 мкг (из расчета 2,5 мг на кг массы тела)*
детям 125 мг на 10 кг массы тела;
подросткам 750 мг
дети старше 2 лет: 400 мг;
дети 1–2 года: 200 мг
дети старше 2 лет: 100 мг 2 раза в сутки**
Препараты для лечения аскаридоза, международные и торговые названия, формы выпуска
| Международное название |
| ≥ 1/10 | ≥ 10 % | Очень часто | ||
≥ 1/100 –ПередозировкаПри случайной передозировке препарата могут появиться боли в животе спазматического характера, головокружение, головная боль, тошнота, рвота и диарея. Хотя максимальная рекомендуемая продолжительность лечения препаратом Вермокс не превышает три дня, имеются сообщения о редких случаях возникновения обратимых нарушений функции печени и нейтропении у пациентов, которые проходили лечение по поводу эхинококкоза массивными дозами препарата в течение длительного периода времени. Специфического антидота не существует. В первый час после приема препарата внутрь можно выполнить промывание желудка. При необходимости можно дать активированный уголь. Взаимодействие с другими лекарственными средствамиСопутствующее применение циметидина может сопровождаться подавлением/угнетением метаболизма мебендазола в печени, что приводит к повышению концентраций лекарственного вещества в плазме, особенно при длительном применении. В последнем случае с целью коррекции дозы рекомендуется определение концентраций препарата в плазме (лекарственный мониторинг концентрации препарата в плазме крови). Необходимо избегать одновременного применения мебендазола и метронидазола. Меры предосторожностиПрименение у детей в возрасте младше 2 лет: Убедительно подтвержденного документальными свидетельствами опыта применения препарата у детей в возрасте младше 2 лет не имеется. Однако получены отдельные сообщения о возникновении судорог у пациентов этой возрастной группы, поэтому использование препарата Вермокс для лечения детей младше 2 лет не рекомендуется. В случае непереносимости лактозы необходимо учитывать, что препарат содержит лактозу. Каждая таблетка препарата содержит 110 мг лактозы моногидрата. Пациенты с редкими наследственными патологиями непереносимости галактозы, лактазной недостаточностью или глюкозо-галактозной мальабсорбцией не должны принимать данный препарат. Результаты исследования случай–контроль случаев синдрома Стивенса Джонсона / токсического эпидермального некролиза (ССД/ТЭН) позволили предположить возможную связь между ССД/ТЭН и сопутствующим использованием мебендазола и метронидазола. Поэтому одновременного применения метронидазола и мебендазола следует избегать. Влияние на способность к управлению транспортными средствами и на работу с механизмами Мебендазол не оказывает влияния на способность к вождению автомобиля и управлению механизмами. Упаковка6 таблеток в блистере из алюминия/ПВХ. 1 блистер в картонной коробке с приложенной инструкцией по применению. Условия храненияХранить при температуре от + 15 °C до + 30 °C. Хранить в недоступном для детей месте. Срок годностиНе применять после истечения срока годности, указанного на упаковке. Условия отпускаГедеон Рихтер Румыния А.О., Тыргу Муреш, Румыния для ОАО «Гедеон Рихтер», Будапешт, Венгрия. Ответственный за выпуск в оборот 1103 Будапешт, ул. Дёмрёи, 19-21, Венгрия Телефон горячей линии (звонок бесплатный): 7-800-555-00777 ТОКСОКАРОЗ: современный подходТоксокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изученаПоловозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер. Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет. Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии. Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный. В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко. У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания. Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома. Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах. Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна. Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия. В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови. Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis. Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии. Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови. При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного. М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения. Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар. Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых. Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар. Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения. Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах. Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов. Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает). Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней. Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.) Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата. Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения. Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход. Включает соблюдение личной гигиены, обучение детей санитарным навыкам. Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак. Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
|