что лучше мексидол или этоксидол уколы
Что лучше мексидол или этоксидол уколы
Острый перитонит в настоящее время представляет собой наиболее опасное и тяжелое осложнение острых хирургических заболеваний и повреждений органов брюшной полости. Несмотря на то что новые методы интенсивной терапии позволяют достаточно эффективно бороться с патологическим процессом в брюшной полости, летальность при этом остаётся достаточно высокой и варьирует, по данным разных авторов, в зависимости от распространённости патологического процесса, в диапазоне от 9 до 67%, а в ряде случаев приближается к 100% [1; 6; 9].
Крайне тяжёлое состояние больных и летальные исходы при остром перитоните уже в ранние сроки, определяемые порой часами с момента заболевания, обусловлены тяжёлым эндотоксикозом. Развитие эндогенной интоксикации (ЭИ) способствует перенапряжению и в итоге угнетению систем естественной детоксикации, в частности детоксикационной функции печени, что является определяющим в тотальном воздействии токсинов на организм и приводит к развитию полиорганной недостаточности – одной из основных причин смерти [1; 4-6].
Кишечник является одним из первых источников эндотоксинов при остром перитоните. Острое воспаление брюшины приводит к парезу кишечника, нарушению его барьерной функции при прогрессировании патологического процесса и в дальнейшем к развитию энтеральной недостаточности, что вносит весомый вклад в прогрессирование интоксикационного синдрома [7; 8].
Известно, что развитие полиорганной недостаточности при остром перитоните тесно коррелирует с интенсивностью процессов перекисного окисления липидов (ПОЛ), коррекция ее может реализоваться через управление этими процессами [3; 4; 10].
Из большого спектра лекарственных средств, обладающих возможностью устранять нарушения в липидном компоненте биомембран, особого внимания заслуживают те, которые обладают антиоксидантными, мембраностабилизирующими и антигипоксантными свойствами 2. Поскольку в каскаде патологических процессов, приводящих к эндотоксикозу, существенную роль играют мембранодестабилизирующие явления, обусловленные гиперактивацией ПОЛ, то становится очевидным необходимость изучения фармакологической эффективности препаратов метаболического типа действия.
В условиях эндогенной интоксикации перитонеального происхождения установить фармакологические эффекты производных 3-оксипиридина этоксидола и мексидола по повышению детоксикационной способности организма.
Материалы и методы исследования
Основой работы явились экспериментальные исследования на 34 взрослых беспородных собаках обоего пола массой от 8,7 до 12,4 кг (3 группы) с одобрения локального этического комитета в соответствии с международными правилами обращения с экспериментальными животными (табл. 1). У 8 здоровых животных изучены исследуемые показатели, которые были приняты за норму.
В послеоперационном периоде всем животным проводили инфузионную терапию (внутривенные введения 5%-ного раствора глюкозы и 0,89%-ного раствора хлорида натрия из расчета 50 мл/кг). В опытных группах в послеоперационном периоде терапия дополнялась внутривенными введениями раствора этоксидола (10 мг/кг) или мексидола (10 мг/кг), разведенного в 50,0 мл 0,89%-ного раствора хлорида натрия (доза составила 5% от ЛД50 с учетом видовой особенности экспериментальных животных).
Таблица 1- Методики исследования, используемые в процессе эксперимента
8 здоровых животных
1. Уровень эндотоксемии в органном и организменном кровотоке оценивали по содержанию молекул средней массы (МСМ) в сыворотке крови.
2. Для характеристики физико-химических свойств альбумина определяли эффективную (ЭКА) и общую (ОКА) концентрацию альбумина в сыворотке крови.
3. Резерв связывания альбумина (РСА) определяли по формуле РСА= ЭКА/ОКА.
4. Индекс токсичности плазмы (ИТ) определяли по формуле ИТ=ОКА/ЭКА-1.
5. Изучали активность процессов ПОЛ в тканевых структурах кишечника и печени по содержанию диеновых и триеновых коньюгатов (ДК и ТК), малонового диальдегида (МДА), индуцированного железом МДА (Fe-МДА).
6. Определяли активность фосфолипазы А2 (ФЛА2) в тканях исследуемых органов.
7. Определяли состояние антиоксидантной системы защиты по активности супероксиддисмутазы (СОД).
8. Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия Стьюдента
I – контроль-ная группа
Острый перитонит на фоне инфузионной терапии
II – опытная группа
Острый перитонит на фоне применения раствора этоксидола (10 мг/кг)
III – опытная группа
Острый перитонит на фоне применения раствора мексидола (10 мг/кг)
Производитель мексидола ЗАО «ЗиО-Здоровье» ООО «НПК «Фармасофт» (Россия) (форма выпуска: раствор – 2 мл (100 мг этилметилгидроксипиридина сукцинат), этоксидола – ЗАО «Медимэкс» ОАО «Синтез» (Россия) (форма выпуска: раствор – 2 мл (100 мг этилметилгидроксипиридина малат).
В работе применялись методы исследования, позволяющие оценить уровень ЭИ, липопероксидации, антиоксидантной системы, фосфолипазы А2 в крови и тканях исследуемых органов (табл. 1).
Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия Стьюдента. Вычисления производили на CPU 1600 MHz Intel Pentium-IV с помощью пакета программ Microsoft Office XP. Использован текстовый процессор Microsoft Word ХР 2003. Динамика показателей отражена на графиках, построенных с использованием программы электронных таблиц Microsoft Excel 2003.
Результаты исследования и их обсуждение
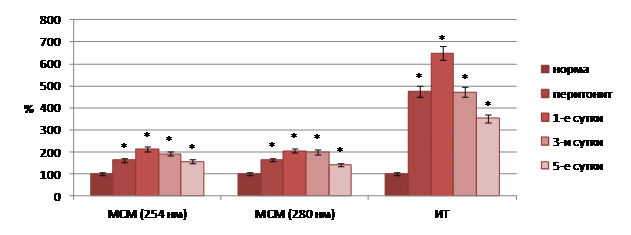
Проведенные исследования показали, что модель острого перитонита была вполне адекватной для решения поставленных задач. В динамике развития патологического процесса отмечалось существенное увеличение в плазме крови содержания токсических продуктов как гидрофильной, так и гидрофобной природы (рис. 1).
Всем нам нужна защита в той или иной степени. Внешняя и внутренняя. Тело и разум довольно хрупки, укреплять и поддерживать их можно по-разному. Даже медикаментозно.
Если человек испытывает отрицательные воздействия (стресс, шок, ишемия, интоксикация, нарушение мозгового кровообращения и т.д.), то врач может назначить ему Мексидол.
Препарат относится к группе гетероароматических антиоксидантов и в своей основе содержит этилметилгидроксипиридина сукцинат, который в свою очередь защищает липиды клеточных мембран и снижает уровень свободных радикалов в организме. Это значительно расширяет спектр фармакологического действия. Мексидол оказывает антигипоксический (насыщает кровь кислородом), антистрессовый, противосудорожный эффект. Также он имеет ноотропные свойства, предупреждает и уменьшает нарушения памяти, повышает концентрацию внимания и работоспособность, ослабляет проявление алкогольной интоксикации. Восстанавливает цикл сон-бодрствование, улучшает метаболизм тканей мозга и их кровоснабжение, улучшает микроциркуляцию и реологические свойства крови (ее текучесть), снижает скорость дистрофических и морфологических изменений в головном мозге. Имеет выраженный терапевтический эффект в лечении болезни Паркинсона. Мексидол улучшает функциональное состояние ишемизированного миокарда и адаптивные возможности организма человека при воздействии различных стрессовых факторов.
А еще Мексидол повышает содержание в головном мозге дофамина, так называемого “гормона радости”.
Показания
В неврологии Мексидол применяется в следующих случаях:
В психиатрии Мексидол назначается:
Также Мексидол применяется при острых гнойно-воспалительных процессах брюшины (некротическом панкреатите и перитоните) в составе комплекса терапевтических способов лечения.
Противопоказания
Препарат нельзя применять при:
Побочные эффекты
Несмотря на положительную реакцию организма на прием Мексидола и его низкую токсичность, у лекарства все же есть побочные эффекты.
Как принимать Мексидол
Мексидол в таблетированной форме принимают перорально. Таблетку не разжевывают и не делят пополам. Запивать ее стоит большим количеством воды. Прием пищи на активность медикамента никакого влияния не оказывает, поэтому принимать Мексидол можно до, во время или после еды.
Обратите внимание, что после приема Мексидола может возникнуть сонливость, поэтому стоит соблюдать осторожность за рулем, а также при занятии другими потенциально-опасными видами деятельности.
Острое нарушение мозгового кровообращения (ОНМК)
Первично в течение 10-14 дней
200-500 мг (в/в капельно) от 2 до 4 раз/сут, затем еще 14 дней 200-250 мг (в/м) несколько раз/сут
Первично в течение 2-х недель
Легкие когнитивные отклонения
Курс от 2 недель до месяца
От 200 до 500 мг/сут (в/в)
Острый отечный (интерстициальный) панкреатит
200-500 мг (в/в капельно и в/м) 3 раза/сут
Некротический панкреатит (легкая степень)
100-300 мг/сут (в/в капельно и в/м 3 раза/сут
Некротический панкреатит (средняя степень)
200 мг (в/в) 3 раза/сут
Некротический панкреатит (тяжелая степень)
Некротический панкреатит (крайне тяжелая степень)
Открытоугольная глаукома различных стадий
Черепно-мозговая травма и последствия черепно-мозговых травм
*При приеме таблеток. В скобках указан способ введения инъекции Мексидола в той же дозировке.
При остром инфаркте миокарда в составе комплексной терапии вводят внутривенно (первые 5 суток) и внутримышечно (последующие 9 суток) в течение 14 суток на фоне традиционной терапии инфаркта миокарда, включающей нитраты, бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (АПФ), тромболитики, антикоагулянтные и антиагрегантные средства, а также симптоматические средства по показаниям.
Мексидол при беременности и лактации
Зачастую лекарственные препараты для беременных женщин и кормящих мам назначаются с осторожностью, а также в случаях, когда польза для матери превышает риски для плода и новорожденного. С Мексидолом та же история. Статистически достоверных исследований применения препарата у беременных женщин, кормящих мам и детей нет. То есть клинических исследований, на которое можно было бы опираться, увы, не существует. Поэтому препарат либо назначают в крайнем случае, либо не рекомендуют его применять.
Что касается детей, то применение Мексидола в педиатрии показано при лечении гнойных нейроинфекций, черепно-мозговых травм, а также для оказания скорой помощи в случае детских черепно-мозговых травм (100 мг однократно).
Взаимодействие
Мексидол показал себя как препарат, имеющий высокую совместимость с другими лекарствами, в том числе применяемыми для лечения соматических заболеваний. Но стоит отметить, что Мексидол способен усиливать действие бензодиазепинов, карбамазепина и средств для лечения болезни Паркинсона, анальгетиков, транквилизаторов, нейролептиков и антидепрессантов, а также веществ со снотворным и противосудорожным действием. Это позволяет уменьшить их дозы и снять большинство побочных эффектов.
Мексидол снижает токсичность этилового спирта. Это полезное свойство применяется при лечении абстинентного алкогольного синдрома.
Мексидол и алкоголь
Как сказано выше, Мексидол применяется в качестве терапии при избавлении от алкогольной зависимости. Препарат снижает токсическое действие алкоголя, выводит его из организма. Но это не значит, что во время приема Мексидола можно употреблять спиртные напитки. Активное вещество Мексидола, проникая в ткани печени и головного мозга, лишь купирует признаки интоксикации, но при этом не защищает сами клетки. То есть действие выпитого алкоголя Мексидолом не нейтрализуется и наносит вред организму.
Аналоги
Фармацевтический рынок предлагает не только Мексидол, но и его аналоги. Различаются препараты основным веществом (хотя синонимы Мексидола содержат все тот же этилметилгидроксипиридина сукцинат), вспомогательными компонентами, производителями, качеством очистки используемого сырья. Именно поэтому после консультации врача в аптеках можно подобрать лекарственные препараты, которые по своему терапевтическому действию похожи с таблетками Мексидол, но подобраны для конкретной клинической картины.
К таблеткам-синонимам Мексидола относятся:
По терапевтическому эффекту аналогичными для раствора являются препараты:
Терапевтический эффект может быть обеспечен и другими действующими веществами. Но не всегда аналоги по эффекту могут идеально заменить выбранный врачом препарат, поэтому замена возможна только после консультации.
Так, к аналогам по эффекту относят следующие медикаменты:
Метаболические лекарственные средства в кардиологической практике
Основным патологическим состоянием, возникающим при многих заболеваниях сердечно-сосудистой системы, в частности при ишемической болезни сердца (ИБС), является гипоксия. Клинические данные свидетельствуют о том, что перспективным направлением в борьбе с г
Основным патологическим состоянием, возникающим при многих заболеваниях сердечно-сосудистой системы, в частности при ишемической болезни сердца (ИБС), является гипоксия. Клинические данные свидетельствуют о том, что перспективным направлением в борьбе с гипоксией является использование фармакологических средств, уменьшающих гипоксию и повышающих устойчивость организма к кислородной недостаточности.
Особый интерес представляют лекарственные средства метаболического действия, целенаправленно влияющие на обменные процессы при гипоксии. Это препараты различных химических классов, их действие опосредуется различными механизмами: улучшением кислород-транспортной функции крови, поддержанием энергетического баланса клеток, коррекцией функции дыхательной цепи и метаболических нарушений клеток тканей и органов [5, 8, 11]. Подобными свойствами обладают антигипоксанты (Актовегин, Гипоксен, Цитохром С), антиоксиданты (Убихинон композитум, Эмоксипин, Мексидол) и цитопротекторы (триметазидин), которые широко используются в клинической практике [3, 9, 12–15].
Антигипоксанты
Антигипоксанты — препараты, способствующие улучшению утилизации организмом кислорода и снижению потребности в нем органов и тканей, суммарно повышающие устойчивость к гипоксии.
Актовегин — мощный антигипоксант, активирующий метаболизм глюкозы и кислорода. Антиоксидантное действие Актовегина обусловлено высоко супероксиддисмутазной активностью, подтвержденной атомно-эмиссионной спектрометрией [1, 4]. Суммарный эффект всех этих процессов заключается в усилении энергетического состояния клетки, особенно в условиях исходной ее недостаточности.
Накопленный клинический опыт отделений интенсивной терапии позволяет рекомендовать введение высоких доз Актовегина: от 800–1200 мг до 2–4 г для профилактики синдрома реперфузии при остром инфаркте миокарда, после проведения тромболитической терапии или балонной ангиопластики, при тяжелой хронической сердечной недостаточности (ХСН) [4, 6].
Гипоксен — антигипоксант, улучшающий переносимость гипоксии за счет увеличения скорости потребления кислорода митохондриями и повышения сопряженности окислительного фосфорилирования. Его применение возможно при всех видах гипоксии.
Цитохром С — ферментный препарат, является катализатором клеточного дыхания. Железо, содержащееся в Цитохроме С, обратимо переходит из окисленной формы в восстановленную, в связи с чем применение препарата ускоряет ход окислительных процессов. При применении препарата возможны аллергические проявления.
Антиоксиданты
Антиоксиданты — соединения различной химической природы, способные обрывать цепь реакций свободнорадикального перекисного окисления липидов или непосредственно разрушать молекулы перекисей. Антиоксиданты участвуют в уплотнении структуры мембраны, что уменьшает доступность кислорода к липидам.
Убихинон (коэнзим Q10) — эндогенный антиоксидант и антигипоксант с антирадикальным действием. Он защищает липиды биологических мембран от перекисного окисления, предохраняет ДНК и белки организма от окислительной модификации.
Защитная роль коэнзима Q10 при ИБС обусловлена его участием в процессах энергетического метаболизма кардиомиоцита и антиоксидантными свойствами. Клинические исследования последних десятилетий показали терапевтическую эффективность коэнзима Q10 в комплексном лечении ИБС, артериальной гипертензии, атеросклероза и синдрома хронической усталости [2, 3]. В терапии больных ИБС Убихинон композитум может сочетаться с бета-адреноблокаторами и ингибиторами ангиотензинпревращающего фермента (ИАПФ). Накопленный клинический опыт позволяет рекомендовать применение коэнзима Q10 и как средство профилактики сердечно-сосудистых заболеваний. Лечебные дозы Убихинона составляют 30–150 мг/сут, профилактические — 15 мг/сут.
Препарат малоэффективен у больных с низкой толерантностью к физической нагрузке, при наличии высокой степени стенозирования коронарных артерий.
Эмоксипин является синтетическим антиоксидантным средством, обладающим широким спектром биологического действия. Он ингибирует свободнорадикальное окисление, активно взаимодействует с перекисными радикалами липидов, гидроксильными радикалами пептидов, стабилизирует клеточные мембраны. Может комбинироваться с изосорбида-5-мононитратом, что позволяет достичь большего антиангинального и противоаритмического эффектов, предотвратить развитие сердечной недостаточности.
Мексидол — оксиметилэтилпиридина сукцинат. Подобно Эмоксипину, Мексидол является ингибитором свободнорадикальных процессов, но оказывает более выраженное антигипоксическое действие.
Основные фармакологические эффекты Мексидола: активно реагирует с перекисными радикалами белков и липидов; оказывает модулирующее действие на некоторые мембрансвязанные ферменты (фосфодиэстеразу, аденилатциклазу), ионные каналы; обладает гиполипидемическим действием, снижает уровень перекисной модификации липопротеидов; блокирует синтез некоторых простагландинов, тромбоксана и лейкотриенов; оптимизирует энергосинтезирующие функции митохондрий в условиях гипоксии; улучшает реологические свойства крови, подавляет агрегацию тромбоцитов.
Клинические исследования подтвердили эффективность Мексидола при расстройствах ишемического генеза, в том числе при различных проявлениях ИБС.
Цитопротекторы
В последнее время возрос интерес к метаболическому направлению в лечении стабильных форм ИБС. Метаболически действующие препараты потенциально могут сохранить жизнеспособность миокарда (гибернирующий миокард) до проведения операции по восстановлению коронарного кровотока. Метаболическая терапия направлена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии. Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным подходом к лечению больных ИБС.
Возможные пути цитопротекции:
Из известных в настоящее время миокардиальных цитопротекторов наиболее изученным препаратом с доказанными антиангинальным и антиишемическим действиями является триметазидин, реализующий свое действие на клеточном уровне и воздействующий непосредственно на ишемизированные кардиомиоциты. Высокая эффективность триметазидина в лечении ИБС объясняется его прямым цитопротекторным антиишемическим действием. Триметазидин, с одной стороны, перестраивает энергетический метаболизм, повышая его эффективность, с другой — уменьшает образование свободных радикалов, блокируя окисление жирных кислот [10, 13].
Механизм действия триметазидина связан:
Указанные процессы помогают сохранить в кардиомиоцитах необходимый уровень АТФ, снизить внутриклеточный ацидоз и избыточное накопление ионов кальция.
Таким образом, противоишемическое действие триметазидина осуществляется на уровне миокардиальной клетки за счет изменения метаболических превращений, что позволяет клетке повысить эффективность использования кислорода в условиях его сниженной доставки и таким образом сохранить функции кардиомиоцита.
Триметазидин на российском фармацевтическом рынке представлен такими препаратами, как «Предуктал» (Франция), «Триметазид» (Польша), «Триметазидин», «Римекор» (Россия).
В многочисленных исследованиях убедительно продемонстрирована высокая антиангинальная и антиишемическая эффективность триметазидина у больных ИБС как при монотерапии, так и в комбинации с другими лекарственными средствами [14, 17, 18]. Препарат не менее эффективен в лечении стабильной стенокардии, чем бета-адреноблокаторы или антагонисты кальция, однако наибольшую эффективность он проявляет в сочетании с основными гемодинамическими антиангинальными препаратами. К преимуществам триметазидина относится отсутствие гемодинамических эффектов, что позволяет назначать препарат независимо от уровня артериального давления, особенностей сердечного ритма и сократительной функции миокарда.
Триметазидин может быть назначен на любом этапе лечения стенокардии в составе комбинированной антиангинальной терапии для усиления эффективности бета-адреноблокаторов, антагонистов кальция и нитратов у следующих категорий больных:
Триметазидин позволяет уменьшить дозу препаратов, оказывающих побочные действия, улучшая общую переносимость лечения.
Важными моментами являются отсутствие противопоказаний, лекарственной несовместимости, а также его хорошая переносимость. Нежелательные реакции возникают очень редко и всегда слабо выражены. Это позволяет применять препарат лицам пожилого возраста, при наличии сахарного диабета и других сопутствующих заболеваний.
Данных о влиянии триметазидина на отдаленные исходы и сердечно-сосудистую смертность у больных ИБС пока нет, поэтому целесообразность его назначения в отсутствие стенокардии или эпизодов безболевой ишемии миокарда не установлена.
Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным подходом к лечению больных ХСН. Метаболическая терапия у таких больных должна быть нацелена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии. Однако работ, посвященных изучению особенностей действия триметазидина у больных ХСН, крайне мало [7, 11, 16].
В связи с этим на кафедре клинической фармакологии и фармакотерапии ФППОВ ММА им. И. М. Сеченова было проведено исследование с целью определить пределы и возможности триметазидина в комплексной терапии больных ХСН, осложнившей течение ИБС.
В исследование было включено 82 больных ХСН II–III функциональных классов по NYHA, осложнившей течение ИБС. В их числе было мужчин — 67, женщин — 15, средний возраст составил 62,2 ± 7,3 года. Перед включением в исследование у всех пациентов была достигнута стабилизация состояния на фоне терапии сердечными гликозидами, диуретиками, бета-адреноблокаторами в индивидуально подобранных дозах. Все больные были распределены в две группы: в первую (основную) группу вошли 40 больных, которым к комплексной терапии был добавлен триметазидин в дозе 60 мг/сут и ИАПФ эналаприл в дозе 5–10 мг/сут; вторую (контрольную) группу составили 42 больных, которым к комплексной терапии был добавлен только эналаприл без триметазидина. Между группами не было достоверных различий по возрасту, полу, давности заболевания, ФК ХСН. Длительность наблюдения составила 16 нед.
Клиническую эффективность терапии оценивали по динамике функционального класса ХСН. Всем больным проводилось холтеровское мониторирование ЭКГ с оценкой среднесуточной частоты сердечных сокращений (ЧСС), общего количества эпизодов депрессии сегмента ST, максимальной величины депрессии сегмента ST. Тренды сегмента ST расценивались как ишемические при его горизонтальном снижении не менее чем на 1 мм относительно точки J продолжительностью 1 мин и более. Антиишемический эффект считали достоверным, если количество эпизодов ишемии миокарда уменьшалось на 3 и более и/или суммарная депрессия сегмента ST сокращалась на 50% и более. Также оценивался характер нарушений ритма сердца: количество изолированных желудочковых экстрасистол (ЖЭ), парных ЖЭ, наджелудочковых экстрасистол (НЖЭ), эпизодов неустойчивой желудочковой тахикардии (ЖТ), пробежек наджелудочковой тахикардии (НЖТ). Критериями антиаритмического эффекта считали уменьшение изолированных ЖЭ на 50%, парных ЖЭ — на 90% при полном устранении эпизодов ЖТ.
Для оценки толерантности к физической нагрузке больным проводился тредмил-тест. Критериями положительной пробы являлись типичный приступ стенокардии и/или стойкая горизонтальная депрессия сегмента ST на 1 мм и более. При анализе результатов тредмил-теста оценивались максимальная мощность выполненной нагрузки и общая продолжительность нагрузки.
С целью оценки состояния внутрисердечной гемодинамики пациентам проводилось эхокардиографическое исследование с оценкой следующих морфофункциональных параметров сердца: размер левого предсердия (ЛП), см; конечно-диастолический размер (КДР)Я, см; конечно-систолический размер (КСР), см; фракция выброса (ФВ) левого желудочка, %.
Клинические и инструментальные исследования проводили до и через 16 недель непрерывной терапии.
Статистический анализ полученных данных проводили с использованием стандартных методов статистики, включая вычисление непарного критерия t Стьюдента. Все данные представлены в виде средних стандартных отклонений (М ± m).
Анализ динамики ФК ХСН показал, что через 16 недель лечения у 28% больных первой группы и у 26% больных второй группы было достигнуто улучшение клинического состояния и переход в более низкий ФК ХСН. Количество больных III ФК уменьшилось в первой группе с 50 до 27,5%, во второй — с 64,3 до 30,9%. Количество больных II ФК увеличилось до 67,5 и 66,7% соответственно. На фоне лечения в обеих группах появились больные I ФК: 5% — в первой группе и 2,4% — во второй. В целом ФК ХСН снизился на 11% (р 0,05) и 6,9% (р > 0,05) соответственно, количество НЖЭ — на 26,4% (р 0,05) и 10,8% (р > 0,05) соответственно.
Ни у одного больного, получавшего терапию триметазидином, не было зарегистрировано вновь появившихся парных ЖЭ или эпизодов неустойчивой ЖТ.
По данным холтеровского мониторирования ЭКГ отмечено и достоверное уменьшение суточного количества эпизодов депрессии сегмента SТ в первой группе на 55,5% (р
Т. Е. Морозова, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва