что лучше фамвир или валацикловир
Действенные препараты от герпеса, которые рекомендуют купить вирусологи
У большинства людей герпетическая инфекция протекает в неосложненной форме и не требует узконаправленной терапии. Но болячки, вылезающие возле губ, носа или на подбородке, доставляют мало радости, болезненны и портят внешность. Особенно если появляются они слишком часто. На помощь в этих случаях приходит группа лекарств специального противогерпесного действия.
Когда требуется принимать таблетки от герпеса
Когда требуется принимать таблетки от герпеса
На свой страх и риск покупать медикаменты вряд ли стоит. Ведь большинство из них вызывают разносторонние побочные эффекты и могут добавить проблем к уже имеющейся. Кроме того, вылечить ими герпес навсегда не получится. Его возбудитель относится к простым вирусам, пребывающим в организме постоянно. Если заражение произошло, чужеродные клетки подавляются иммунитетом. Но когда тот ослабевает, они провоцируют развитие воспалений на коже лица, реже — на теле и слизистых. Оральный герпес, которым поражено более 90% населения мира, вызывает знакомую всем «лихорадку»:
скопление зудящих красных пузырьков;
зуд пораженной области;
образование плотных корочек на месте лопающихся волдырей.
Передается инфекция легко — контактным путем: при касании, объятиях, поцелуях, вместе с частичками слюны. Вирус ветряной оспы также относится к герпетическим. Подхватить его не болевшим ранее людям еще проще — он перемещается с пылевыми частицами в воздухе.
Медикаментозные средства не избавляют от возбудителя, но облегчают острое течение болезни, ускоряют подавление вируса иммунными клетками, уменьшают болезненную симптоматику: зуд, раздражение, общую лихорадку. Применять их необходимо:
людям с ослабленной иммунной системой, в том числе больным ВИЧ, онкологическими патологиями;
при генерализованном поражении организма: обильных высыпаниях по всему телу, которая сопровождается высокой температурой, слабостью, головными болями;
при регулярных обострениях герпеса: по несколько раз в год;
при длительно не заживающих язвах, опасной их локализации: в области половых органов, возле глазных век, в ротовой полости;
при хронических заболеваниях, которые могут усугубиться под влиянием вируса.
В каждом случае врач назначает препараты с учетом возраста, особенностей здоровья, физического состояния пациентов и сопутствующих курсов терапии, которые они проходят. Более эффективными считаются препараты от герпеса в таблетках. Они обладают свойством действовать системно: подавлять вирус сразу во всем организме. При неосложненной форме инфекции можно использовать местные средства в виде мазей или кремов.
Ацикловир
Лекарственное средство, содержащее сильный противовирусный компонент. Подавляет герпес ВПГ-1 и 2, разрушая их генетический аппарат. Ацикловир эффективен также против возбудителя ветряной оспы, облегчает и укорачивает симптомы этой болезни. Фармацевтическая промышленность выпускает несколько препаратов с ацикловиром:
таблетки аналогичного состава Зовиракс и Ацикловир;
мазь Ацикловир: с концентрацией активного вещества 3 и 5%.
Препарат местного действия можно применять в лечении детей с 3 лет, нанося на воспаленные участки кожи. Ацикловир лучше антисептиков снижает болезненность, зуд, устраняет покраснения.
Таблетки рекомендуются взрослым пациентам и подросткам. Принимать их следует курсом до 2 недель несколько раз в сутки. В период терапии вероятны головокружения, повышенная нервная возбудимость, тошнота, нарушения зрения. Ацикловир токсичен для почек и должен применяться в индивидуальной дозировке.
Валтрекс
Эффективный антивирусный препарат с активным веществом под наименованием валацикловир. Помогает ослабить все виды герпеса: орального, генитального, возбудителя ветряной оспы и опоясывающего лишая. Предназначен для лечения больных с 12 лет. Выпускается в форме таблеток и жидкого раствора.
В период терапии важно дозировать количество медикаментозного средства и строго следовать инструкции, так как валацикловир действует на нервную систему, печень и почки. Среди побочных эффектов: головные боли, бессонница, одышка, аритмия, снижение аппетита, тошнота и рвота.
Фамвир
Средство от герпеса в таблетках на основе активного вещества фамцикловир. Можно купить аналоги под торговыми марками:
Действующее вещество препаратов блокирует распространение и размножение вирусов орального, генитального типов, уменьшает поражение кожи при ветряной оспе и опоясывающем лишае. Фамцикловир уменьшает симптоматику заболевания, снижает ее продолжительность, предупреждает серьезные поражения организма. Фамвир и его аналоги имеют пролонгированное действие, поэтому принимать их можно не чаще двух раз в сутки. Как большинство препаратов от герпеса, они влияют на работу нервных волокон, опасны для печени и почек. Лечиться им следует с 18 лет. Дозировку таблеток нужно обсуждать с врачом. Беременным и кормящим женщинам Фамвир противопоказан.
Изопринозин
Таблетированный антивирусный препарат на основе вещества пранобекс. Оказывает иммуномодулирующий эффект, стимулирует выработку глобулинов и лимфоцитов, блокирует распространение возбудителя герпеса в организме. Усиливает действие ацикловира, назначается при тяжелых или длительно протекающих инфекциях. Назначается также для профилактики генерализованных форм. Общий курс приема таблеток — около 10 суток.
Осторожность при терапии препаратом Изопринозин необходима при недостаточности печени, почек, заболеваниях ЦНС и суставов.
Денавир
Лекарственное средство местного применения в виде крема. Содержит активный компонент пенцикловир — 10 мл на 1 г. препарата. Денавир предназначен для лечения герпетической инфекции на кожных покровах. Наносить его необходимо до 4 раз в день в течение 7–10 дней. Среди побочных эффектов препарата: обесцвечивание кожи, жжение, сухость.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Иммуномодуляторы в лечении хронической рецидивирующей инфекции, вызванной вирусами простого герпеса
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Теоретически идеальным вариантом химиотерапии был и остается механизм прямой инактивации вирусной ДНК, но из-за неизбежного общего токсического, цитопатического и канцерогенного эффекта этот способ для клинического использования оказался неприемлемым [8]. Поэтому был разработан менее опасный способ инактивации вирусной ДНК — подавление активности вирусных ферментов, обеспечивающих жизнедеятельность ДНК. Наиболее безопасным вариантом оказалось создание синтетических аналогов нуклеозидов герпесвирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирусспецифическим ферментом — тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или нежизнеспособности вирусной ДНК [1]. Первый лечебный синтетический нуклеозид — ацикловир (ациклический аналог гуанозина) — стал «золотым стандартом» противогерпетической химиотерапии. Ацикловир, будучи включен в какой-либо участок новой ДНК, никогда не заменяется естественным гуанином [13]. В последнее время синтезированы и широко используются новые противовирусные препараты этой группы — валтрекс и фамвир.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва
По вопросам литературы обращайтесь в редакцию
Фамцикловир в лечении герпетических инфекций
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Центральный научно-исследовательский кожно-венерологический институт МЗ РФ, Москва
В инфекционной патологии человека герпесвирусам отводится важная роль ввиду их широкого распространения в популяции, склонности к пожизненному персистированию в организме и способности вызывать острую, хроническую и латентную форму заболевания. Многочисленными исследованиями показано, что вирусами простого герпеса инфицировано 65–90% взрослого и детского населения планеты. По сравнению с 1980–ми годами к концу тысячелетия число зарегистрированных больных герпесом возросло в США на 13–40%, в странах Европы – на 7–16%. Так, за 1999 год в мире зарегистрировано 86 млн. больных генитальным герпесом – наиболее распространенного заболевания среди инфекций, передающихся половым путем (ИППП). В России обращаемость к врачам различных специальностей (дерматологам, гинекологам, урологам) по поводу генитального герпеса составляет не более 15% от реальной частоты. Заболеваемость за последние 5 лет увеличилась более чем в 2 раза, а общее число больных составляет около 8 млн человек (Хахалин Л.Н.,1999).
| В России насчитывается 8 млн больных генитальным герпесом. |
За последние годы были достигнуты значительные успехи в лечении герпеса благодаря внедрению в клиническую практику синтетических нуклеозидов, среди которых перспективным является фамцикловир (Фамвир).
Фамцикловир является предшественником пенцикловира и обладает рядом существенных преимуществ по сравнению с ацикловиром:
• высокое сродство к тимидинкиназе вируса (в 100 раз выше) и более выраженное блокирование репликации вируса между приемами препарата;
• фамцикловир обладает самой высокой биодоступностью (77% против 10–20% у ацикловира) и самым длительным периодом нахождения в инфицированной вирусом клетке (до 20 часов);
• постоянная концентрация препарата в инфицированных клетках обеспечивает длительный противовирусный эффект и дает возможность реже принимать препарат;
• фамцикловир обладает свойством проникать в шванновские клетки, окружающие нервные волокна. В клетках, инфицированных ВЗВ, периоды полувыведения составляют 9 часов для фосфорилированного пенцикловира и 0,8 часа для фосфорилированного ацикловира [6,7,8]. Поэтому фамцикловир является единственным противовирусным препаратом, уменьшающий длительность постгерпетической невралгии при опоясывающем лишае (на 100 дней по сравнению с плацебо) (рис. 1).
Рис. 1. Длительность постгерпетической невралгии при опоясывающем лишае.
Для врачей–клиницистов важное практическое значение имеет высокая клиническая эффективность Фамвира при генитальном герпесе:
• фамвир уменьшает количество рецидивов на 80% (рис. 2) [11];
• обусловливает отсутствие рецидивов почти у одной трети пациентов;
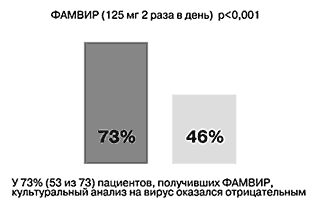
• предупреждает распространение вируса (у 73% пациентов, получавших фамвир, культуральный анализ на вирус оказался отрицательным по сравнению с 46% пациентов, получавших плацебо) (рис. 3) [12];
• уменьшает сроки распространения вируса до 1,8 дня по сравнению с 3,4 днями в группе плацебо (Р Рис. 2. Фамвир уменьшает количество рецидивов на 80%.
Рис. 3. Фамвир способен останавливать распространение вируса.
Стратегия лечения больных генитальным герпесом определяется рядом факторов: частотой рецидивов и тяжестью клинических проявлений заболевания, а также наличием психосоциальных проблем и риска передачи инфекции половому партнеру или новорожденному.
В настоящее время существует два подхода к лечению: эпизодическая или профилактическая (супрессивная) терапия. Целями лечения являются купирование острых симптомов заболевания, уменьшение частоты и тяжести рецидива, предупреждение реактивации вируса и улучшение качества жизни пациента. Эпизодическая терапия проводится только в период обострения заболевания и значительно уменьшает боль, дискомфорт в зоне поражения, сокращает время заживления герпетических высыпаний, а также сокращает период вирусовыделения до 1,8 дня по сравнению с 3,4 днями в группе плацебо.
В США Центром по контролю и профилактике заболеваний (CDC) Фамцикловир одобрен как средство эпизодического лечения рецидивов генитального герпеса в дозе 125 мг два раза в день в течение 5 дней, при первом эпизоде генитального герпеса фамвир рекомендован по 250 мг 3 раза в день в течение 5–10 дней [5,9,10].
По результатам многоцентрового исследования, проведенном Merz с сотр. (1997), включавшем 375 женщин, имевших в анамнезе не менее 6 рецидивов генитального герпеса, прием фамцикловира в дозе 250 мг два раза в день в течение 4 месяцев оказался наиболее эффективным: предотвращение рецидивов наблюдалось у 90 % пациенток данной группы в сравнении с другими режимами дозирования и приема препарата, а также с группой плацебо [9,10].
В другом исследовании, проведенном Diaz–Mitoma с сотр. (1998), подавляющую (супрессивную) терапию фамцикловиром осуществляли в течение 1 года введением 125 мг препарата 3 раза в день, 250 мг 2 раза в день, 250 мг 3 раза в день или плацебо. Все три дозы фамцикловира значительно отдаляли появление клинически подтверждаемого рецидива. В группе, получавшей 250 мг 2 раза в день, медиана интервала времени до появления первого рецидива составила 336 дней в сравнении с группой плацебо, в которой аналогичный показатель был равен 47 дням. У 72% больных, получавших терапию фамцикловиром, рецидивы генитального герпеса в течение 1 года после начала лечения не наблюдались. В группе без лечения (плацебо) таких больных было всего 22%. Таким образом было показано, что фамцикловир эффективен в качестве средства профилактической терапии рецидивов генитального герпеса в дозе 250 мг 2 раза в день [9,10].
Назначение фамцикловира дает возможность уменьшения суточной и курсовой доз препарата в 5 раз, по сравнению с ацикловиром: курсовая доза у фамцикловира – 5,25 г, у ацикловира – 28,0 г. Данное обстоятельство особенно актуально при лечении пожилых пациентов. Необходимо отметить, что лечение наиболее эффективно при назначении фамвира в первые 48 ч с момента появления высыпаний [3,8].
В ГУ ЦНИКВИ МЗ РФ также было проведено клинико–лабораторное изучение эффективности фамцикловира при генитальном герпесе [2]. Монотерапия рецидивов была проведена у 110 больных (62 мужчин и 48 женщин) в возрасте от 18 до 50 лет. Давность заболевания варьировала от нескольких месяцев до 10 лет, длительность рецидивов составила от 5 до 21дней. 79 больных (71,8%) имели тяжелое течение генитального герпеса (рецидивы 1–2 раза в месяц и ремиссии менее 6 недель), 28 пациентов (25,5%) – заболевание средней тяжести (обострения 1 раз в 2–3 месяца и ремиссии 2–3 месяца), легкое течение заболевания (1–3 рецидива в год, ремиссии не менее 4 месяцев) наблюдалось только у 3 пациентов (2,7%).
Результаты исследования подтвердили высокую эффективность фамвира в лечении генитального герпеса. Монотерапия рецидивов ГГ фамцикловиром в курсовой дозе 2,5 г сокращала длительность рецидивов герпеса более, чем в 2 раза – с 8,7 до 3,8 дней (Р Выводы
1.Фамцикловир является высокоэффективным препаратом для лечения и профилактики рецидивов генитального герпеса и опоясывающего лишая.
2. Фамцикловир обладает анальгезирующим действием, особенно выраженном при опоясывающем лишае.
3. Фамцикловир является единственным противовирусным препаратом, уменьшающим длительность постгерпетической невралгии при опоясывающем лишае.
4. Супрессивная терапия фамвиром в течение 1 года уменьшает количество рецидивов генитального герпеса на 80% и отсутствие рецидивов почти у трети пациентов.
5. При генитальном герпесе фамвир предупреждает распространение вируса и уменьшает сроки распространения вируса.
6. 30% штаммов вирусов, резистентных к ацикловиру, чувствительны к терапии фамвиром.
1. Яцуха М.В., Губанова Е.И., Масюкова С.А. Динамика заболеваемости генитальным герпесом и деятельность ЛПУ в Москве и Московской области. Актуальные проблемы дерматологии и венерологии.Сб.научных работ.Москва, 2000, с.94–95
2. Владимирова Е.В. Эффективность фамцикловира в лечении рецидивирующего генитального герпеса (клинико–лабораторное исследование).Дисс. канд.мед.наук., Москва, 1998, 110 с.
3. Gross G. Herpes – simplex – Virus und Varicella – Zoster – Virus – Infektionen // “Dermatologie, heutiger Stand”, Stuttgart – New – York, Georg Thieme Verlag, – 1995, s.43 – 50.
5. Centers for Disease Control and Prevention. 1998.CDC 1998. Guidelines for treatment of Sexually Transmitted Diseases. Morb.Mortal.Wkly.Rep.47,1–118.
6. Earnshaw D.L., Bacon T.H., Darlison S.J. et al. Penciclovir mode of action studies in HSV – I. HSV – 2 and VZV infected MRC – 5 cells, providing a rationale for its persistent antiviral activity.// Antimicrob Agents Chemother, 1992, 36: p.2747 – 57.
7. Pue M.A., Benet L2.Pharmacokinetiks of famciclovir in man // Antiviral Chem Chemother, – 1993, – (Suppl. 1) – p.47 – 55.
8. Degreef H, Famciclovir Herpes Zoster Clinical Study Group. Famciclovir, a new oral antiherpes drug: results of the first controlled clinical study demonstrating its efficacy and safety in the treatment of uncomplicated herpes zoster in immunocompetent patients // Int.J. Antimicrob Agents, – 1994, – 4: p.241 – 6.
9. Stanberry L. et al. Antiviral Research 42(1999), 1–14
10. Leung D.T, Sacks S.L. Current Recomendations for the treatment of genital herpes//Drags, 2000, Dec;60 (6): 1329–1352
11. Diaz–Mitoma F et al. Oral famciclovir for the supression of recurrent genital herpes: a randomized controlled trial. JAMA. 1998; 280: 887–892
12. Saks SL et al. Patient–initiated, twice–daily oral famciclovir for early recurrent genital herpes: a randomized double–blind multicenter trial. JAMA. 1996; 276: 44–49.